2. 浙江大学生命科学研究院, 杭州 310058
2. Life Sciences Institute, Zhejiang University, Hangzhou 310058
番茄环纹斑点病毒(Tomato zonate spot virus, TZSV)属于布尼亚病毒科(Bunyaviridae), 番茄斑萎病毒属(Tospovirus), 自2005年发现以来, 一直是云南番茄、辣椒、烟草等经济作物的重要病原[1], 由蓟马传毒为害[2]。TZSV与其它番茄斑萎病毒属病毒类似, 基因组为单链线状三分体RNA:S RNA、M RNA、L RNA。S RNA正链编码非结构蛋白NSs, 负链编码核壳体蛋白N;M RNA正链编码移动蛋白NSm, 负链编码糖蛋白Gn/Gc;L RNA负链编码病毒的复制酶RdRp。
TZSV为球形病毒, 直径约80-120 nm, 具有双层脂膜组成的包膜, 包膜表面有Gn/Gc糖蛋白构成的突起。相关证据表明Gn/Gc糖蛋白是Tospovirus病毒与蓟马识别的关键蛋白[3]。Gn/Gc蛋白是由前体蛋白G经剪切而形成的, TZSV的前体蛋白G大小为3 369 bp, 编码1 122 aa, 其中, 氨基酸1-25位为信号肽, 经剪切后, 进一步在高尔基内进行N-糖基化修饰形成成熟的Gn蛋白和Gc蛋白。对同为布尼亚病毒科的汉坦病毒(Hantavirus)研究显示:Gn和Gc结构相似, 均由胞外区、跨膜区及C末端胞质尾区(GP-CT)3部分组成[4]。由于Gn是膜蛋白, 具有跨膜结构域, 用全长Gn不能顺利表达出目的蛋白。本研究通过生物信息学的方法, 预测Gn蛋白的抗原表位和跨膜结构域, 通过选择Gn蛋白的非跨膜区进行Gn的原核表达, 并通过免疫家兔得到了专一性的Gn蛋白多抗血清, 旨为研究TZSV与蓟马互作奠定基础。
1 材料与方法 1.1 材料TZSV感染的番茄由本实验室保存。Marker DL2000、pMD Simple18-T载体、rTaq酶、限制性内切酶Nco I及Xho I为TaKaRa公司产品。M-MLV为Promega公司产品。DNA回收试剂盒购自Sangon公司。IPTG、NBT及BCIP购自Sigma公司。硝酸纤维素酶购自BioRad公司。Ni+亲和纯化柱购自GE公司。
1.2 方法 1.2.1 Gn蛋白结构及Protean预测从NCBI下载TZSV Gn/Gc蛋白的基因序列(序列号:NC_010490), 用SignalP-4.0预测Gn/Gc蛋白的剪切位点;TMHMM预测Gn跨膜结构。利用DNAstar软件提供的Protean模块, 用Kyte-Doolittle方法预测Gn蛋白亲水性;Eisenberg方法预测Gn蛋白二级结构;Karplas-Schulz方法预测蛋白质骨架区的柔韧性;Jameson-wolf方法预测蛋白潜在的抗原表位;用Emini方法预测蛋白的表面可及性[5]。
1.2.2 Gn基因的RT-PCR扩增及原核表达载体构建采用LiCI沉淀法提取RNA[1], 两步法RT-PCR扩增Gn序列。上游引物Gn-F:CATGCCATGGCATCGAAGACGGAGCATGAA(下划线为限制性内切酶Nco I);下游引物Gn-R:CCGCTCGAGTCATGAGAAGTTCGTGCAGA(下划线为限制性内切酶Xho I)。cDNA合成体系为20 μL, 用12 μL总RNA为模板, 1 µL 100 nmol/L引物混合, 70℃预变性10 min后, 迅速插入冰上5 min, 加入5×RT Buffer 4 μL, 10 mmol/L dNTP 2 μL, 5 U/μL M-MLV 1 μL, 40 U/μL RNase Inhibitor 1 μL, 42℃延伸60 min。以cDNA为模板进行PCR扩增, 反应体系为:94℃下预变性4 min;然后94℃下变性1 min, 55℃退火1 min, 72℃下延伸1 min 30 s, 循环扩增30次;最后72℃下延伸10 min。PCR产物经切胶纯化后, 克隆到pMD simple 18-T载体上。菌落PCR鉴定阳性克隆并送华大基因测序。将Gn基因用Nco I及Xho I双酶切后, 与表达载体pET-30a相连接, 转化大肠杆菌BL21(DE3), 菌落PCR鉴定阳性克隆并进一步测序验证编码框是否正确。
1.2.3 Gn融合蛋白的诱导表达、SDS-PAGE分析和纯化阳性克隆接菌于含100 mg/L卡那霉素(Kanamycin)的LB培养基中, 培养至对数生长期, OD600=0.6时加入终浓度为1 mmol/L的IPTG 37℃诱导表达6 h, 以不加IPTG诱导的培养物为阴性对照。离心收集菌体, 在8 mol/L尿素变性条件下破碎细胞, 用Ni+亲和纯化柱回收带有His标签的融合蛋白。纯化后的蛋白在复性缓冲液(50 mmol/L Tris, 0.5 mM EDTA, 50 mmol/L NaCl, 1%甘氨酸)中透析48 h, 作为抗原免疫家兔。同时取样加2×SDS-PAGE上样缓冲液(0.1 mol/L Tris-HCl, 1% β-巯基乙醇, 4% SDS, 0.2%溴酚蓝, 20%甘油, pH 6.8) 充分悬浮。沸水中处理10 min, 12 000 r/min离心2 min后取上清进行SDS-PAGE电泳分析。
1.2.4 多抗血清的制备及效价测定用紫外分光光度计测定Gn蛋白浓度, 稀释至1 mg/mL, 参照欧阳元龙等[6]的方法免疫家兔。抗血清按1/512、1/1 024、1/2 048、1/4 096、1/8 192、1/16 384倍比进行梯度稀释, 间接ELISA进行抗血清效价测定[7]。
1.2.5 Gn蛋白的Western blotting检测取0.1 g感病叶片液氮研磨后, 加入200 μL 2×SDS蛋白上样缓冲液, 进行SDS-PAGE电泳, 电泳结束后电转移至硝酸纤维素膜上, TZSV Gn多抗血清孵育1 h(1:4 000倍比稀释), TBST洗膜后, 加入碱性磷酸酯酶标记羊抗兔二抗(1:8 000倍比稀释), 加入NBT/BCIP显色至条带清晰。
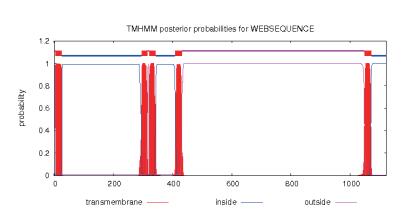
2 结果 2.1 TZSV Gn蛋白结构及Protean预测SignalP-4.0预测前体蛋白G氨基酸序列第25位为信号肽剪接位点, Gn和Gc的剪切位点位于前体蛋白G氨基酸序列第436位, 由此推算Gn蛋白核苷酸序列长1 233 bp, 编码411 aa, 分子量为47.5 kD。TMHMM预测前体蛋白G氨基酸第295位后有连续3个跨膜结构(图 1)。在原核表达中, 信号肽及跨膜结构会影响到目的蛋白的定位及表达量;此外综合Kyte-Doolittle、Eisenberg、Karplas-Schulz、Jameson-wolf方法、Emini方法, Gn蛋白氨基酸残基1-260区段内有较好的亲水性、可及性和较高的抗原性指数(图 2), 因此在本研究中选择前体蛋白G氨基酸序列26-295之间的区域, 基因片段长度810 bp用于Gn蛋白的原核表达及多抗血清制备。
|
| 图 1 TMHMM预测前体G蛋白跨膜结构域 |

|
| 图 2 Protean预测Gn蛋白抗原表位 |
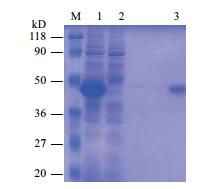
用RT-PCR从感病番茄中扩增得到长度为810 bp的Gn基因, 经1%琼脂糖电泳分析与目的片段大小相吻合, PCR产物纯化后与pMD simple 18-T连接, 并测序。证实扩增片段即为Gn基因片段, 且ORF正确。用Nco I及Xho I双酶切原核表达载体pET-30a-Gn, 结果显示从载体上能特异性切下一段约810 bp左右的片段。同时测序结果也说明该片段即为TZSV的Gn基因, 证明所构建的原核表达载体是正确的。转化有原核表达载体pET-30a-Gn阳性克隆的大肠杆菌BL21菌株在LB液体培养基中培养, 然后加入1 mmol/L IPTG诱导表达6 h, 而不加IPTG诱导的阳性克隆菌株则作为对照。经12.5%的SDS-PAGE分析显示, IPTG诱导的菌株特异性表达约40 kD融合蛋白(图 3)。该融合蛋白在N端和C端都表达有His-tag标签。用GE公司的Ni+亲和纯化柱纯化回收带有His标签的Gn蛋白。
|
| 图 3 Gn蛋白的诱导表达及纯化 M:蛋白marker;1:pET-TZSV-Gn加IPTG诱导6 h;2:pET-TZSV-Gn未加IPTG诱导;3:8 mol/L尿素pH4.5条件下洗脱目的蛋白 |
以纯化后的Gn蛋白作为抗原免疫家兔, 每周注射一次, 注射4次后取血收集血清, 用间接ELISA测定抗血清的效价。结果显示1 mg/mL的抗原能和多抗血清反应的最高稀释倍数为1/16 384倍。
2.4 TZSV Gn蛋白的Western blot检测用制备好的抗血清对TZSV感病病样及原核表达的Gn蛋白进行Western blot检测(图 4), 在约40 kD处检测到原核表达的Gn蛋白, 在约47 kD附近检测到TZSV感病病样的Gn蛋白条带, 与预期相符合。

|
| 图 4 Gn蛋白的Western blot检测 M:蛋白marker;1:原核表达回收的Gn融合蛋白;2:健康番茄样品;3:感染TZSV番茄样品 |
Gn/Gc糖蛋白为布尼亚病毒科病毒的重要结构蛋白, 它镶嵌在成熟病毒颗粒的包膜上, 在感染人或动物的布尼亚病毒中, 因其具有中和抗原决定簇和各型的特异性抗原位点, 能够刺激机体产生特异性抗体, 而成为基因工程疫苗研究的靶点[8, 9]。本研究在对感染植物Tospovirus病毒TZSV Gn蛋白结构及Protean预测发现, TZSV Gn蛋白氨基酸残基1-260区段内有较好的亲水性、可及性和较高的抗原性指数, 制备的抗血清具有良好的特异性。用本实验室制备的Gn抗血清做TZSV Gn蛋白免疫胶体金标记, Gn蛋白抗体能很好的定位到病毒粒子表面, 具有非常好的电镜形态学诊断特征[10]。
Gn蛋白一个重要的功能是介导病毒与细胞受体的识别。对感染人的汉坦病毒(Hantavirus)研究显示Gn蛋白可以介导病毒与细胞蛋白β3整合素(β3 integrins)、衰变加速因子(DAF/CD55)、补体分子球形结构域受体(gC1qR/p32) 识别而使病毒进入细胞[11-12]。对感染植物的Tospovirus病毒代表种番茄斑萎病毒(Tomato spotted wilt virus, TSWV)的Gn定位研究表明, Gn能特异性定位到西花蓟马(Frankliniella occidentalis)中肠部位, 表明与TSWV Gn识别的受体蛋白可能为蓟马中肠受体蛋白[13], 也发现了可能为Gn受体的蓟马蛋白[14-15]。在所有已知的5 500多种蓟马中, 仅发现蓟马科(Thripidae)的花蓟马属(Frankliniella)、蓟马属(Thrips)、硬蓟马属(Scirtothrips)及缘蓟马属(Ceratothripoides)4个属的12种蓟马能够传播Tospoviruses[16]。推测Tospovirus病毒与蓟马的特异性很可能是Gn/Gc蛋白与蓟马中肠受体蛋白特异性密切相关。本研究所制备的TZSV Gn蛋白多抗血清不仅可以应用于病毒快速检测及病毒发生流行监测, 还可进一步利用免疫标记、far-western blotting、免疫共沉淀及酵母双杂等技术应用于Gn蛋白与相关传毒介体蓟马的互作功能研究。
4 结论本研究通过生物信息学方法对Gn蛋白结构及B细胞的潜在抗原表位预测, 选择了Gn的非跨膜区进行原核表达及多抗血清制备, 所制备的抗血清具有较高的效价, 1 mg/mL的抗原能和多抗血清反应的最高稀释倍数为1/16 384倍。Western blot表明多抗血清特异性好, 不仅能检测到原核表达的Gn蛋白(40 kD), 也能检测到感染TZSV病样中的Gn蛋白(49 kD)。该多抗血清不仅能应用于TZSV检测, 还能进一步应用于Gn的功能研究。
| [1] | Dong JH, Cheng XF, Yin YY, et al. Characterization of Tomato zonate spot virus, a new Tospovirus species in China[J]. Archives of Virology, 2008, 156 (5): 755–764. |
| [2] | Whitfield AE, Ullman DE, German TL. Tospovirus-thrips interactions[J]. Annual Review of Phytopathology, 2005, 43 (7): 459–489. |
| [3] | Medeiros RB, Ullman DE, Sherwood JL, et al. Immunoprecipitation of a 50-kDa protein: a candidate receptor component for Tomato spotted wilt tospovirus(Bunyaviridae)in its main vector, Frankliniella occidentalis[J]. Virus Research, 2000, 67 (2): 109–18. DOI:10.1016/S0168-1702(00)00123-4 |
| [4] | 盛欣, 兰英华, 李用国. 汉坦病毒糖蛋白及其在细胞融合中作用的研究进展[J]. 医学研究杂志, 2013, 42(12): 16–18. |
| [5] | 马凡舒, 张蕾, 王洋, 孙彦刚, 闫喜军. B细胞抗原表位预测方法的研究进展[J]. 中国畜牧兽医, 2016, 43(1): 63–67. |
| [6] | 欧阳元龙, 吴建祥, 熊如意, 等. 水稻黑条矮缩病病毒外壳蛋白基因S10的原核表达、多克隆抗体制备及应用[J]. 中国水稻科学, 2010, 24(1): 25. |
| [7] | Wang M, Gonsalves D. ELISA detection of various Tomato spotted wilt virus isolates using specific antisera to structural proteins of the virus[J]. Plant Disease, 1990, 74 (2): 154–158. DOI:10.1094/PD-74-0154 |
| [8] | Faburay B, Lebedev M, McVey DS, et al. A glycoprotein subunit vaccine elicits a strong Rift Valley fever virus neutralizing antibody response in sheep[J]. Vector Borne Zoonotic Dis, 2014, 14 (10): 746–756. DOI:10.1089/vbz.2014.1650 |
| [9] | 于蒙蒙, 于澜. 汉坦病毒糖蛋白的结构及功能研究进展[J]. 微生物学免疫学进展, 2012, 40(4): 63–66. |
| [10] | 郑宽瑜, 董家红, 方琦, 等. 胶体金免疫电镜技术检测番茄环纹斑点病毒[J]. 电子显微学报, 2015, 34(1): 67–70. |
| [11] | Jin M, Park J, Lee S, et al. Hantaan virus enters cells by clathrin-dependent receptor-mediated endocytosis[J]. Virology, 2002, 294 (1): 60–69. DOI:10.1006/viro.2001.1303 |
| [12] | Cifuentes-Mu?oz N, Salazar-Quiroz N, Tischler ND. Hantavirus Gn and Gc envelope glycoproteins: key structural units for virus cell entry and virus assembly[J]. Viruses, 2014, 6 (4): 1801–1822. DOI:10.3390/v6041801 |
| [13] | Whitfield AE, Ullman DE, German TL. Expression and characterization of a soluble form of Tomato spotted wilt virus glycoprotein Gn[J]. Journal of Virology, 2004, 78 (23): 13197–13206. DOI:10.1128/JVI.78.23.13197-13206.2004 |
| [14] | Bandla MD, Campbell LR, Ullman DE, et al. Interaction of Tomato spotted wilt tospovirus(TSWV)glycoproteins with a thrips midgut protein, a potential cellular receptor for TSWV[J]. Virology, 1998, 88 (2): 98–104. |
| [15] | Jones DR. Plant viruses transmitted by thrips[J]. European Journal of Plant Pathology, 2005, 113 (2): 119–157. DOI:10.1007/s10658-005-2334-1 |
| [16] | Sin SH, McNulty BC, Kennedy GG, et al. Viral genetic determinants for thrips transmission of Tomato spotted wilt virus[J]. PNAS, 2005, 102 (14): 5168–5173. DOI:10.1073/pnas.0407354102 |




