辣椒疫病是由辣椒疫霉菌引发的一种土传性病害, 主要危害辣椒的茎、叶和果实, 侵染后可造成植株萎蔫、落叶和果实腐烂[1]。一旦发病, 传播迅速, 对辣椒生产构成极大威胁, 常造成辣椒减产20%-30%, 甚至造成毁田绝收, 严重影响辣椒的产量和质量[2]。当前生产上主要采用甲霜灵、霜脲氰等内吸化学杀菌剂进行防治, 但疫霉菌对使用过的内吸杀菌剂极易产生抗药性, 而化学药剂防治为主的防治措施还会产生药剂残留以及环境污染等问题[3-5]。所以, 对辣椒疫病进行生物防治是当前辣椒生产可持续发展的必然选择。
目前, 对辣椒疫病生物防治功能菌株的研究主要集中在生防细菌、木霉及放线菌等[6-8]。侧孢短芽孢杆菌是一种多功能菌株, 能产生多种具有应用潜力的代谢产物, 如杀虫蛋白、抑菌物质、抗癌免疫调节物质, 另外侧孢短芽孢杆菌还具有解磷、解钾、固氮等多种生物学功能[9, 10]。但是, 利用侧孢短芽孢杆菌防治辣椒疫病的研究较少。本研究以辣椒疫霉为靶标, 从海南省多地采集43份土样中分离和筛选出对其具有较高抑制活性的菌株, 并对菌株进行鉴定和室内的生防效果测定, 以期为辣椒疫病的生物防治提供新的资源。
1 材料与方法 1.1 材料辣椒疫霉菌(Phytophthora capsici), 由本实验室保存;供试辣椒品种分别为尖椒1号(Capsicum annuum L.)和津福42(Capsicum fructescens L.)。
1.2 方法 1.2.1 土样中细菌的分离与单菌落纯化采用平板稀释法[11]分离、纯化采集自海南多地的43份土样。分别用无菌水将各土壤样品稀释至10-4、10-5和10-6 g/mL, 用移液管吸取0.1 mL土壤稀释液涂布到PB培养基上, 置于37℃培养箱中培养。48 h后挑取不同单菌落, 用分区划线法分别接种到不同的细菌培养基上37℃培养。24-48 h观察记录平板上长出的菌落。挑取单菌落在PB培养基上继续划线进行纯化培养。24-48 h后观察第1次划线纯化培养菌落, 再同法进行第2次、第3次划线纯化培养。经表形观察和镜检没有杂菌后, 分别保存于新鲜试管斜面。
1.2.2 辣椒疫霉病菌拮抗菌的筛选采用平板对峙法[12]筛选辣椒疫霉的拮抗菌。用5 mm打孔器沿PDA培养基上辣椒疫霉菌菌落边缘打孔, 挑取生长速度较一致的病原菌块, 接种到新的PDA培养基平板中心, 置28℃培养48 h后, 以病原菌为圆心在平板的背面打“十”字格, 以2.8 cm为半径, 用接种针分别点接纯化后的不同细菌菌株于十字格的4点上, 置于28℃培养, 测量并记录48-96 h平板上的抑菌圈半径, 通过比较不同菌株的抑菌圈半径判断抑菌性, 从中挑选出抗性最强的菌株。
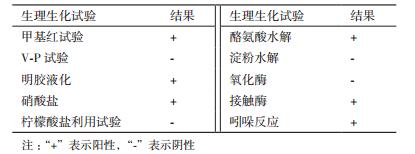
1.2.3 拮抗菌的生理生化特征将拮抗菌A60划线接种于固体PB培养基上, 37℃培养箱中培养48 h后观察拮抗菌的菌落形态。参照《常见细菌系统鉴定手册》[13]对拮抗菌进行甲基红试验、V-P试验、明胶液化、硝酸盐、柠檬酸盐利用试验、酪氨酸水解、淀粉水解、氧化酶、接触酶、吲哚反应等生理生化指标的测定。
1.2.4 16S rDNA序列分析鉴定采用细菌基因组提取试剂盒DP302(天根生化科技有限公司)进行基因组DNA的提取, 以此DNA为模板, 以27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TACGGHTACCTTGTTACGACTT-3')为引物, 进行菌株16S rDNA的扩增[14]。PCR扩增条件为:95℃ 5 min;94℃ 1 min, 50℃ 1 min, 72℃ 2 min, 35个循环;72℃ 10 min。委托上海生工生物有限公司对16S rDNA扩增产物进行测序, 所得序列与NCBI数据库中已知序列进行比对(Blast), 通过MEGA5.2软件构建系统发育树[15]。
1.2.5 拮抗菌A60对辣椒果实的室内防效测定将保存的A60菌株于LB固体培养基平板上活化24 h, 挑取单菌落接种于20 mL LB液体培养基的100 mL三角瓶中, 为种子瓶。按1%接种量, 接入盛有100 mL LB液体培养基的250 mL三角瓶中, 于37℃、200 r/min恒温振荡培养24 h, 得到A60培养液。用无菌水稀释成1×107 CFU/mL浓度备用。用打孔器在生长5 d的辣椒疫霉病菌边缘打孔, 取菌块接入装有50 mL无菌水的250 mL三角瓶中, 28℃、180 rpm摇床震荡培养10 min, 再用无菌水稀释成浓度为1×106 CFU/mL的孢子悬液备用。
将辣椒果实和甜椒果实进行表面消毒:75%酒精浸泡30 s, 无菌水清洗3次。用灭菌的枪头打孔, 每个果实表面6个孔, 每个处理10个果实。处理组A60培养液浓度分别为1×107、5×106、1×106、5×105和1×105 CFU/mL, 先在孔中分别加入20 μL无菌发酵液, 2 h后加入20 μL 1×106 CFU/mL的辣椒疫霉菌孢子悬液, 仅接种辣椒疫霉菌组为阳性对照CK1, 无菌水为阴性对照CK2。测定拮抗菌A60对辣椒疫病的防治效果, 黑暗保湿48 h, 28℃恒温培养, 观察发病情况, 计算发病率和病情指数。
病害严重度分级标准如下:0级, 无病;1级, 1个发病孔;2级, 2个发病孔;3级, 3个发病孔;4级, 4个发病孔;5级, 5-6个发病孔。
病情指数(%)={Σ[(各级病果数×相对级数值)]/调查总果数×5}×100%
防治效果(%)={[阳性对照病情指数-处理病情指数]/阳性对照病情指数}×100%
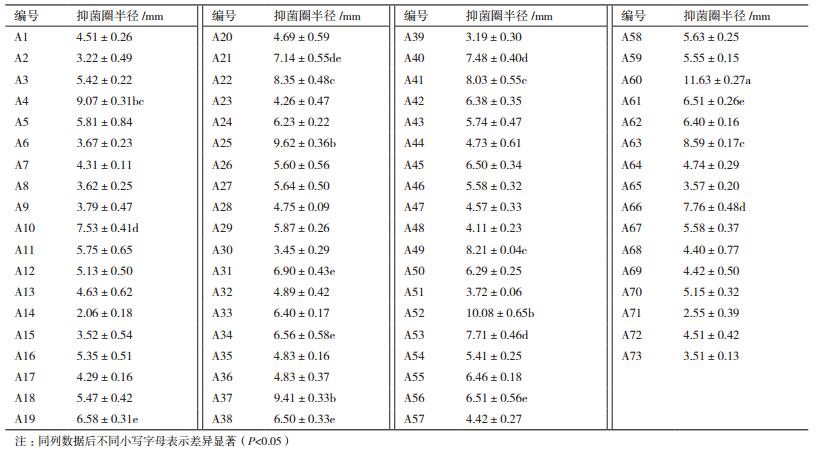
2 结果 2.1 辣椒疫霉病菌拮抗菌的筛选从43份土样中共分离得到700余株菌株, 其中对辣椒疫霉菌具有拮抗作用的菌株73株(表 1), 其中抑制效果最好是菌株A60, 抑菌圈半径为11.63 mm(图 1)。该菌种保存在中国微生物菌种保藏管理委员会普通微生物中心, 编号为CGMCC No.5694。
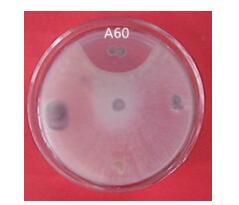
|
| 图 1 拮抗菌株A60抑菌效果 |
拮抗菌A60光学显微镜观察菌落大小为(0.5-1.0)μm×(2.0-5.0)μm, 芽孢侧生;在固体PB培养基上呈现黄褐色、扁平状、边缘光滑、中央略凸起;革兰氏染色结果可变, 延迟期为G-、对数期为G+、稳定期为G-。通过生理生化鉴定结果(表 2), 结合形态学特征, 参照《常见细菌系统鉴定手册》, 将拮抗菌A60初步鉴定为短芽孢杆菌属(Brevibacillus)。
该菌株的16S rDNA核苷酸序列长度为1 526 bp, 通过与NCBI数据库中已有的细菌序列进行比对分析, 发现拮抗菌A60菌株与侧孢短芽孢杆菌(Brevibacillus laterosporus)的同源性相似性为99%。以邻位法构建系统发育树(图 2), 可以看出A60与侧孢短芽孢杆菌(Brevibacillus laterosporus HQ412764.1) 亲缘关系最接近。综合生理生化特征及16S rDNA序列和系统发育树分析结果, 拮抗菌株A60鉴定为侧孢短芽孢杆菌(Brevibacillus laterosporus)。

|
| 图 2 菌株A60依据16S rDNA序列的系统发育树 标尺0.1表示序列差异的分支长度;发育节点的数值表示Brootstrap值;括号内数值为GenBank数据库的登录号 |
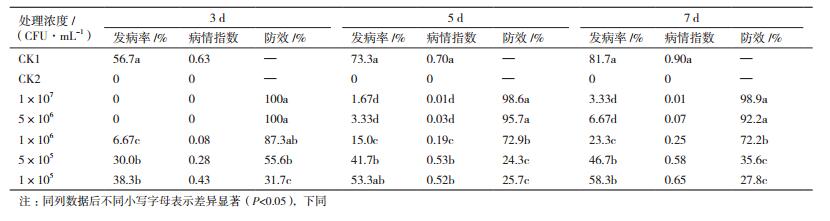
防效结果(表 3)表明, 加入浓度为1×107 CFU/mL和5×106 CFU/mL拮抗菌A60的辣椒, 在第3 d时未发病, 防效可达到100%, 第5天和第7天仍可达到90%以上防效;加入浓度为5×105 CFU/mL和1×105 CFU/mL拮抗菌A60的辣椒在第3天、第5天和第7天发病率均低于对照组, 但防效明显降低, 说明高浓度拮抗菌A60能够有效的降低发病率和病情指数, 并且具有很好的持效性, 低浓度拮抗菌A60也可以提供防治作用。
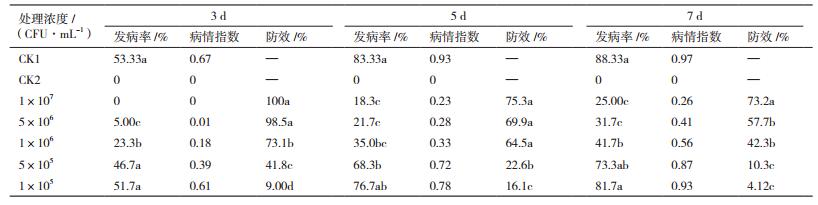
防效结果(表 4)表明, 加入高浓度拮抗菌A60的甜椒, 在第3天时未发病, 达到100%, 第5天时75.26%, 第7天仍可达到73.20%;当拮抗菌A60浓度降低为5×106 CFU/mL时, 在第3天和第5天时防效与高浓度无显著性差异, 但当第7天时防效明显降低, 说明低浓度持效性有所降低;当拮抗菌A60浓度低于5×105 CFU/mL时, 无明显防治效果。说明拮抗菌A60能够降低发病率和病情指数, 并且高浓度时具有较好的持效性, 但在甜椒上的防治效果比在辣椒上的稍差一些, 使用时应适当增加浓度。
近年来, 侧孢短芽孢杆菌作为一种多功能菌株, 在生物防治、环境保护、医学等方面都显示了巨大的应用价值和研究前景。作为最具潜力的生防菌株之一, 侧孢短芽孢杆菌可产生丰富的抗菌物质, 如蛋白类、脂肽类化合物、芽孢菌胺、聚酮类化合物等, 对多种真菌和细菌都表现出广谱的抑菌活性[16]。李悦等[17]研究表明侧孢短芽孢杆菌B8胞外抗菌蛋白可有效抑制立枯丝核菌和辣椒疫霉菌菌丝生长, 并引起菌丝畸形。张丹等[18]研究表明侧孢短芽孢杆菌S62-9对大多数致病性细菌及部分真菌都具有抑制作用, 其中对G+菌的抑菌效果强于G-菌, 抑菌机制主要是营养竞争作用和产生抗菌肽。侧孢短芽孢杆菌还可诱导植物产生系统抗性, 李蔚等[19]用侧孢短芽孢杆菌B8胞外抗菌蛋白处理辣椒4 d后, 植株产生PR蛋白, 说明侧孢短芽孢杆菌可诱导辣椒产生系统抗病性。另外, 苗素平[20]研究表明添加侧孢短芽孢杆菌的微生物肥料, 可有效改善土壤肥力、促进作物生长。朱金英等[21]在绿源有机肥中添加不同比例的海洋侧孢短芽孢杆菌(AMCC100018) 可有效促进黄瓜植株生长、改善黄瓜果实的品质。
综上所述, 侧孢短芽孢杆菌具有抑菌能力强、抑菌范围广、生长快速等特点, 还可诱导植物产生抗病性和促进植物生长, 其菌体及抑菌代谢产物均可制成优良的生防菌剂。本研究将侧孢短芽孢杆菌A60的菌悬液分别稀释不同倍数进行室内的防效试验, 结果表明, 拮抗菌A60能够明显降低辣椒、甜椒上辣椒疫病的发病率和病情指数, 并且具有很好的持效性。为了更好的进行田间应用, 应进一步确定其抑菌调控体系以及抑菌物质在植物、病原物和生防菌三者之间发挥作用的调控机制。随着测序技术的逐渐发展, 尤其是高通量测序技术的广泛应用, 可利用基因组学尤其是功能基因组学, 包括转录物组学、蛋白质组学、代谢物组学、比较基因组学来研究其生防机制和调控网络。
4 结论本研究从43份海南土样中分离、筛选出了73株对辣椒疫霉病菌有拮抗作用的细菌A1-A73, 其中A60抑菌活性最高, 对辣椒疫霉的抑菌圈半径达11.63 mm。根据形态特征、生理生化特征和16S rDNA序列分析鉴定其为侧孢短芽孢杆菌。分别在辣椒和甜椒上进行侧孢短芽孢杆菌A60的室内防效测定, 结果表明, 拮抗菌A60能够明显的降低发病率和病情指数, 具有较好的防病持效性。
| [1] | 董金皋. 农业植物病理学, 北方本[M]. 北京: 中国农业出版社, 2001: 402-405. |
| [2] | 李萍, 叶涛, 郑婷, 等. 辣椒疫霉可溶性蛋白和酯酶同工酶电泳分析[J]. 安徽农业大学学报, 2015, 42(6): 915–920. |
| [3] | 张海良, 马辉刚, 李湘民, 等. 辣椒疫霉菌对甲霜灵的敏感性测定[J]. 江西农业大学学报, 2011, 33(2): 270–274. |
| [4] | 翟明涛, 王开运, 许辉, 等. 抗氟吡菌胺辣椒疫霉菌株的诱导及其生物学特性的研究[J]. 植物病理学报, 2014, 44(1): 88–96. |
| [5] | 何烈干, 葛艳丽, 马辉刚, 等. 辣椒疫霉不同发育阶段对氟吗啉的敏感性研究[J]. 中国农学通报, 2016, 32(16): 123–131. DOI:10.11924/j.issn.1000-6850.casb15080038 |
| [6] | 赵影. 辣椒疫霉菌拮抗细菌的筛选、鉴定及其生防潜力[D]. 泰安: 山东农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10434-1012486992.htm |
| [7] | 张爱民, 韩世玉, 杨红, 等. 辣椒疫霉菌拮抗木霉菌株的分离与初步筛选[J]. 贵州农业科学, 2014(6): 87–90. |
| [8] | 刘晓瑜, 窦桂铭, 马玉超, 等. 生防链霉菌SAT1的分离、鉴定及其对辣椒疫霉的生物防治潜力[J]. 广东农业科学, 2014, 41(19): 75–79. DOI:10.3969/j.issn.1004-874X.2014.19.018 |
| [9] | 张楠, 刘洋, 柯晓静, 等. 侧孢短芽孢杆菌S62-9抗菌肽基因的初步定位[J]. 河北农业大学学报, 2016, 39(5): 82–86. |
| [10] | 余惠荣, 李悦, 李晓菲, 等. 侧孢短芽孢杆菌B8抑菌物质的理化性质及其分离纯化[J]. 沈阳农业大学学报, 2015, 46(4): 398–403. |
| [11] | Claus D, Berkeley RCW. Bergey's manual of systemic bacteriol-ogy[M]. Baltinore: Williams & Wilkins, 1986. |
| [12] | 赵斌, 何绍江. 微生物学实验[M]. 北京: 科学出版社, 2002: 86. |
| [13] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 349-387. |
| [14] | 周泠璇, 刘娅. 红提葡萄内生细菌的分离鉴定及灰霉病拮抗菌的筛选[J]. 生物技术通报, 2016, 32(4): 184–189. |
| [15] | Tamura K, Peterson D, Peterson N, et al. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28 (10): 2731–2739. DOI:10.1093/molbev/msr121 |
| [16] | 陈潺, 陈升富, 王建宇, 等. 侧孢短芽孢杆菌的应用研究进展[J]. 山东农业科学, 2015(2): 149–156. |
| [17] | 李悦, 余惠荣, 李蔚, 等. 侧孢短芽孢杆菌B8对两种植物病原菌抗菌机制初步研究[J]. 中国植保导刊, 2015(3): 12–16. |
| [18] | 张丹, 王志新, 李兴峰, 等. 侧孢短芽孢杆菌S62-9对常见微生物的体外抑菌作用[J]. 中国食品学报, 2017(1): 55–61. |
| [19] | 李蔚, 赵秀香, 徐千惠, 等. 侧孢短芽孢杆菌B8胞外抗菌蛋白对辣椒立枯病抗病机制的研究[J]. 中国植保导刊, 2016, 36(10): 5–9. DOI:10.3969/j.issn.1672-6820.2016.10.001 |
| [20] | 苗素平. 不同浓度侧孢短芽孢杆菌对土壤与作物生长的影响[J]. 济宁学院学报, 2016(6): 38–42. |
| [21] | 朱金英, 张书良, 郭建军, 等. 海洋侧孢短芽孢杆菌(AMCC 100018) 对设施黄瓜的应用效应研究[J]. 长江蔬菜, 2014(14): 62–65. |