2. 江西省农业微生物资源开发与利用工程实验室, 南昌 330045
2. Jiangxi Engineering Laboratory for the Development and Utilization of Agricultural Microbial Resources, Nanchang 330045
水稻(Orysa sativa L.)是全球最重要的粮食作物, 养活了全球一半以上的人口[1]。种子健康是世界农业可持续发展和粮食安全生产的重要基础[2]。种子萌发和幼苗建成是植物生活史中两个最关键的阶段, 它们直接决定着植物种群的延续, 较高的发芽势和发芽率是培育壮秧的基础[3, 4]。然而, 水稻恶苗病、细菌性条斑病、稻曲病、根尖线虫病、纹枯病和稻瘟病等种(土)传病害的滋生与蔓延常引起稻谷变色、抑制稻种萌发和幼苗建成, 严重威胁着水稻生产安全[5-7]。有研究表明[8-11], 种子带菌会造成种子萌发率和幼苗活力下降, 并使植物形态发生变异。种子处理是作物病虫害综合治理(IPM)中具有重要意义的首要环节, 不仅能促进作物生育安全、使作物健康茁壮成长, 而且能有效防治部分种(土)传病害;相比作用于叶面的植保产品, 种子处理剂因其经济、高效的特点, 被广泛应用于水稻生产中[12, 13]。迄今为止, 化学与生物药剂已被广泛用于缓解和控制种(土)传病害, 但喷淋化学杀菌剂容易使病害产生抗药性, 造成毒性残留, 并引起生态环境失衡[14]。鉴于生物农药良好的环境兼容性和人们对绿色食品的需求, 利用广谱、高效、低毒、环保的微生物生防制剂来替代化学药剂愈发成为全球研究的重点[15, 16]。众所周知, 放线菌是许多胞外酶和抗生素的知名生产者, 尤其是链霉菌属凭借易分离培养、产多种次级代谢物等特点, 被广泛用于农业病害的生物防治[17]。魏赛金等[18]发现链霉菌702不仅能显著抑制水稻纹枯病菌、稻瘟病菌、稻曲病菌等14种植物病原真菌的生长, 且低浓度的农抗702能有效促进水稻种子胚根和芽的生长, 提高根系活力。
课题组先期以水稻纹枯病菌为靶目标, 分离筛选到一株能产新型抗真菌活性物质(1-甲基-3-氧代-6-氮杂二环[3.1.1]-5(7)-庚烯-2-酮, 分子式为C6H7O2N, 暂命名为农抗N2) 的链霉菌新种Streptomyces sp. N2, 此活性物质具备的广谱拮抗植物病原真菌特性为其在不同类型植物病害上的生防应用奠定了基础[19]。本研究用不同浓度农抗N2粗提物浸种处理水稻种子, 通过考察幼苗株高、发芽率、活力指数、储藏物质运转率等多项萌发指标, 及其对淀粉酶活力、渗透调节物质含量和丙二醛(Malondialdehyde, MDA)含量的影响, 旨在探明新型农抗N2粗提物浸种对水稻种子中不同生理生化特性之间的内在联系, 为新型微生物浸种剂——农抗N2的应用研究提供理论依据。
1 材料与方法 1.1 材料 1.1.1 菌株链霉菌N2(Streptomyces sp. N2), 分离自云南省昆明市西山国际森林公园。水稻种子:淮两优608, 保存于江西省农业微生物资源开发与利用工程实验室。
1.1.2 试剂三氯乙酸、无水乙醇、硝酸等均购自西陇化工股份有限公司;浓硫酸、蒽酮、3, 5-二硝基水杨酸等均购自国药集团化学试剂有限公司;牛血清白蛋白、考马斯亮蓝G-250、3, 5-二硝基水杨酸等均购自上海蓝季科技发展有限公司;其他试剂均为分析纯。仪器:JW-3022HR型高速冷冻离心机, 安徽嘉文仪器装备有限公司;LDZX-50KBS型立式压力蒸汽灭菌器, 上海申安医疗器械厂;LRH-250A生化培养箱, 韶关市泰宏医疗器械有限公司;L6-紫外可见光光度计、UV765-紫外可见光光度计, 上海精密仪器仪表有限公司。
1.2 方法 1.2.1 农抗N2粗提物制备农抗N2粗提物原液:将培养7 d的链霉菌N2孢子刮入30 mL带玻璃珠的无菌蒸馏水中, 震荡20 min后移取1 mL孢子悬液于装有50 mL种子培养液(蔗糖20 g, 玉米淀粉10 g, 玉米浆10 g, (NH4)2SO4 1 g, KH2PO4 1 g, MgSO4 1 g, MnSO4 0.01 g, ZnSO4 0.01 g, H2O 1 L, pH7.2-7.4, 121℃灭菌30 min)的250 mL三角瓶中, 160 r/min、30℃振荡培养72 h即得链霉菌N2种子液。种子液按10%的接种量转接至含500 mL发酵培养液(蔗糖40 g, 玉米淀粉20 g, 玉米浆20 g, 黄豆饼粉10 g, (NH4)2SO4 2 g, KH2PO4 1 g, MgSO4 1 g, MnSO4 0.01 g, ZnSO4 0.01 g, H2O 1 L, pH7.2-7.4, 121℃灭菌30 min)的2 L三角瓶中, 160 r/min、30℃培养一周即为链霉菌N2发酵液;链霉菌N2发酵液经两倍体积乙醇(纯度≥90%)浸提至少24 h后4 000 r/min离心弃除菌体, 上清液经旋转蒸发器浓缩后于10 000 r/min离心10 min, 保留上清液, 最后用0.22 μm滤膜过滤除菌即得无菌农抗N2粗提物原液。用无菌蒸馏水稀释农抗N2粗提物原液制成不同浓度药液, 浸种备用。
1.2.2 水稻种子处理及其萌发指标测定[4, 20, 21]水稻种子催芽:75%酒精表面消毒3 min, 流水冲洗2 min;28℃避光浸泡12 h后分别用50 mL浓度为0.23、0.58、1.15、2.88、5.77、11.53和23.06 μg/mL的农抗N2粗提物继续浸种24 h, 以蒸馏水为空白CK对照。每皿15粒种子, 设7个重复。置于光照培养箱(光周期12 h, 温度28℃)中催芽, 每天观察并记录萌发情况, 第3天记录发芽势, 连续观察7 d, 以连续2 d无种子萌发为催芽终期(以幼芽达到种子长度一半, 幼根与种子等长为萌发标准)。催芽终止后测量株高、根长, 记录幼根、幼苗、籽粒干重并计算发芽指数、活力指数、贮藏物质运转率等种子萌发指标。另取8份等量水稻种子按以上消毒、浸种、催芽方式7 d后取胚乳用于可溶性蛋白、可溶性总糖含量和淀粉酶活性的测定。
萌发指标的测定:幼苗株高、根长用毫米刻度尺进行测量;
发芽势(GE)=(3 d内正常发芽的种子数/供试种子总数)×100%;
发芽率(GP)=(7 d内正常发芽的种子数/供试种子总数)×100%;
发芽指数(GI)=∑Gt/Dt(Gt表示在第7天的发芽数;Dt代表相应的发芽天数);
活力指数(VI)=GI×S(GI是发芽指数;S是一定时期内幼苗质量或幼苗长度);
贮藏物质运转率(TR)=[(胚芽+胚根)干质量/(胚芽+胚根+籽粒)干质量]×100%。
1.2.3 淀粉酶活性、可溶性蛋白含量及可溶性总糖含量的测定胚乳粗提物制备:称取1.0 g催芽终止后的水稻种子, 去根芽与颖壳后加入0.1 mol/L柠檬酸缓冲液(pH5.6), 于冰浴中研磨成匀浆, 倒入10 mL离心管中并用缓冲液定容至刻度, 混匀后于25℃下静置15-20 min(每隔3 min振荡一次), 经4 000 r/min离心15 min后取上清液即为胚乳粗提物, 置于4℃备用。
参考文献测定相关酶活性及物质含量:采用3, 5-二硝基水杨酸比色法[22]测定淀粉酶活力, 考马斯亮蓝法[23]测定可溶性蛋白含量, 蒽酮法[24]测定可溶性总糖含量。
1.2.4 丙二醛含量测定幼苗粗提液制备:挑选长势相同、催芽终止后的水稻种子幼苗1.0 g, 置于预冷研钵中加入10 mL 10%三氯乙酸和少量石英砂冰浴中研磨成匀浆。置于4℃, 4 000 r/ min离心10 min后取上清液即为MDA粗提液, 4℃备用。
丙二醛含量采用硫代巴比妥酸法[25]测定, 按公式:MDA(mmoL/g·FW)=[6.452×(D532-D600)-0.559×D450]×Vt/Vs×FW计算丙二醛含量;式中:Vt为提取液总体积(mL);Vs为测定用提取液总体积(mL);FW为样品鲜重(g)。
1.2.5 数据统计与分析采用Excel 2010、DPS 7.05、Origin 9.0和Adobe Photoshop CS5进行数据处理、绘图及显著性分析。
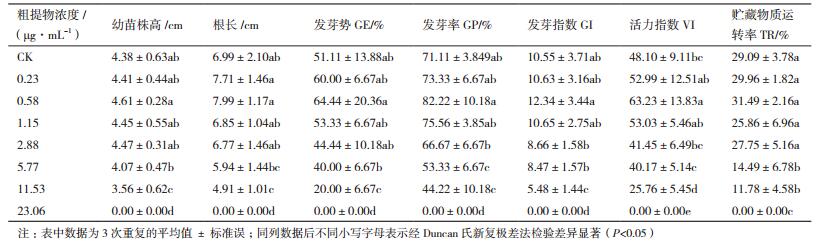
2 结果 2.1 农抗N2粗提物对水稻种子萌发指标的影响将不同浓度农抗N2粗提物浸种对水稻种子萌发指标进行单因素方差分析(One-Way ANOVA)。由表 1可知, 水稻种子经浓度为0.23 μg/mL至1.15 μg/mL农抗N2粗提物处理后, 活力指数VI显著提高, 其余各项萌发指标也均高于对照组, 但差异不显著;且于0.58 μg/mL时效果最佳, 幼苗株高、根长、GE、GP、GI、VI和TR 7项萌发指标较对照组分别提高了5.25%、14.31%、26.08%、15.62%、16.97%、31.46%和8.25%。随着处理浓度的升高, 各项指标呈下降趋势;当处理浓度高于2.88 μg/mL后除幼苗株高略高于对照组, 其他指标均受抑制, 尤以GP和TR差异显著, 相比对照组分别降低了25.00%和50.19%。当处理浓度高于或等于11.53 μg/mL时表现出显著的抑制效果。综上可知, 农抗N2粗提物对水稻种子萌发的作用主要表现为低促高抑(图 1), 活力指数相比对照组, 差异显著, 说明活力指数较其他指标对农抗N2粗提物更为敏感, 适宜浓度农抗N2粗提物浸种有利于增强种子活力, 促进种子萌发。
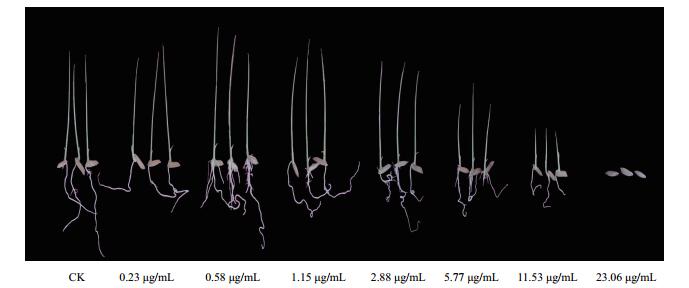
|
| 图 1 农抗N2粗提物浸种对水稻幼苗形态的影响 |
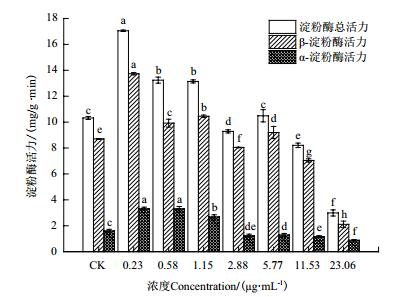
不同浓度农抗N2粗提物对水稻种子淀粉酶活性的影响结果(图 2)表明, α、β-淀粉酶活力与农抗N2粗提物浸种浓度呈负相关, 在0.23-1.15 μg/mL时, 淀粉酶总活力相比对照组依次增强了65.23%、28.27%和27.35%, 差异显著;但浸种浓度高于2.88 μg/mL后显著抑制了α-淀粉酶和β-淀粉酶的活力, 因此我们可以推测, 一定浓度农抗N2粗提物浸种有利于增强水稻种子中的淀粉酶活力, 保证萌发过程中淀粉的转化, 促进水稻种子萌发。
|
| 图 2 农抗N2粗提物对水稻种子淀粉酶活性的影响 图中数据为3次重复的平均值±标准误, 不同小写字母表示经Duncan氏新复极差法检验差异显著(P < 0.05), 下同 |
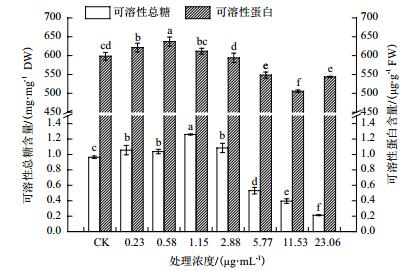
农抗N2粗提物对水稻种子催芽终止后胚乳中可溶性蛋白和总糖含量的影响, 结果(图 3)表明, 低浓度农抗N2粗提物处理组中可溶性蛋白和总糖含量随着农抗N2粗提物浓度的增加先升高后降低, 且可溶性蛋白和总糖含量分别在处理浓度为0.58 μg/mL与1.15 μg/mL时达到最高, 相比对照组分别提高了6.49%和30.70%, 差异显著, 随后开始降低。在处理浓度分别高于2.88 μg/mL和5.77 μg/mL后胚乳中的可溶性蛋白和总糖均显著低于对照组, 同样表现为低促高抑。由此可以说明, 适宜浓度农抗N2粗提物浸种催芽有利于种子增强物质代谢能力, 为水稻种子的萌发奠定物质和能量基础。
|
| 图 3 农抗N2粗提物对水稻种子可溶性总糖和蛋白质含量的影响 |
农抗N2粗提物对水稻种子丙二醛MDA含量的影响, 结果(图 4)显示, 农抗N2粗提物浸种处理水稻种子均能显著降低种子中MDA的含量, 相较对照组分别降低了21.58%、21.97%、23.94%、13.32%、10.51%和17.76%, 差异显著。当处理浓度为0.23-5.77 μg/mL时, MDA含量先降低(0.23-1.15 μg/mL)后升高(≥2.88 μg/mL), 且在1.15 μg/mL时期含量最低1.12 mmoL/g·FW, 差异显著。由此说明, 农抗N2浸种处理能有效缓解水稻种子膜质过氧化, 有利于提高水稻种子的组织保护能力。
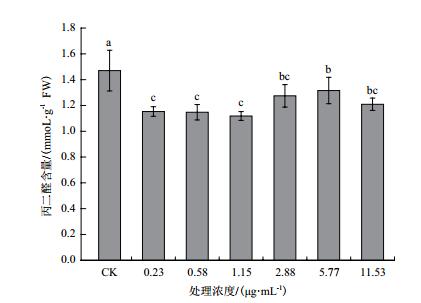
|
| 图 4 农抗N2粗提物对水稻种子MDA含量的影响 |
水稻种子发芽势、发芽率、发芽指数和活力指数是评价和反映水稻种子萌发速度、整齐度和幼苗生长状况的重要指标, 指数越大表明种子发芽速度快、整齐度高、长势好[26]。实验结果表明, 0.23 μg/mL至1.15 μg/mL范围内的农抗N2粗提物浸种能有效提高种子发芽率, 促进种子快速发芽, 显著增强种子活力, 幼苗长势良好;当处理浓度达到5.77 μg/mL后幼苗发芽势弱, 根、芽均受抑制, 且发芽率、活力指数和贮藏物质运转率显著低于对照组。此外, 贮藏物质运转率TR可以反映种子对贮藏物质的运转效率[27]。由此可以推测, 农抗N2粗提物的浓度高于5.77 μg/mL后贮藏物质转运效率显著降低是造成种子发芽率、活力指数等显著下降的主要原因, 与陈燕妮等[21]的研究结果一致。综上可知, 适宜浓度农抗N2粗提物浸种可促进种子萌发和提高幼苗素质, 高浓度对种子活力有抑制作用。
水稻等禾本类作物种子胚乳中的贮藏物质主要是淀粉, 胚乳中的淀粉酶是种子萌发初期物质和能量代谢快速启动的重要保障, 为ATP与蛋白质的合成分别提供底物和碳骨架, 是幼苗形态建成与生长发育的重要生理基础[28]。除淀粉外, 种子中可溶性总糖也是常见的碳水化合物, 主要有葡萄糖、果糖、麦芽糖和蔗糖等, 是萌发过程的直接呼吸底物和重要养分来源, 对幼胚的初期生长具有重要作用;贮藏蛋白质是种子萌发过程中用于胚部新细胞建立的主要物质基础[29, 30], 同时, 植物可利用自身可溶性糖与可溶性蛋白等渗透调节物质, 有效维持或降低植物体内细胞渗透势, 在保护蛋白质分子、抵御氧化胁迫等方面具有重要作用[31, 32]。试验结果发现, 经浓度0.23-1.15 μg/mL的农抗N2粗提物浸种处理后种子胚乳中可溶性蛋白与总糖均有提高, 且分别在0.58和1.15 μg/mL时达到最大, 相比对照差异显著;同时各类淀粉酶活性也得到显著提高, 胚乳中的淀粉酶活性与可溶性蛋白、总糖的含量变化趋势基本一致, 一定程度上呈正相关, 与刘晶等[33]的研究结果相似。因此可以说明, 0.23-1.15 μg/mL的农抗N2粗提物浸种能显著激活淀粉酶活性, 促进淀粉水解, 增强种子萌发过程的物质能量代谢能力, 进而显著提高可溶性总糖与蛋白质的含量;有助于可溶性糖和可溶性蛋白通过维持种子体内细胞渗透势, 增强幼苗的抗逆性。
丙二醛(MDA)是植物器官脂质过氧作用产生的一种细胞毒素, 不仅会加剧脂质膜的损伤, 也会引起蛋白质、核酸等生命大分子的交联聚合, 其含量直接反映了机体脂质的过氧化程度, 间接地反映了细胞的损伤程度[34, 35]。实验结果表明, 0.23-5.77 μg/mL浓度范围农抗N2粗提物浸种处理能显著降低丙二醛含量, 且其含量先降后升, 因此可以推断, 适宜浓度的农抗N2粗提物浸种能有效保护种子细胞免遭质膜损伤, 提高幼苗的逆境生存能力。综上可知, 链霉菌新种Streptomyces sp. N2作为一株生防放线菌, 可借助微生物发酵手段制备出高效、广谱的抗真菌活性物质, 实现其在生物防治种(土)传病害中生防应用, 为开发新型种子处理剂奠定坚实的基础。
4 结论适宜浓度(0.23-1.15 μg/mL)农抗N2粗提物浸种有利于增强水稻细胞代谢强度、促进根芽生长、加快物质转运效率, 提高种子发芽率, 提高幼苗抗逆性。高浓度(≥2.88 μg/mL)浸种虽有利于缓解膜质过氧化, 但淀粉酶活力受到显著抑制, 因无法满足种子萌发所需的物质和能量, 而抑制种子萌发。综上, 适宜浓度的农抗N2粗提物浸种有利于水稻种子萌发, 但是否其中的抗真菌活性物质起主导作用, 有待进一步深入研究。
| [1] | Fujisawa M, Baba T, Nagamura Y, et al. The map-based sequence of the rice genome[J]. Nature, 2005, 436 (7052): 793–800. DOI:10.1038/nature03895 |
| [2] | Rahman MME, Ali ME, Ali MS, et al. Hot water thermal treatment for controlling seed-borne mycoflora of maize[J]. Int J Sustain Crop Prod, 2008, 3 (5): 5–9. |
| [3] | 贺转转, 邢佳佳, 陈玲, 等. 植物幼苗抗逆机制研究进展[J]. 生物技术通报, 2013(2): 1–7. |
| [4] | 杜景红, 李北齐, 薛庆喜. NaCl浸种对水稻种子发芽的影响[J]. 中国农学通报, 2013, 29(3): 33–35. DOI:10.11924/j.issn.1000-6850.2012-2662 |
| [5] | Walcott RR. Detection of seedborne pathogens[J]. Horttechnology, 2003, 13 (1): 40–47. |
| [6] | 彭卫福, 李昆太, 曾勇军. 水稻病害的微生物防治研究进展[J]. 江西农业大学学报, 2015(4): 625–631. |
| [7] | 赵帅锋, 严百元, 胡选祥, 等. 不同浸种药剂和浓度对水稻发芽的安全性研究[J]. 中国植保导刊, 2016(8): 63–65. |
| [8] | Binyam T. Review on seed health tests and detection methods of seedborne diseases[J]. Journal of Biology, Agriculture and Healthcare, 2015 : 176–184. |
| [9] | Rajput MA, Pathan MA, Lodhi AM, et al. Studies on seed-borne fungi of wheat in sindh province and their effect on seed germination[J]. Pakistan Journal of Botany, 2005, 37 (1): 181–185. |
| [10] | Niaz I, Dawar S. Detection of seed borne mycoflora in maize(Zea mays L.)[J]. Pakistan Journal of Botany, 2009, 41 (1): 443–451. |
| [11] | Du PV, Cuong ND, Nghiep HV, et al. Survey on seed borne fungi and its effects on grain quality of common rice cultivars in the Mekong Delta[J]. Omonrice, 2001, 9 : 107–113. |
| [12] | 周军, 周建明. 影响水稻种子发芽的主要因素及控制途径[J]. 安徽农业科学, 2014(12): 3520–3523. DOI:10.3969/j.issn.0517-6611.2014.12.021 |
| [13] | 邓接楼, 张高阳, 周木华, 等. 不同水稻药剂浸种对杂交水稻种子萌发及幼苗生长的影响[J]. 上饶师范学院学报, 2016(3): 85–89. |
| [14] | Naveenkumar R, Muthukumar A, Sangeetha G, et al. Developing eco-friendly biofungicide for the management of major seed borne diseases of rice and assessing their physical stability and storage life[J]. Comptes Rendus Biologies, 2017, 340 (4): 214–225. DOI:10.1016/j.crvi.2017.03.001 |
| [15] | Kumar SN, Nambisan B. Antifungal activity of Diketopiperazines and Stilbenes against plant pathogenic fungi in vitro[J]. Applied Biochemistry and Biotechnology, 2014, 172 (2): 741–754. DOI:10.1007/s12010-013-0567-6 |
| [16] | O Callaghan M. Microbial inoculation of seed for improved crop performance: issues and opportunities[J]. Applied Microbiology and Biotechnology, 2016, 100 (13): 5729–5746. DOI:10.1007/s00253-016-7590-9 |
| [17] | Boukaew S, Prasertsan P. Factors affecting antifungal activity of Streptomyces philanthi RM-1-138 against Rhizoctonia solani[J]. World Journal of Microbiology and Biotechnology, 2014, 30 (1): 323–329. DOI:10.1007/s11274-013-1424-z |
| [18] | 魏赛金, 王世强, 李昆太, 等. 链霉菌702对水稻种子萌发、幼苗生长及土壤微生物的影响[J]. 农业环境科学学报, 2014(5): 853–861. DOI:10.11654/jaes.2014.05.005 |
| [19] | Xu B, Chen W, Wu Z, et al. A novel and effective Streptomyces sp. N2 against various phytopathogenic fung[J]. Applied Biochemistry and Biotechnology, 2015, 177 (6): 1338–1347. DOI:10.1007/s12010-015-1818-5 |
| [20] | 李善家, 韩多红, 王恩军, 等. 外源甜菜碱对盐胁迫下黑果枸杞种子萌发和幼苗保护酶活性的影响[J]. 草业科学, 2016, 33(4): 674–680. DOI:10.11829/j.issn.1001-0629.2015-0404 |
| [21] | 陈燕妮, 刘飞. 干旱胁迫对'大同34号'谷子种子萌发和幼苗生长发育的影响[J]. 中国农学通报, 2016, 32(15): 55–58. DOI:10.11924/j.issn.1000-6850.casb15110006 |
| [22] | 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006. |
| [23] | 邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2003. |
| [24] | 张志良, 翟伟菁. 植物生理学实验指导[M]. 第3版. 北京: 高等教育出版社, 2003. |
| [25] | 隋丽, 徐文静, 杜茜, 等. 放线菌769发酵液对水稻体内主要防御酶活性的影响[J]. 吉林农业大学学报, 2009(4): 382–384. |
| [26] | 何宏艳, 雷梦梦, 吴玉霞, 等. 药剂浸种对辣椒种子萌发和幼苗生理特性的影响[J]. 种子世界, 2015(11): 34–37. DOI:10.3969/j.issn.1000-8071.2015.11.016 |
| [27] | 郑敏娜, 李荫藩, 梁秀芝, 等. 水分胁迫对豌豆种子萌发和幼苗生长发育的影响[J]. 山西农业科学, 2012(3): 212–216. |
| [28] | 赵玉锦, 王台. 水稻种子萌发过程中α-淀粉酶与萌发速率关系的分析[J]. 植物学通报, 2001(2): 226–230. |
| [29] | 柯贞进, 尹美强, 温银元, 等. 干旱胁迫下聚丙烯酰胺浸种对谷子种子萌发及幼苗期抗旱性的影响[J]. 核农学报, 2015(3): 563–570. DOI:10.11869/j.issn.100-8551.2015.03.0563 |
| [30] | 陈蕾太, 孙爱清, 杨敏, 等. 逆境条件下小麦种子活力与种子萌发相关酶活性及其基因表达的关系[J]. 应用生态学报, 2017(02): 609–619. |
| [31] | 赵红, 李文华. 废电池浸出液对水稻种子萌发及幼苗渗透调节物质含量的影响[J]. 河南农业科学, 2017(1): 26–29. |
| [32] | 李丽杰, 顾万荣, 李从锋, 等. DCPTA对低温下玉米叶片抗氧化系统及渗透调节物质的影响[J]. 植物生理学报, 2016(12): 1829–1841. |
| [33] | 刘晶, 张鹤婷, 殷悦, 等. 外源H2S对干旱胁迫下水稻种子萌发过程淀粉酶活性的影响[J]. 热带作物学报, 2016(11): 2119–2126. DOI:10.3969/j.issn.1000-2561.2016.11.014 |
| [34] | Shen C, Miao J, Li Y, et al. Effect of benzo[J]. Journal of Ocean University of China, 2016, 15 (2): 303–310. DOI:10.1007/s11802-016-2771-9 |
| [35] | 刘晶, 张鹤婷, 殷悦, 等. 外源硫化氢对干旱胁迫下萌发水稻种子抗氧化代谢的影响[J]. 南方农业学报, 2017(1): 31–37. |