成体干细胞是一类位于成体组织中的未分化细胞, 具有自我更新(Self-renewal)能力与分化潜能, 这两方面的特性对于组织内稳态的维持及组织损伤后修复具有重要意义[1]。干细胞的增殖与分化之间的平衡受到细胞内外部因素的共同精细调控[2]。增殖能力过强会引起干细胞积聚, 甚至肿瘤发生。分化过度则会导致干细胞丢失, 组织早衰。因此, 研究干细胞自我更新与有序分化的调控机制对于机体组织的维持机理揭示以及癌症治疗、再生医学方面的临床应用具有重要价值。果蝇卵巢作为实验材料易获取, 内含的生殖干细胞具在体识别优势, 是在体研究干细胞命运调控机制的理想系统[3]。
果蝇卵巢的基本结构单位为卵巢小体, 卵巢小体前端的卵原区(Germarium)中含有2-3个生殖干细胞(GSCs)。在GSC周围是由三类体细胞共同构成的GSC微环境(Niche), 它们分别是端丝细胞(Terminal filament, TF)、帽细胞(Cap cell, CpC)以及护卫细胞。GSC不对称分裂产生的一个子细胞保留干细胞命运, 另一个子细胞则远离微环境形成包囊母细胞(Cystoblast, CB)。CB经4次连续的细胞分裂后形成16细胞包囊, 其中一个细胞获得卵母细胞的命运。GSC的命运受自身内部机制与干细胞微环境共同调控[2]。BMP(Bone morphogenetic protein)信号是已知调控生殖干细胞自我更新与分化的最主要的微环境信号。微环境帽细胞能分泌信号分子Dpp, 激活GSC中BMP信号通路, 抑制分化促进基因bam的转录, 进而维持GSC的未分化状态[4-6]。微环境护卫细胞位于生殖干细胞侧方, 其在GSC命运调控过程中同样扮演了重要角色[7]。研究显示, 护卫细胞中的EGFR信号能抑制BMP信号的异位激活, 促进GSC的正常分化[8]。此外, 护卫细胞中一些因子如Lsd1、Rho信号等可通过抑制dpp的转录影响BMP信号激活[7, 9]
SWI/SNF是一种进化上相对保守的染色质重塑复合物。在果蝇中, 至少存在两种不同的SWI/SNF类型的重塑复合物BAP和PBAP[10]。已有文献报道, 果蝇SWI/SNF复合物共有的核心亚基Mor, Brm, Snr1是果蝇正常卵子发生过程所必需的[11-13]。那么其他非共有的亚基是否也参与了GSC的相应发育过程呢?已知Osa是BAP形式复合物中的特有组分。本研究利用果蝇GAL4/UAS表达系统, 结合RNAi技术, 试图探究Osa在果蝇卵巢生殖干细胞分化中的功能并分析其可能的作用机理, 旨在为探明干细胞自我更新与分化的调控机理提供更多线索。
1 材料与方法 1.1 材料采用的果蝇品系:c587-gal4、UAS-mCD8;;GFP、UAS-osa-RNAi-38285、UAS-osa-RNAi-35447以及作为阴性对照的UAS-mcherry-RNAi均购于Bloomington果蝇资源保藏库。本研究中采用的实验试剂:荧光一抗mouse anti-α-spectrin(1:20, DHSB)、rat anti-vasa(1:50, DHSB)、rabbit anti-vasa(1:200, Santa Cruz Biotech)、rabbit anti-GFP(1:1 000, Invitrogen)、rabbit anti-pMad(1:2 000, Edward Laufer)、rabbit anti-βgal(1:1 000, Cappel);荧光二抗Alexa r488、Alexa m488、Alexa r546、Alexa m546均购于Molcular Probe公司, 工作浓度均为1:1 000。PBS购于捷瑞生物工程有限公司;Triton-100购于BioRad公司;山羊血清购于GIBCO公司;多聚甲醛购于SIGMA公司。
1.2 方法 1.2.1 果蝇遗传操作采用GAL4/UAS系统, c587-gal4品系分别与UAS-mcherry-RNAi、UAS-osa-RNAi-38285、UAS-osa-RNAi-35447品系果蝇杂交, 并于25℃进行2 h的卵收集。待培养至F1代果蝇羽化后, 挑选所需的雌性果蝇置于29℃培养箱中继续培养5 d后对其卵巢进行解剖。具体步骤为:左手镊固定成虫, 用右手镊在果蝇尾部扯开一个小口, 将腹部所含所有组织从小口中挤出, 并从中挑出一对卵巢, 完成解剖。
1.2.2 免疫荧光染色将解剖好了的卵巢置于含1 mL固定剂(4%多聚甲醛溶液)中固定30 min;用含0.3%Triton-x 100的PBS(PBST)洗涤3次;加入含1%Triton-x 100的PBS, 将组织吹散后渗透1 h;渗透完成后, 使用封闭液封闭2 h;继而用含合适工作浓度的一抗4℃孵育过夜;第2天, 用洗涤液洗涤4次, 每次20 min;加入封闭液封闭1 h, 之后使用二抗稀释液室温避光孵育2 h;孵育完成后加入DAPI至最终浓度为1:2 000, 室温染色10 min;最后用PBST避光洗涤4次, 每次20 min, 染色完成。
1.2.3 果蝇卵巢组织制片及显微观察在光学显微镜下, 将染色完成后的果蝇卵巢组织移至九孔玻璃平板中, 用较尖细的镊子去除卵巢小体后端相对成熟的卵室, 留下前端未成熟透明状的卵原区, 收集完成后用移液器吸至载玻片上, 盖玻片压片后用指甲油封片。待指甲油完全干后即可显微观察。本研究在荧光显微镜(Nikon Eclipse 80i)下进行荧光观察, 并利用激光共聚焦显微镜(Leica TCS SP5) 采集荧光染色图像。
1.2.4 数据统计分析本研究使用GraphPad Prism6软件对实验数据进行统计分析并制图, 显著性检验使用独立样本t检验或χ2检验。
2 结果 2.1 下调护卫细胞中osa的表达导致GSC分化受阻为探究EC中Osa在源于GSC的生殖细胞谱系分化发育中的功能, 使用c587-gal4驱动表达UAS-osa-RNAi转基因, 在果蝇卵巢组织卵原区EC细胞中特异性下调osa的表达, 并通过免疫荧光染色标识融合体, 辨识该细胞器的形态特征, 以判断生殖细胞谱系的分化发育状态。已知GSC和CB细胞中融合体呈球形, 称之为血影小体;在处于不同分化发育阶段的2细胞期、4细胞期及8-16细胞期生殖细胞包囊中该细胞器分别呈棒状、U形及分枝状结构。数据分析显示, 与对照组相比, 敲减EC中的osa可致卵原区中含球状血影小体的生殖细胞(Undifferentiated germ cells, UGCs)数量显著增多(图 1), 表明源于GSC的生殖细胞谱系分化发育受阻。上述遗传分析结果提示Osa以细胞非自治性方式参与果蝇卵巢中GSC的分化调控。
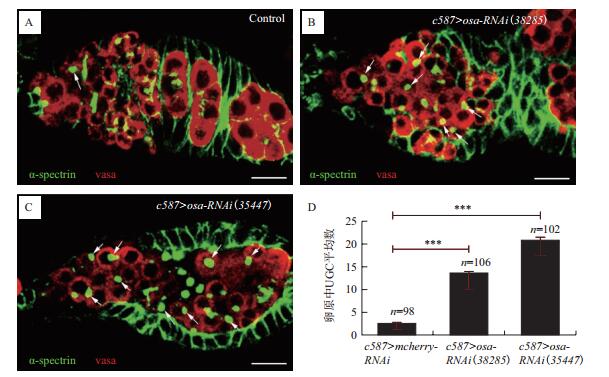
|
| 图 1 下调护卫细胞中osa的表达影响GSC有序分化 A:对照组卵原区中含球状融合体的生殖细胞(箭头所示, 不包含GSC);B、C:osa表达下调了的卵原中可以检测到UGCs(箭头所示)显著增多;D:卵原中UGCs平均数统计(**p < 0.01, ***p < 0.001)。图中α-spectrin抗体(绿色)标记融合体, vasa抗体(红色)标记生殖细胞。图中的标尺均为10 μm, 显微放大倍数为40倍 |
已知BMP信号活性精细调控果蝇卵巢中GSC的自我更新与分化。为探讨Osa介导的GSC分化调控的分子机理, 进一步在敲减EC中osa的遗传背景下, 检测BMP信号活性的分布有无异常。磷酸化Mad(pMad)是BMP信号转导子Mad的激活形式, Dad-lacZ是BMP信号通路靶基因Dad的报告基因, 磷酸化Mad(pMad)或Dad-lacZ的表达与否是评估BMP信号通路激活的分子标志。本实验中, 通过pMad或βgal抗体荧光染色来检测BMP信号活性的分布。如图 2所示, 对照组中pMad表达局限在果蝇卵巢组织卵原区最前端的2-3个GSC中, 而实验组果蝇卵原区中pMad的表达范围显著扩大, 表现为卵原区前端pMad阳性生殖细胞数明显增多, 同时对实验组卵原中表达Dad-lacZ的生殖细胞数目进行统计, 发现其较对照组也显著增多。pMad及Dad-lacZ检测结果均表明下调EC中osa的表达可致卵原区BMP信号过度激活, 信号活性分布扩张, 进而阻滞GSC的正常分化。
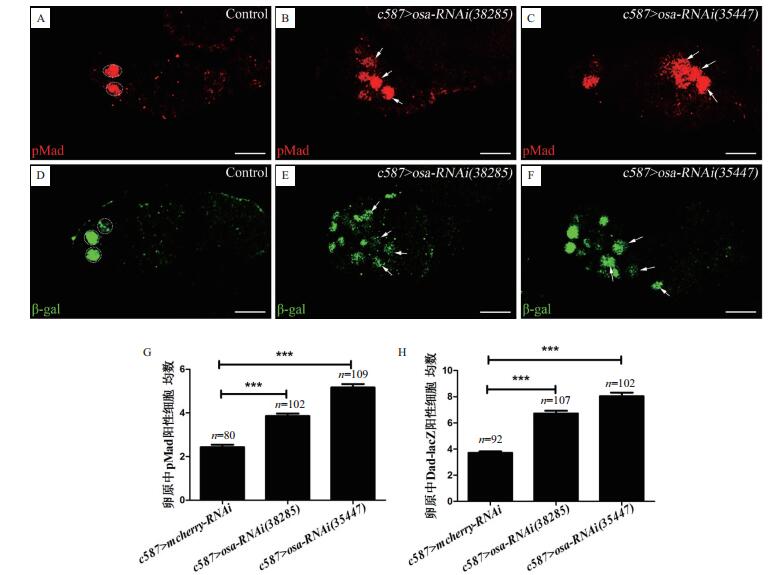
|
| 图 2 osa表达下调对BMP信号活性的影响 A:在对照组卵原区中, 仅有最前端的两个生殖细胞显示pMad阳性表达(圆圈所示);B、C:下调护卫细胞中osa的表达后, pMad表达范围显著扩大(箭头所示);D:对照组卵原中Dad-lacz表达模式;E、F:osa下调的卵原中Dad-lacZ阳性细胞数目增多(箭头所示);G:卵原中pMad阳性细胞平均数统计;H:卵原中Dad-lacZ阳性细胞平均数统计(**P < 0.01, ***P < 0.001)。图D、E、F中β-gal抗体标记Dad-lacZ阳性细胞。图中的标尺均为10 μm, 显微放大倍数为40倍 |
已有研究表明, EC细胞对生殖细胞的包裹缺陷与生殖细胞谱系分化发育受阻存在因果关联。为验证这一细胞学机制是否同样存在于Osa介导的GSC分化调控中, 我们基于免疫荧光染色技术对osa表达下调的卵巢组织中的EC细胞形态进行评估。本实验利用报告基因mCD8-GFP勾勒EC的形态。实验结果(图 3)显示, 与对照组相比, 实验组卵原区中EC的形态发生改变, 不能伸出伪足以包裹分化中的生殖细胞。这一结果初步证实, 敲减果蝇卵巢组织EC中osa导致EC不能正常包裹生殖细胞。

|
| 图 3 osa表达下调对EC细胞形态的影响 A:以报告基因mCD8-GFP标记EC的形态, 可观察到对照组卵原区中护卫细胞能伸出细胞突起包裹生殖细胞(箭头所示);B、C:在osa表达下调的卵原中, 护卫细胞形态异常(箭头), 不能包裹生殖细胞;D:形态正常的护卫细胞卵原及出现形态缺陷的卵原占样本总数(n)的比例统计(**P < 0.01, ***P < 0.001)。图中mCD8-GFP(绿色)标记护卫细胞形态, vasa抗体(红色)标记生殖细胞。图中的标尺均为10μm, 显微放大倍数为40倍 |
生殖干细胞不断自我更新与分化以保障果蝇卵巢在整个生命周期中的生殖活力[1]。大量研究证明, 干细胞自我更新与分化之间的协调受其自身内部因素及源于微环境的外部机制在转录、翻译等多种水平上共同调控, 表观遗传调控作为一种重要的调控方式在其中发挥了关键作用[14, 15]。关于染色质重塑复合物BAP中特有组分Osa在成虫果蝇翅膀的形态建成以及神经发育过程中的调控作用已有报道[16, 17]。本研究运用UAS/GAL4二元表达系统又对Osa在果蝇卵巢生殖干细胞GSC分化发育过程中的功能进行探究, 发现特异性下调果蝇卵巢卵原区护卫细胞中osa的表达可导致GSC分化受阻, 提示osa以细胞非自治性方式在GSC的分化发育过程中发挥功能。进一步研究显示, BMP信号通路在实验组果蝇卵原区中过度激活, 其活性分布范围明显扩大。基于此我们推测, Osa调控GSC的分化过程可能依赖于BMP信号路径。
已知EC是生殖干细胞的重要微环境细胞。正常情况下, EC能伸出细胞伪足以包裹生殖干细胞及其分化而来的子细胞。研究显示, 多个信号通路参与调控EC对生殖细胞的包裹行为。如EGFR(Epidermal growth factor receptor)信号通路配体加工激活所需的关键因子Stet或JAK/STAT信号通路核心转录因子Stat92E的功能丧失或表达下调均导致EC细胞形态异常及其对生殖细胞包裹缺陷[18, 19]。2011年Kirilly等[7]进一步研究发现, 护卫细胞的包裹缺陷可引起生殖细胞分化受阻。EC动态的细胞伪足可能为分裂分化了的生殖细胞后移提供动力。本研究发现在护卫细胞中下调osa的表达会导致护卫细胞形态改变, 使其不能形成细胞突起以包裹生殖细胞。因此, 维持EC形态学特征可能是Osa调控GSC分化的细胞学基础。鉴于Osa是染色质重塑复合物BAP的重要亚基, 推论其作用于EC包裹生殖细胞的分子机理应涉及对关键靶基因的表达调控, 尤其是之前提及的多个信号通路的核心组分[18, 19]。已有报道表明, 在果蝇翅膀中, Osa是EGFR信号通路多种靶基因的正常表达所必需的[16]。因此, 探究Osa通过调控EGFR信号活性在EC包裹生殖细胞过程中发挥作用这一可能分子机理将是我们未来的研究重点。
进一步的研究还将利用ChIP-seq、高通量转录组测序及特定遗传分析手段, 从靶基因层面揭示Osa调控生殖细胞分化的分子机制。
4 结论染色质重塑复合物BAP中的特有组分Osa以非细胞自治性的方式作用于GSC的分化发育过程, 其作用机理可能涉及BMP信号通路及EC细胞特定的形态学过程。
| [1] | Morrison SJ, Spradling AC. Stem cells and niches: mechanisms that promote stem cell maintenance throughout life[J]. Cell, 2008, 132 (4): 598–611. DOI:10.1016/j.cell.2008.01.038 |
| [2] | Ting X. Control of germline stem cell self‐renewal and differentiation in the Drosophila ovary: concerted actions of niche signals and intrinsic factors[J]. Wiley Interdisciplinary Reviews: Developmental Biology, 2013, 2 (2): 261–273. DOI:10.1002/wdev.v2.2 |
| [3] | Kirilly D, Xie T. The Drosophila ovary: an active stem cell community[J]. Cell Research, 2007, 17 (1): 15–25. DOI:10.1038/sj.cr.7310123 |
| [4] | Xie T, Spradling AC. Decapentaplegic is essential for the mainten-ance and division of germline stem cells in the Drosophila ovary[J]. Cell, 1998, 94 (2): 251–260. DOI:10.1016/S0092-8674(00)81424-5 |
| [5] | Song X, Wong MD, Kawase E, et al. Bmp signals from niche cells directly repress transcription of a differentiation-promoting gene, bag of marbles, in germline stem cells in the Drosophila ovary[J]. Development, 2004, 131 (6): 1353–1364. DOI:10.1242/dev.01026 |
| [6] | Chen D, McKearin DM. A discrete transcriptional silencer in the bam gene determines asymmetric division of the Drosophila germline stem cell[J]. Development, 2003, 130 (6): 1159–1170. DOI:10.1242/dev.00325 |
| [7] | Kirilly D, Wang S, Xie T. Self-maintained escort cells form a germline stem cell differentiation niche[J]. Development, 2011, 138 (23): 5087–5097. DOI:10.1242/dev.067850 |
| [8] | Liu M, Lim TM, Cai Y. The Drosophila female germline stem cell lineage acts to spatially restrict DPP function within the niche[J]. Science Signaling, 2010, 3 (132): ra57–ra57. |
| [9] | Eliazer S, Shalaby NA, Buszczak M. Loss of lysine-specific demethylase 1 nonautomously causes stem cell tumors in the Drosophila ovary[J]. Proceedings of the National Academy of Sciences, 2011, 108 (17): 7064–7069. DOI:10.1073/pnas.1015874108 |
| [10] | Mohrmann L, Langenberg K, Krijgsveld J, et al. Differential targeting of two distinct SWI/SNF-related Drosophila chromatin-remodeling complexes[J]. Molecular and Cellular Biology, 2004, 24 (8): 3077–3088. DOI:10.1128/MCB.24.8.3077-3088.2004 |
| [11] | Brizuela BJ, Kennison JA. The Drosophila homeotic gene moira regulates expression of engrailed and HOM genes in imaginal tissues[J]. Mechanisms of Development, 1997, 65 (1): 209–220. |
| [12] | Brizuela BJ, Elfring L, Ballard J, et al. Genetic analysis of the brahma gene of Drosophila melanogaster and polytene chromosome subdivisions 72AB[J]. Genetics, 1994, 137 (3): 803–813. |
| [13] | Zraly CB, Marenda DR, Nanchal R, et al. SNR1 is an essential subunit in a subset of Drosophila brm complexes, targeting specific functions during development[J]. Developmental Biology, 2003, 253 (2): 291–308. DOI:10.1016/S0012-1606(02)00011-8 |
| [14] | He J, Xuan T, Xin T, et al. Evidence for chromatin-remodeling complex PBAP-controlled maintenance of the Drosophila ovarian germline stem cells[J]. PloS One, 2014, 9 (7): e103473. DOI:10.1371/journal.pone.0103473 |
| [15] | Xin T, Xuan T, Tan J, et al. The Drosophila putative histone acetyltransferase Enok maintains female germline stem cells through regulating Bruno and the niche[J]. Developmental Biology, 2013, 384 (1): 1–12. DOI:10.1016/j.ydbio.2013.10.001 |
| [16] | Terriente-Félix A, de Celis J F. Osa, a subunit of the BAP chromatin-remodelling complex, participates in the regulation of gene expression in response to EGFR signaling in the Drosophila wing[J]. Developmental Biology, 2009, 329 (2): 350–361. DOI:10.1016/j.ydbio.2009.03.010 |
| [17] | Eroglu E, Burkard T R, Jiang Y, et al. SWI/SNF complex prevents lineage reversion and induces temporal patterning in neural stem cells[J]. Cell, 2014, 156 (6): 1259–1273. DOI:10.1016/j.cell.2014.01.053 |
| [18] | Schulz C, Wood CG, Jones DL, et al. Signaling from germ cells mediated by the rhomboid homolog stet organizes encapsulation by somatic support cells[J]. Development, 2002, 129 (19): 4523–4534. |
| [19] | Decotto E, Spradling AC. The Drosophila ovarian and testis stem cell niches: similar somatic stem cells and signals[J]. Developmental cell, 2005, 9 (4): 501–510. DOI:10.1016/j.devcel.2005.08.012 |




