水稻的雄性不育材料既是提高育种效率的宝贵种质资源, 也是研究植物生殖生物学的重要实验材料。深入研究水稻生殖发育过程及其机理对于改进育种方法, 促进生产实践有着重要的指导意义[1, 2]。在被子植物雄性生殖发育过程中, 花粉壁的形成是其中一个关键步骤, 目前研究发现多数雄性不育性状都与花粉壁发育异常相关[3]。对花粉壁的研究不仅在理论上具有重大意义, 在育种生产上也极为重要。花粉形成的外壁结构坚硬并具有粘性, 它既可以在环境变化中保护花粉, 又能够帮助花粉与媒体的附着和柱头的识别。花粉壁的发育是一个极其复杂的过程, 小孢子质膜外积累胼胝质并形成初生外壁后, 以初生外壁形成的模板不断积累孢粉素等组分最终发育成为成熟的花粉外壁[4-8]。整个过程当中, 胼胝质层是初生外壁的沉积模板, 初生外壁又进而决定花粉外壁的沉积模式。初生外壁的沉积物的主要组分为多聚糖、纤维素, 同时含有一些蛋白质。而花粉外壁的主要成分是长链脂肪酸、氧化芬芳环以及苯基丙酸类物质聚合而成的孢粉素, 具有抗腐蚀的特性。近年来, 通过观察雄性不育突变体的花粉外壁的结构形态, 结果阐明了胼胝质层与花粉外壁沉积模式的关系[9, 10]。但是对沉积物组分的影响尚未有深入的研究。
最近, 水稻雄性不育突变体gsl5被研究证明花粉发育过程中细胞板和初生壁中胼胝质成分明显缺失[11]。胼胝质缺失导致了花粉外壁的结构形态产生了极大的变化, 孢粉素积累异常, 最终造成雄性不育。为了进一步研究胼胝质层缺失对花粉壁多糖组分的改变, 本研究对gsl5突变体花粉进行了气谱分析, 试图阐述花粉壁发育过程中单糖组分的含量变化, 对深入研究花粉壁的形成及其功能具有重要意义。
1 材料与方法 1.1 材料亲本参照是选用本实验中使用的品种Oryza Japonica, 突变体是在实验中发现的雄性不育突变体gsl5。以上材料均在河北省廊坊市(海拔1500米)中国农业科学院基地种植, 年均气温3℃, 年均降水量390 mm, 年均日照时数2 896 h。突变体gsl5从2010年至2014年与Oryza Japonica回交4次, 后期两次采用大棚种植, 日照时间为12 h和8 h两种。在本试验中检测花粉细胞壁单糖组分所使用的样品为2013年在大棚中12 h日照种植的。
1.2 方法 1.2.1 提取花粉细胞壁9000水稻花穗中的花粉被人工收集后加入3倍体积的95%的乙醇, 共收集3个生物学重复。5 000×g离心后弃上清, 加入70%的酒精重悬, 离心。清洗3次后对沉淀物进行研磨并用70%的酒精在70℃孵育15 min, 然后将沉淀加入氯仿:甲醇(1:1) 混合液, 离心弃上清, 并依此清洗3次。最终沉淀物为花粉细胞壁组分, 干燥后用于后续实验。
1.2.2 提取花粉细胞壁富含胶质的组分富含胶质的组分用草酸铵提取法[12]获得。样品经0.5%草酸铵煮沸1 h后离心, 取上清透析。
1.2.3 提取花粉细胞壁富含半纤维素的组分富含半纤维素的组分用KOH提取法[12]获得。先将草酸铵不溶物用4 mol/L KOH、20 mmol/l NaBH4室温溶解12 h。KOH不溶物用pH5.5的乙酸溶解透析后冷冻干燥。
1.2.4 色谱分析色谱分析单糖组分的方法参照York等[12]的方法进行, 用肌醇作为内参。各种组分经1 mol/L methanolic-HCl 80℃处理16 h, 自由单糖转化为甲基糖苷。110℃硅烷化20 min后, 干燥样品, 用环己烷溶解。然后上机GC3800 Varian检测。
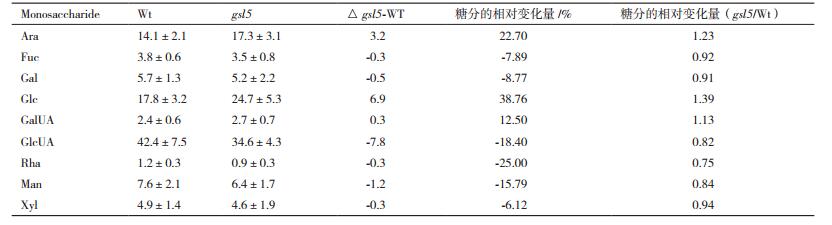
2 结果 2.1 花粉壁单糖组分水稻突变体gsl5胼胝质层缺失后总花粉壁单糖组分变化见表 1, 其中阿拉伯糖(Ara)、葡萄糖(Glc)和半乳糖醛酸(GalUA)分别提高了22.70%、38.76%和12.5%;另外岩藻糖(Fuc)、半乳糖(Gal)、葡萄糖醛酸(GlcUA)、鼠李糖(Rha)、甘露糖(Man)和木糖(Xyl)则分别降低了7.89%、8.77%、18.4%、25%、15.79%和6.12%。概括来说, 总花粉壁组分单糖变化不大, 多数单糖组分变化未超过20%。变化较大的是阿拉伯糖、半乳糖醛酸和鼠李糖, 超过了20%的增减。与后面富含胶质或者富含半纤维素的花粉壁比较, 总花粉壁单糖组分变化并不明显。
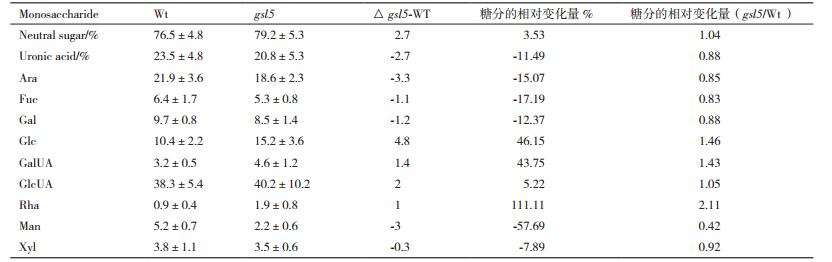
水稻突变体gsl5胼胝质层缺失后花粉壁富含胶质的单糖组分变化见表 2, 其中中性糖、葡萄糖、半乳糖醛酸、葡萄糖醛酸和鼠李糖分别增加了3.53%、46.15%、43.75%、5.22%、111.11%;另外糖醛酸、阿拉伯糖、岩藻糖、半乳糖、甘露糖和木糖分别降低了11.49%、15.07%、17.19%、12.37%、57.69%和7.89%。概括来说, 富含胶质的组分单糖变化较大, 4种单糖的增减都超过20%, 其中鼠李糖的变化超过2倍, 增加显著。与总花粉壁或者富含半纤维素的花粉壁比较, 变化的单糖种类并不多, 但是鼠李糖的增加是最高的。
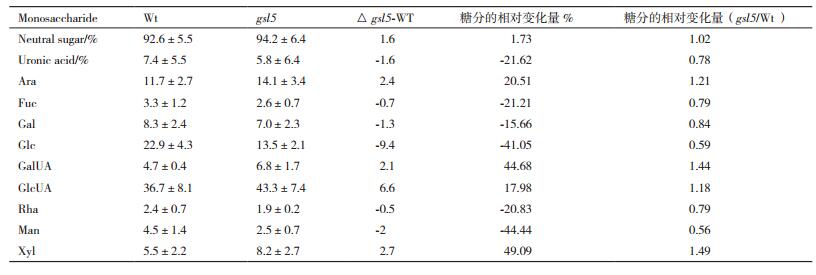
水稻突变体gsl5胼胝质层缺失后花粉壁富含半纤维素的单糖组分变化见表 3, 其中中性糖、阿拉伯糖、半乳糖醛酸、葡萄糖醛酸和木糖分别增加了1.73%、20.51%、44.68%、17.98%和49.9%;另外糖醛酸、岩藻糖、半乳糖、葡萄糖、葡萄糖醛酸、鼠李糖、甘露糖分别降低了21.62%、21.21%、15.66%、41.05%、20.83%和44.44%。对于富含半纤维素的花粉壁单糖组分来讲, 变化比前两者在量上并不是最高的, 但是变化的单糖种类最多, 超过8种单糖有20%以上的增减量。
与许多被子植物雄性不育性状一样, 水稻突变体gsl5的性状是由于花粉壁的形成受到严重阻碍造成的[12]。通过对花粉发育过程的细胞学观察发现其初生外壁胼胝质层缺失, 根据被子植物花粉发育模型, 胼胝质层是不断积累孢粉素等组分的模板, 并以此模板决定花粉外壁的沉积。研究工作已经揭示了胼胝质层在花粉壁形成过程中的关键性作用, 但是它究竟影响了堆积物的哪些方面还鲜有研究。初生外壁沉积物大多由多聚糖、纤维素构成, 其单糖组分是沉积物的一个重要特征。我们的工作发现花粉壁在胼胝质层缺失后的单糖组分变化很复杂, 增加或者降低含量都很普遍, 没有一个统一的模式。至于这些单糖组分的变化如何影响花粉的结构性、硬度和粘性等特征, 有待更进一步的研究。但是我们发现富含胶质和富含半纤维素的花粉壁成分改变了很多单糖的组分, 超过8种单糖在半纤维素花粉壁中产生了较大的变化, 而胶质花粉壁的鼠李糖增加了1倍以上。也就是说前两者在单糖构成上与亲本就有很大的差异。半纤维素和胶质对于细胞壁纤维的弹性具有重要影响, 同时研究已经发现水稻突变体gsl5花粉的形态畸形, 不能形成类球的亲本花粉形态。于是我们推测这两者单糖组分的巨大差异减少了花粉壁的韧性, 从而导致花粉壁不能维持正常的形态。
4 结论初生壁胼胝质层的缺失导致水稻雄性不育突变体gsl5的花粉壁单糖组分发生了很大的变化, 对于花粉的发育和生理功能造成影响。
| [1] | 李仕贵, 周开达, 朱立煌. 水稻温敏显性核不育基因的遗传分析和分子标记定位[J]. 科学通报, 1999, 44(9): 955. |
| [2] | 袁隆平. 水稻光, 温敏不育系的提纯和原种生产[J]. 杂交水稻, 1994(6): 1–3. |
| [3] | Ariizumi T, Toriyama K. Genetic regulation of sporopollenin synthesis and pollen exine development[J]. Annual Review of Plant Biology, 2012, 62 (1): 437. |
| [4] | Lu P, Chai M, Yang J, et al. The Arabidopsis CALLOSE DEFECTIVE MICROSPORE1 gene is required for male fertility through regulating callose metabolism during microsporogenesis[J]. Plant Physiology, 2014, 164 (4): 1893. DOI:10.1104/pp.113.233387 |
| [5] | Worrall D, Hird DL, Hodge R, et al. Premature dissolution of the microsporocyte callose wall causes male sterility in transgenic tobacco[J]. Plant Cell, 1992, 4 (7): 759–71. DOI:10.1105/tpc.4.7.759 |
| [6] | Dong X, Hong Z, Sivaramakrishnan M, et al. Callose synthase(CalS5) is required for exine formation during microgametogenesis and for pollen viability in Arabidopsis[J]. Plant Journal for Cell & Molecular Biology, 2005, 42 (3): 315–328. |
| [7] | Enns LC, Kanaoka MM, Torii KU, et al. Two callose synthases, GSL1 and GSL5, play an essential and redundant role in plant and pollen development and in fertility[J]. Plant Molecular Biology, 2005, 58 (3): 333–349. DOI:10.1007/s11103-005-4526-7 |
| [8] | Nishikawa S, Zinkl GM, Swanson RJ, et al. Callose(β-1, 3 glucan)is essential for Arabidopsis pollen wall patterning, but not tube growth[J]. Bmc Plant Biology, 2005, 5 (1): 1–9. DOI:10.1186/1471-2229-5-1 |
| [9] | Shi X, Han X, Lu T. Callose synthesis during reproductive develop-ment in monocotyledonous and dicotyledonous plants[J]. Plant Signaling & Behavior, 2015, 11 (2). |
| [10] | Shi X, Sun X, Zhang Z, et al. GLUCAN SYNTHASE-LIKE 5(GSL5) plays an essential role in male fertility by regulating callose metabolism during microsporogenesis in rice[J]. Plant & Cell Physiology, 2015, 56 (3): 497. |
| [11] | Yang C, Zhou H, Shi X, et al. Identification and Analysis of Zbs1, a Dominant Male-Sterile Mutant of Naked Oat(Avena nuda L.)[J]. 2016, 56(4). |
| [12] | York WS, Darvill AG, Mcneil M, et al. Isolation and characteriza-tion of plant cell walls and cell wall components[J]. Methods in Enzymology, 1986, 118 (1): 3–40. |