甲醛(Formaldehyde,HCHO)是一种化学性质极为活泼一碳化合物,植物中内源性甲醛来自N-、O-和S-甲基化合物的氧化脱甲基作用[1]。低浓度内源性甲醛可以维持植物细胞中的甲醛循环[2],而暴露于甲醛环境中则会对植物构成非生物胁迫,长时间的甲醛胁迫会导致植物叶片萎蔫和黄化,并伴随叶绿素的降解和细胞中还原糖含量的变化[3, 4],暴露于较高浓度的气体甲醛中会减缓植物的生长并降低植物的发芽率[5]。包括甲醛胁迫在内所有非生物胁迫都会诱导植物的氧化胁迫,使细胞内产生过量活性氧(Reactive oxygen species,ROS),ROS的过量积累会损伤细胞内DNA、脂质和蛋白质,引起细胞内丙二醛(Malondialdehyde,MDA)和过氧化氢(Hydrogen peroxide,H2O2)含量迅速升高,甚至导致有丝分裂异常、基因突变和细胞死亡[6]。植物吸收气体甲醛主要依靠气孔与环境之间的气体交换,甲醛胁迫下植物细胞中ROS的积累会对植物细胞造成氧化胁迫,使H2O2在叶片保卫细胞的叶绿体和细胞质中的积累,引起叶片气孔导度和气孔开度显著下降,植物对甲醛的吸收效率也因此下降[7]。
多胺是一类存在于所有植物活细胞中的脂肪族含氮化合物,广泛参与植物的盐胁迫、干旱胁迫、冷胁迫和金属离子胁迫等非生物胁迫的应答[8]。其在生理pH条件下带正电荷,因此可与带负电荷的生物大分子如DNA、RNA、蛋白质和磷脂等相互作用,并参与调控脂膜的物理化学性质、核酸的结构以及多种酶的活性[9]。精胺(Spermine)和亚精胺(Spermidine)是活细胞中两种主要多胺,它们是活性氧的清除剂和关键抗氧化酶的激活剂[10],有明确的证据表明,外源施加精胺和亚精胺可以通过调控抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)和超氧化物歧化酶(Superoxide dismutase,SOD)等的活性缓解非生物胁迫产生的ROS对植物造成的氧化损伤[11, 12]。此外,通过基因工程手段将精胺和亚精胺合成途径的关键酶在多种植物中过量表达同样增强了植物对非生物胁迫的抗性[13, 14]。
模式植物烟草(Nicotiana tabacum cv. Xanthi)对气体和液体甲醛具有一定吸收能力,通过遗传改良提高烟草的甲醛吸收效率与代谢能力的研究也早有报道[15, 16]。为了研究多胺预处理对烟草响应气体甲醛胁迫的影响,本研究采用生理生化的手段分别对烟草植株进行精胺和亚精胺预处理,通过分析气体甲醛胁迫后烟草叶片中叶绿素含量、过氧化生理指标、4种主要抗氧化酶的活性,以及叶片中代谢产物的变化,考察精胺和亚精胺预处理能否在缓解气体甲醛胁迫对烟草叶片造成的氧化损伤同时增强烟草叶片对气体甲醛的抗性和吸收能力。
1 材料与方法 1.1 材料以野生型烟草(Nicotiana tabacum cv. Xanthi)的无菌培养植株为实验材料,烟草种子来自日本京都大学。
1.2 方法 1.2.1 烟草植株的多胺预处理烟草无菌植株在超净工作台中继代于MS固体培养基,于25℃/24 h光照强度为100 μmol/(m2·s)的组培室中培养30 d,取出植株于MS液体培养基中培养15 d后用于多胺的预处理。两种多胺均以去离子水为溶剂并在电磁搅拌器上充分溶解,处理烟草使用的精胺(100 μmol/L)和亚精胺(200 μmol/L)终浓度均为预实验中所确定。多胺预处理设置3个实验组,每组4株烟草,每株鲜重相近且叶片数相同。采用精胺、亚精胺处理液,以及去离子水分别处理烟草根部4 h后,取出整株烟草用于甲醛胁迫处理。
1.2.2 烟草甲醛吸收率的测定以自制气体甲醛吸收测量装置测定烟草的甲醛吸收效率。实验操作如下:将预处理后的4株烟草根部浸于装有去离子水的组培瓶,并以保鲜膜将组培瓶封口避免水的蒸发对烟草甲醛吸收的干扰。烟草置于玻璃干燥器(0.025 m3)中,内有小型风扇保持空气流动,取少量甲醛溶液(37%)滴加于脱脂棉球,将棉球悬于玻璃干燥器中,以NI-T UT338A型甲醛测定仪置于干燥器中实时监测其中气体甲醛浓度,分别在甲醛浓度达到1、3和5 mg/m3时将脱脂棉球取出,用封口膜密封干燥器边缘,于25℃且光照强度为100 μmol/(m2·s)条件下进行气体甲醛吸收的测定,每10 min记录一次甲醛浓度,并以无烟草的实验组作为气体甲醛挥发对照。
1.2.3 气体H13CHO对烟草胁迫及叶片代谢产物的标记处理参照1.2.2中方法在自制的气体甲醛吸收测量装置中采用高浓度气体H13CHO(约300 mg/m3)处理烟草植株4 h。处理完毕分别从不同预处理的实验组中剪取烟草叶片,用液氮速冻后于-80℃保存备用。13C-NMR核磁样品制备参照Sun等[4]的方法。应用布鲁克核磁共振仪(DRX 500-MHz,中科院昆明植物研究所)进行13C-NMR分析,13C-NMR分析所使用参数参照Zhou等[17]。将13C-NMR光谱中的共振峰通过与已知化合物的13C-NMR谱进行比对,并利用中国科学院上海有机化学研究所的化学专业数据库检索进行确认,计算不同样品中各代谢物的相对含量时,目标共振峰以甲酰胺碳原子的共振峰(166.66 ppm)为内参进行积分。
1.2.4 叶片生理指标及抗氧化酶活性的测定 1.2.4.1 叶绿素含量的测定取上述气体H13CHO处理后的烟草叶片,预冷无菌蒸馏水冲洗叶片4-5次后用吸水纸吸干叶片表面残留的蒸馏水,取0.5 g样品参照舒展等[18]的方法进行测定。
1.2.4.2 MDA和H2O2含量的测定分别取-80℃保存的烟草叶片0.2 g测定MDA和H2O2含量。MDA含量测定采用TBA法[19],H2O2含量采用Gay等[20]的方法。
1.2.4.3 抗氧化酶活性的测定各取-80℃保存的烟草叶片用于定APX、POD、CAT和SOD四种抗氧化酶活性的测定,不同处理的烟草叶片各取0.2 g,其中APX活性测定参照Nakano[21]方法,POD活性测定参照程鹏等[22]的愈创木酚法方法,CAT活性参考王群等[23]的紫外分光光度方法并有所改进,SOD活性测定采用Vuleta等[24]的氮蓝四唑法。
1.2.5 数据分析上述实验生理指标均设3组重复,所测得生理数据以及核磁积分数据采用Exccel 2003进行统计分析,用DPS 7.05对所测得数据进行显著性差异分析(P < 0.05)。
2 结果 2.1 精胺和亚精胺预处理对烟草甲醛吸收的影响将烟草分别置于1、3和5 mg/m3浓度的气体甲醛中,通过甲醛测定仪实时监测玻璃干燥皿中剩余的甲醛浓度分析精胺和亚精胺预处理对烟草吸收气体甲醛的影响,在3个不同甲醛浓度处理60 min后,甲醛浓度均明显下降,这说明烟草对气体甲醛有一定的吸收能力。由图 1-A可知,在1 mg/m3的气体甲醛中处理时间达到60 min时,各实验组中气体甲醛均降至0,其中,100 μmol/L的精胺和200 μmol/L的亚精胺预处理对烟草吸收气体甲醛均有明显的促进作用,在处理时间为50 min时气体甲醛浓度已降至0,且精胺预处理效果好于亚精胺。由图 1-B可知,气体甲醛浓度为3 mg/m3时,精胺和亚精胺预处理均显著提高了烟草吸收气体甲醛的效率,在处理的前10 min,精胺和亚精胺的效果相当,之后的10-60 min精胺效果均好于亚精胺。图 1-C表明精胺和亚精胺预处理同样能提高烟草对5 mg/m3气体甲醛的吸收效率,精胺效果好于亚精胺。因此,在1、3和5 mg/m3浓度的气体甲醛中精胺与亚精胺能提高烟草对气体甲醛的吸收效率,且精胺效果均好于亚精胺。由于低浓度的气体甲醛在短时间内不足以对烟草叶片其他生理指标产生显著的可检出影响,因此采用高浓度气体甲醛处理4 h的烟草叶片用于后续叶绿素含量、过氧化生理指标及抗氧化酶活性和还原糖含量的测定。

|
| 图 1 精胺和亚精胺预处理对烟草叶片吸收甲醛效率的影响 A:精胺与亚精胺预处理对烟草叶片吸收1 mg/m3的气体甲醛的影响;B:精胺与亚精胺预处理对烟草叶片吸收3 mg/m3的气体甲醛的影响;C:精胺与亚精胺预处理对烟草叶片吸收5 mg/m3的气体甲醛的影响。CK:未加入烟草叶片时溶液的甲醛挥发曲线 |
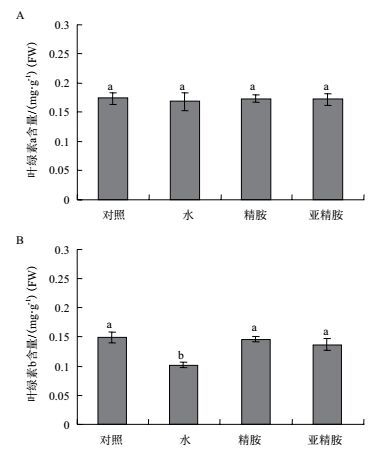
叶绿体是ROS产生的重要场所,过量的ROS会参与破坏叶绿素的Chl-4吡咯环,加速叶绿素的降解,由图 2-A和2-B可知,与未处理的对照相比,5 mg/m3的气体甲醛胁迫对烟草叶片中叶绿素a含量的影响并不显著,叶绿素b则对气体甲醛胁迫比较敏感,水预处理的烟草叶片在气体甲醛胁迫后叶绿素含量下降了31.7%,而精胺和亚精胺预处理后,烟草叶片中叶绿素b含量则维持与对照组相同的水平。
|
| 图 2 精胺与亚精胺预处理对气体甲醛胁迫处理后烟草叶片叶绿素a和叶绿素b含量的影响 A:叶绿素a含量;B:叶绿素b含量。柱形上方的小写字母表示差异显著(P < 0.05),下同 |
H2O2和MDA含量的变化可以表征ROS对植物的氧化损伤程度,由图 3-A可知,在没有多胺预处理时,气体甲醛胁迫使烟草叶片中H2O2含量显著升高为对照组的1.2倍,精胺和亚精胺预处理的烟草叶片中H2O2含量较对照组略微升高,但仍维持对照组的含量水平。由图 3-B可知,气体甲醛胁迫后水预处理的烟草叶片中MDA含量升高为对照组的1.4倍,精胺和亚精胺预处理的叶片中MDA虽然都升高为对照组的1.2倍,但叶片中MDA含量仍显著低于水预处理的烟草叶片。

|
| 图 3 精胺与亚精胺预处理对气体甲醛胁迫处理后烟草叶片MDA和H2O2含量的影响 A:H2O2含量,其中对照为新鲜烟草叶片;B:MDA含量 |
POD是植物抗氧化酶系统中以H2O2为底物的一个重要的抗氧化酶。由图 4-A可知,气体甲醛胁迫下POD活性显著降低了15%,精胺和亚精胺预处理过的烟草叶片中POD的活性并未显著降低,且精胺与亚精胺的作用效果相当。由此说明,在气体甲醛胁迫下,用精胺和亚精胺预处理烟草植株可以维持叶片的POD活性。

|
| 图 4 精胺与亚精胺预处理对气体甲醛胁迫处理后烟草叶片POD(A)、CAT(B)、SOD(C)、APX(D)活性的影响 |
CAT是存在于细胞过氧化物酶体内能催化H2O2分解为O2和H2O的酶,是植物保护酶系统中重要成员,其活性的高低可作为判断植物应答逆境胁迫的能力的依据。由图 4-B可知,在未受到气体甲醛胁迫的烟草叶片中,CAT活性较低,气体甲醛处理则使CAT活性显著升高为对照组的1.2倍,精胺和亚精胺的预处理虽然对CAT活性有一定促进作用,但效果不显著。这些结果说明气体甲醛胁迫可以诱导烟草叶片CAT的活性的增强,精胺和亚精胺预处理烟草植株可以进一步增强烟草叶片CAT活性,但效果并不显著。
SOD在消除细胞内过量的ROS时发挥着重要作用,它可催化超氧自由基发生歧化反应生成H2O2,是植物抵抗逆境的重要抗氧化酶之一。从图 4-C可知,与未处理的对照相比,气体甲醛胁迫显著降低了烟草叶片的SOD活性,其活性较对照组下降了18%。精胺预处理对SOD并无显著影响,而亚精胺预处理的烟草叶片中SOD活性是水预处理的1.2倍。这些结果说明气体甲醛胁迫可以使烟草叶片中SOD活性降低,而用亚精胺预处理过的烟草植株在受到气体甲醛胁迫时SOD的活性显著升高,但精胺预处理的效果不显著。
APX在植物细胞质、线粒体、过氧化物酶体和叶绿体中存在多种同工酶。从图 4-D可知,气体甲醛胁迫后烟草叶片APX活性变化不显著,精胺和亚精胺预处理过的烟草中叶片APX活性均提高到对照组的1.2倍,显著高于对照组和水预处理的烟草。这些结果说明气体甲醛胁迫在短时间内会显著影响烟草叶片中APX活性,精胺和亚精胺预处理可以增强气体甲醛胁迫下APX活性。
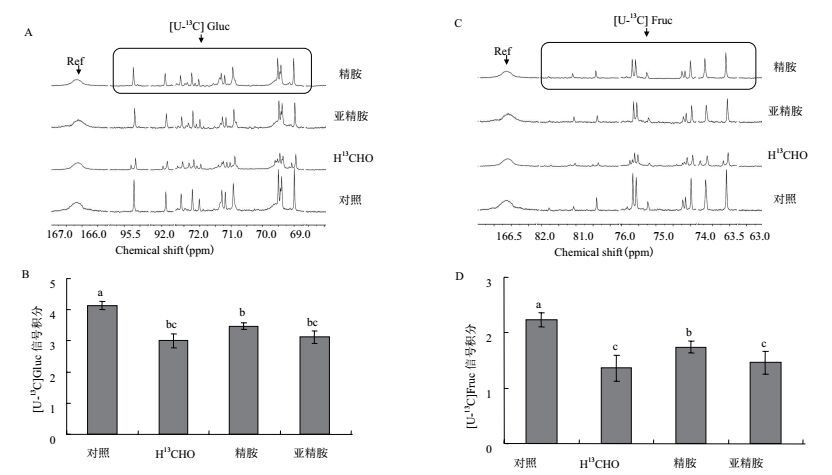
2.5 精胺和亚精胺预处理对甲醛胁迫下烟草叶片代谢产物的影响在烟草叶片的13C-NMR代谢谱中,并未发现有机酸组成和含量的显著变化,但两种还原糖的含量出现显著变化。由图 5可知,气体甲醛胁迫使叶片中游离的总葡萄糖(Glucose, Gluc)信号峰[U-13C]Gluc和总果糖(Fructose, Fruc)信号峰[U-13C]Fruc都显著低于对照组,其信号积分分别较各自对照组下降了27%和39%,这说明短时间的高浓度气体甲醛胁迫可以使叶片中的还原糖大量消耗。与对照组相比,精胺预处理的实验组中[U-13C]Gluc和[U-13C]Fruc的信号积分分别较各自对照组下降了16%和22%,其中[U-13C]Gluc的信号积分略高于水预处理的实验组,[U-13C]Fruc的信号积分则显著高于水预处理的实验组,亚精胺预处理未对烟草叶片中还原糖的消耗起到缓解作用,[U-13C]Gluc和[U-13C]Fruc的相对积分均与对照组处于同一水平。
|
| 图 5 精胺与亚精胺预处理对气体甲醛胁迫处理后烟草叶片还原糖含量的影响 A:总葡萄糖13C-NMR图谱;B:总葡萄糖的信号积分;C:总果糖13C-NMR图谱;D:总果糖的信号积分 |
叶绿体对逆境胁迫十分敏感,叶绿素含量能反应植物在逆境胁迫下的生命活力。在叶绿体的类囊体膜和捕光复合物中都含有不同比例的精胺和亚精胺[25],有研究显示甲醛胁迫下拟南芥叶片叶绿素会大量损失,出现黄化和褪色现象,甲醛吸收效率也因此严重降低[26]。本研究结果表明,叶绿素a在高浓度气体甲醛中处理4 h后含量出现显著变化,而精胺和亚精胺预处理可以将气体甲醛胁迫下叶片中叶绿素b的含量维持在对照组水平,这说明精胺和亚精胺的预处理对气体甲醛胁迫下烟草叶片的叶绿素有一定保护作用,这种保护作用主要是通过减缓叶绿素b的降解来实现。
植物自身的有氧代谢过程会产生ROS,极低浓度的ROS作为信号传导分子起作用[27]。当受到逆境胁迫时,ROS的过量积累会对植物产生毒害作用,使植物细胞中H2O2和MDA含量升高,其中H2O2在植物叶片保卫细胞中积累会引起保卫细胞关闭,植物叶片对甲醛的吸收效率也因此下降[28]。此时植物的抗氧化酶系统的协同作用对于ROS的清除发挥着主要作用。通过多胺的外源施加提高植物抗氧化酶活性来抵抗逆境胁迫的研究早有报道,这种促进作用是通过与抗氧化酶结合或者促进抗氧化酶合成来实现的[29]。在本研究中,4种主要的抗氧化酶POD、CAT、SOD和APX的活性都受到了气体甲醛胁迫的影响,POD和SOD的活性在气体甲醛胁迫后出现下降,CAT和APX的活性则不同程度升高。精胺预处理对POD、CAT和APX活性的提高促进效果较好,亚精胺预处理则对4种主要抗氧化酶活性的提高都有促进作用,这与Kamiab等[30]通过外源施加精胺和亚精胺提高无花果幼苗的抗氧化酶活性缓解盐胁迫的研究结果一致。本研究的结果同样表明,在气体甲醛胁迫前采用一定浓度的精胺(100 μmol/L)和亚精胺(200 μmol/L)预处理烟草植株对烟草叶片细胞中H2O2和MDA的积累有显著的抑制作用。这与Velikova等[31]外源施加精胺和亚精胺缓解了菜豆叶片中H2O2和MDA含量积累的结果一致,这些结果表明精胺和亚精胺可以通过调控抗氧化酶的活性来缓解烟草叶片的氧化损伤,以减少H2O2和MDA的积累,这可能是精胺和亚精胺的预处理增强了烟草对气体甲醛胁迫抗性同时促进其甲醛吸收的一种机制。
应用精胺和亚精胺预处理烟草植株根部后,气体甲醛胁迫下的烟草叶片13C-NMR代谢谱中并未出现有机酸组成和含量的显著变化,说明精胺与亚精胺预处理对烟草代谢气体甲醛无显著促进作用。此外,在气体甲醛胁迫下,精胺预处理可以缓解烟草叶片中还原糖的消耗,减轻烟草叶片的损伤,但亚精胺无此效果。
4 结论在气体甲醛胁迫下,精胺和亚精胺预处理可以提高烟草叶片细胞中抗氧化酶系统的活力以清除甲醛胁迫产生的ROS,延缓叶片细胞内过氧化生理指标MDA和H2O2积累的同时缓解了叶绿素b的降解,因此避免叶片保卫细胞的大量关闭,使烟草对气体甲醛保持了一定的吸收效率。
| [1] | László I, Szoke é, Tyihák E. Relationship between abiotic stress and formaldehyde concentration in tissue culture of Datura innoxia Mill[J]. Plant Growth Regulation, 1998, 25 (3): 195–199. DOI:10.1023/A:1006095200260 |
| [2] | Tyihák E, Blunden G, Yang MH, et al. Formaldehyde, as its dimedone adduct, from Ascophyllum nodosum[J]. Journal of Applied Phycology, 1996, 8 (3): 211–215. DOI:10.1007/BF02184974 |
| [3] | 安雪, 李霞, 潘会堂, 等. 16种室内观赏植物对甲醛净化效果及生理生化变化[J]. 生态环境学报, 2010, 19(2): 379–384. |
| [4] | Sun H, Zhang W, Tang L, et al. Investigation of the role of the calvin cycle and C1 metabolism during HCHO metabolism in gaseous HCHO-treated petunia under light and dark conditions using13C-NMR:formaldehyde metabolism in petunia hybrida[J]. Phytochemical Analysis, 2015, 26 (3): 226–235. DOI:10.1002/pca.v26.3 |
| [5] | Shirazi AM, Muir PS. In vitro effects of formaldehyde on Douglas fir pollen[J]. Plant Cell & Environment, 1998, 21 (21): 341–346. |
| [6] | Saito Y, Nishio K, Yoshida Y, et al. Cytotoxic effect of formaldehyde with free radicals via increment of cellular reactive oxygen species[J]. Toxicology, 2005, 210 (2-3): 235–245. DOI:10.1016/j.tox.2005.02.006 |
| [7] | 李惠民, 张莹, 贺军民. UV-B对拟南芥叶片不同来源H2O2的活化和气孔关闭的诱导[J]. 西北植物学报, 2013, 33(5): 911–921. |
| [8] | Groppa MD, Benavides MP. Polyamines and abiotic stress:recent advances[J]. Amino Acids, 2008, 34 (1): 35–45. DOI:10.1007/s00726-007-0501-8 |
| [9] | Galston AW, Sawhney RK. Polyamines in plant physiology[J]. Plant Physiology, 1990, 94 (2): 406–410. DOI:10.1104/pp.94.2.406 |
| [10] | Pottosin I, Shabala S. Polyamines control of cation transport across plant membranes:implications for ion homeostasis and abiotic stress signaling[J]. Frontiers in Plant Science, 2014, 5 (3): 1–16. |
| [11] | Yi TH, Kao CH. Cadmium-induced oxidative damage in rice leaves is reduced by polyamines[J]. Plant & Soil, 2007, 291 (1): 27–37. |
| [12] | 刘强, 王庆成, 徐静, 等. 外源亚精胺和精胺对NaHCO3胁迫下南蛇藤抗氧化系统的影响[J]. 应用生态学报, 2009, 20(3): 549–554. |
| [13] | Capell T, Phillips RL. Modulation of the polyamine biosynthetic pathway in transgenic rice confers tolerance to drought stress[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101 (26): 9909–9914. DOI:10.1073/pnas.0306974101 |
| [14] | Wen XP, Ban Y, Inoue H, et al. Aluminum tolerance in a spermidine synthase-overexpressing transgenic European pear is correlated with the enhanced level of spermidine via alleviating oxidative status[J]. Environmental & Experimental Botany, 2009, 66 (3): 471–478. |
| [15] | Nian HJ, Meng QC, Cheng Q, et al. The effects of overexpression of formaldehyde dehydrogenase gene from Brevibacillus brevis on the physiological characteristics of tobacco under formaldehyde stress[J]. Russian Journal of Plant Physiology, 2013, 60 (6): 764–769. DOI:10.1134/S1021443713060083 |
| [16] | Nian HJ, Meng Q, Zhang W, et al. Overexpression of the formaldehyde dehydrogenase gene from Brevibacillus brevis to enhance formaldehyde tolerance and detoxification of tobacco[J]. Applied Biochemistry & Biotechnology, 2013, 169 (1): 170–180. |
| [17] | Zhou S, Xiao S, Xuan X, et al. Simultaneous functions of the installed DAS/DAK formaldehyde-assimilation pathway and the original formaldehyde metabolic pathways enhance the ability of transgenic geranium to purify gaseous formaldehyde polluted environment[J]. Plant Physiology & Biochemistry, 2015, 89 : 53–63. |
| [18] | 舒展, 张晓素, 陈娟, 等. 叶绿素含量测定的简化[J]. 植物生理学报, 2010, 46(4): 399–402. |
| [19] | Schmedes A, H?lmer G. A new thiobarbituric acid(TBA)method for determining free malondialdehyde(MDA)and hydroperoxides selectively as a measure of lipid peroxidation. J Am Oil Chem Soc[J]. Journal of Oil & Fat Industries, 1989, 66 (6): 813–817. |
| [20] | Gay CA, Gebicki JM. Measurement of protein and lipid hydroperoxides in biological systems by the ferric-xylenol orange method[J]. Analytical Biochemistry, 2003, 315 (1): 29–35. DOI:10.1016/S0003-2697(02)00606-1 |
| [21] | Nakano Y, Asada K. Hydrogen pceroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant & Cell Physiology, 1981, 22 (5): 867–880. |
| [22] | 程鹏, 徐鹏飞, 范素杰, 等. 野生大豆接种大豆疫霉根腐病菌后过氧化物酶(POD)活性变化[J]. 大豆科学, 2013, 32(2): 197–201. |
| [23] | 王群, 刘朝巍, 徐文娟. 紫外分光光度法测定玉米过氧化氢酶活性新进展[J]. 中国农学通报, 2016, 32(15): 159–165. |
| [24] | Vuleta A, Jovanovi? SM, Tuci? B. Adaptive flexibility of enzymatic antioxidants SOD, APX and CAT to high light stress:The clonal perennial monocot Iris pumila as a study case[J]. Plant Physiology & Biochemistry, 2016, 100 : 166–173. |
| [25] | Kotzabasis K, Fotinou C, Roubelakis-Angelakis KA, et al. Polyamines in the photosynthetic apparatus[J]. Photosynthesis Research, 1993, 38 (1): 83–88. DOI:10.1007/BF00015064 |
| [26] | Wang SS, Song ZB, Sun Z, et al. Effects of formaldehyde stress on physiological characteristics and gene expression associated with photosynthesis in Arabidopsis thaliana[J]. Plant Molecular Biology Reporter, 2012, 30 (6): 1291–1302. DOI:10.1007/s11105-012-0440-8 |
| [27] | Ray PD, Bo-Wen H, Yoshiaki T. Reactive oxygen species(ROS)homeostasis and redox regulation in cellular signaling[J]. Cellular Signalling, 2012, 24 (5): 981–990. DOI:10.1016/j.cellsig.2012.01.008 |
| [28] | 孙慧群, 周升恩, 吴怀胜, 等. 气体甲醛胁迫对蚕豆保卫细胞中过氧化氢的积累和气孔导度及开度的影响[J]. 植物生理学报, 2015, 51(2): 246–252. |
| [29] | 徐仰仓, 王静, 刘华, 等. 外源精胺对小麦幼苗抗氧化酶活性的促进作用[J]. 植物生理学报, 2001, 27(4): 349–352. |
| [30] | Kamiab F, Talaie A, Khezri M, et al. Exogenous application of free polyamines enhance salt tolerance of pistachio(Pistacia vera L.)seedlings[J]. Plant Growth Regulation, 2014, 72 (3): 257–268. DOI:10.1007/s10725-013-9857-9 |
| [31] | Velikova V, Yordanov I, Edreva A. Oxidative stress and some antioxidant systems in acid rain-treated bean plants:Protective role of exogenous polyamines[J]. Plant Science, 2000, 151 (1): 59–66. DOI:10.1016/S0168-9452(99)00197-1 |




