番茄,是茄科番茄属一年生或多年生草本植物,用途非常广泛,可食用,可烹饪,还能加工番茄酱、汁等,因而在我国南北方广泛栽培。由于目前番茄大多采用温室设施种植,而温室内的小气候环境一般湿度较高,且冬春季节平均温度也高于室外,很容易滋生病害,其中灰葡萄孢菌(Botrytis cinerea)引发的灰霉病就是一种较为常见的病害。灰葡萄孢菌是半知菌亚门丝孢纲丝孢目淡色菌科葡萄孢属弱寄生病原菌,其寄主范围相当广泛,能够侵染近200多种植物,尤其在冬春季节的温室大棚中,特别容易感染瓜类、浆果类和茄果类等果蔬作物,成为限制其品质和产量提高的重要因素[1]。
番茄的叶片、茎和果实都会受到灰葡萄孢菌的侵染,一旦感染叶片和茎部会出现水渍状病斑,感染的前期茎叶组织会软化,后期则腐烂,果实被感染后会在表面形成灰色霉层,慢慢变软腐烂,极大影响了番茄产量,严重时减产可达20%-30%以上。番茄灰霉病是番茄生产和储藏中的主要病害之一,目前主要依靠化学杀菌剂来防治番茄灰霉病。但长期使用化学杀菌剂容易造成病原菌的抗药性及食品安全问题,因而微生物防治是重要的研究方向[2]。
目前报道过的灰霉病生防菌包括芽孢杆菌(Bacillus)[3-4]、假单胞菌(Pseudomonas)[5]、木霉菌(Trichoderma)[6]、链霉菌(Streptomyces)[7]和酵母菌(Yeast)[8]等,其生防机制包括竞争作用、拮抗作用、重寄生作用、溶菌作用、诱导抗性及促进植物生长等方面[9]。随着生防菌的不断使用,生物防治已成为控制番茄灰霉病的一条重要而有效的途径,具有良好的应用前景[10]。
本研究针对当地温室常见的灰霉病,从发病的番茄果实中分离病原菌灰葡萄孢菌,并分离筛选出对其有抑制作用的菌株,旨为番茄灰霉病的防治奠定一定的理论基础。
1 材料与方法 1.1 材料番茄灰霉病病样采自榆次东阳镇实验基地大棚,番茄品种为“齐达利”。
培养基:PDA琼脂培养基:马铃薯200 g,葡萄糖20 g,琼脂15-20 g,自来水1 000 mL,自然pH;PDB液体培养基:不加琼脂,其它成分同PDA培养基。
1.2 方法 1.2.1 病原菌分离和纯化菌株的分离纯化参照常规方法[11-12]。将带有明显的灰霉病病症的番茄果实表面用10%的次氯酸钠溶液浸泡3 min后,用无菌水冲洗3次,切取病健交界处组织块若干,分别接种到PDA培养基上培养。22℃培养1-2 d后,挑选与灰葡萄孢菌形态相似的单菌落,接到新的培养基上培养,直到菌落表现均匀一致为止。将纯化后的菌株标记为“BC2016-2”且接种到PDA斜面培养基上,22℃下培养3 d后放到4℃冰箱保藏以备长期使用。为了保证病原菌存活,维持其致病力,每90 d在PDA培养基上继代1次。
1.2.2 形态学鉴定将菌种接种于PDA培养基上,22℃倒置培养。参照魏景超[11]对培养特征、形态特征进行观察并记录,以确定该菌株的种属地位。
1.2.3 分子生物学鉴定将纯化后的单克隆菌落送至上海生工进行测序,测序结果在NCBI数据库中进行BLAST比对,用Mega 6.0软件分析序列,构建系统进化树。
1.2.4 病原菌的拮抗菌株筛选采用平板对峙法。用打孔器取活化的病原菌菌饼(直径为6 mm)置于PDA平板中央,22℃培养24 h;用灭菌的牙签挑取纯化好的菌种点接在距平皿中心3 cm处的4个角点上,30℃培养3-5 d。每处理设3个重复,以只接种病原菌的平板作对照,观察病原菌的生长状态,选出对病原菌生长有抑制作用,且被抑病原菌丝边缘平齐、拮抗作用持久的菌株,测量病原菌菌落直径,计算菌株的抑制率。

拮抗菌株的形态特征分析参照《常见细菌系统鉴定手册》[13]。
1.2.5.2 16S rDNA序列分析将纯化后的单克隆菌株送至上海生工测序,测序后获得的16S rDNA序列在NCBI网站用BLAST进行序列比对分析并构建系统发育树。
1.2.6 拮抗菌防治效果测定取一定量的番茄种子,播种到装有1 000 g灭菌土的营养钵中。待番茄苗长到5叶期时进行接种实验,将大小一致、生长状态良好的番茄苗分为4个处理组,3个实验组和1个对照组,每组番茄苗15株,重复3次。实验中所用灰葡萄孢菌的孢子悬浮液浓度为1×106个/mL,拮抗菌的发酵液浓度为1×108个/mL。实验组1:喷雾接种拮抗菌CM3,24 h后接种病原菌;实验组2:喷雾接种拮抗菌Y-30,24 h后接种病原菌;实验组3:喷雾接种拮抗菌Y-48,24 h后接种病原菌;对照组:无菌水喷雾,24 h后接种病原菌。接种后保持温度(20±1)℃,相对空气湿度90%以上,10 d后进行病害调查,隔10 d再调查1次。此期间对番茄进行正常的栽培管理。
病害分级标准:0级:无病;1级:1/5以下叶片发病;2级:1/5-2/5叶片发病;3级:2/5-3/5叶片发病;4级:3/5-4/5叶片发病;5级:4/5以上叶片发病。
病情指数=[∑(病害的级别×该级别的植株数)/(病害的最高级别×总株数)]×100
防治效果(%)=(1-处理病情指数/对照病情指数)×100%
2 结果 2.1 病原菌的分离、纯化和鉴定 2.1.1 病原菌的菌落特征从感染灰霉病的番茄果实表面,分离纯化出1株病原菌,命名为BC2016-2。此菌株在PDA培养基上可以正常生长,生长温度为22℃。菌丝生长初期为灰白色,贴着培养基生长,生长速度较快,4 d左右可长满培养皿,菌丝颜色慢慢加深,变成灰褐色,气生菌丝很茂盛、质地较为疏松,但长度较短。菌丝产生孢子后菌落表面成粉状,可以观察到气生菌丝顶端有灰褐色的孢子产生,在产孢后期会在培养基上出现黑色不规则状的菌核,大小不一,在(2-4)mm×(1-3)mm之间。菌落不产生色素,菌落背面不变色,但会产生发霉的气味。
显微镜下观察,病原菌分生孢子梗为灰褐色,有隔膜,顶端膨大,其上着生大量分生孢子,形似葡萄穗状,分生孢子为单孢,近圆形或椭圆形,无色或淡色(图 1)。

|
| 图 1 灰葡萄孢菌的菌落形态以及孢子显微镜图片 A:灰葡萄孢菌(生长4 d);B:灰葡萄孢菌(生长10 d);C:分生孢子梗;D:单个的分生孢子 |
病原菌BC2016-2的ITS序列在NCBI上进行比对分析,与基因库中已知的灰葡萄孢菌ITS序列高度同源,相似性为99%(图 2)。

|
| 图 2 根据病原菌BC2016-2的ITS序列同源性构建的系统发育树 |
从实验室保存的109株芽孢杆菌,经过初筛和复筛,挑选出了3株拮抗菌,编号为CM3、Y-30和Y-48(图 3)。其中CM3是一株解淀粉芽孢杆菌(Bacillus amyloliquefacien),已经报道过其对草莓灰霉病有较强的抑制作用,其发酵上清液性质稳定,适合开发成微生物制剂[3];Y-30和Y-48是新筛选到的两株抑制灰霉病菌效果明显的菌株。表 1显示的是3种菌株在平板对峙实验中的结果,可以看到菌株Y-48的抑菌率最高,达到75.41%。

|
| 图 3 拮抗菌对灰葡萄孢菌的抑制结果 A:菌株Y-48,B:菌株CM3,C:菌株Y-30 |
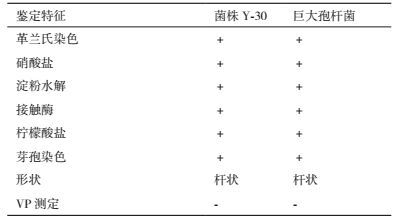
通过形态特征观察发现菌株Y-30在PDA培养基上乳白色不透明菌落,菌落表面粗糙,边缘呈锯齿状。由生理生化实验结果(表 2)可知,菌株Y-30与《常见细菌系统鉴定手册》[13]描述的巨大芽孢杆菌(Bacillus megaterium)的生理生化特征基本相同,初步鉴定为巨大芽孢杆菌。
菌株Y-30的16S rDNA片段测序结果表明,该片段全长为1 345 bp。将测定的序列在NCBI数据库中进行BLAST同源性比较,通过比对发现菌株Y-30与Bacillus megaterium 的同源性为99%,系统发育树见图 4。结合形态学和生理生化特征指标,确定菌株Y-30为巨大芽孢杆菌。

|
| 图 4 根据拮抗菌Y-30的16S rDNA序列同源性构建的系统发育树 |
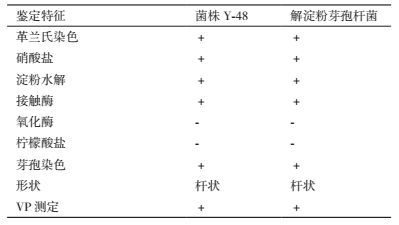
形态特征观察发现菌株Y-48在PDA培养基上呈白色不透明菌落,菌落表面会形成褶皱突起,菌落边缘较规则。生理生化实验(表 3)可知,Y-48与《常见细菌系统鉴定手册》[13]描述的解淀粉芽孢杆菌(Bacillus amyloliquefacien)的生理生化特征基本相同,初步鉴定为解淀粉芽孢杆菌。
菌株Y-48的16S rDNA片段测序结果表明,该片段全长为1 364 bp。将测定的序列在NCBI数据库中进行BLAST同源性比较,比对结果显示菌株Y-48与Bacillus amyloliquefacien的同源性均为99%,系统发育树见图 5。结合形态学和生理生化特征指标,确定菌株Y-48为解淀粉芽孢杆菌。

|
| 图 5 根据拮抗菌Y-48的16S rDNA序列同源性构建的系统发育树 |
盆栽实验结果显示(表 4),分离到的灰葡萄孢菌BC2016-2能够引起番茄植株的灰霉病,病情指数比较严重,达到81.33。筛选到的3株拮抗菌都能够抑制灰霉病的发生,其中解淀粉芽孢杆菌Y-48(处理组3)的预防效果最好,达到72.13%;CM3(处理组1)的预防效果次之,为65.58%,巨大芽孢杆菌Y-30(处理组2)的预防效果较低,为54.1%。
分离鉴定病原菌是植物病害研究的基础性工作,使用分子技术对病原菌进行鉴定已经成为一种常用、快速、灵敏且准确可靠的手段。本研究根据ITS序列分析的结果,再结合病原菌的形态特征,将分离到的菌株BC2016-2确定为灰葡萄孢菌,结果更加真实可靠。王瑞虎等[14]结合形态特征和分子生物学方法,鉴定从番茄果实上分离的菌株t08016b为灰葡萄孢菌,同时发现燕麦培养基上灰葡萄孢菌的产孢量较高,所以判断燕麦中可能存在促进灰葡萄孢产生孢子的因子。李诚等[15]通过病原菌形态特征、致病性测定及rDNA-ITS的同源性分析,确定江西奉新猕猴桃灰霉病的病原菌为灰葡萄孢菌。
本研究中以菌株BC2016-2为指示菌,筛选到了3株抑制作用明显的菌株,分别为CM3、Y-30和Y-48。其中,菌株CM3是本实验室在草莓根际分离出的一株对草莓灰霉病菌有抑制作用的解淀粉芽孢杆菌[3],菌株CM3发酵产生的抑菌成分有稳定的性能及较强的环境适应性,未来可以开发成微生物制剂,用来进行草莓灰霉病的生物防治。菌株Y-30和Y-48都是实验室保藏的菌株,通过生理生化实验和16S rDNA序列检测,将菌株Y-30确定为巨大芽孢杆菌,菌株Y-48确定为解淀粉芽孢杆菌。盆栽实验表明:3株拮抗菌对分离到的灰葡萄孢菌均有良好的防治效果,菌株Y-48的效果最好,菌株CM3和Y-30的效果次之。
在目前的生物防治研究中,枯草芽孢杆菌和解淀粉芽孢杆菌已经是较为常用的生防菌,而巨大芽孢杆菌的研究则相对较少。时健[16]在番茄根际土壤中筛选到了168株具有拮抗作用的拮抗菌,其中芽胞杆菌属为优势菌属,共有126株。王晓辉等[17]从大黑山林间土壤中筛选出了一株生防菌K1,通过形态学和16S rDNA序列鉴定为解淀粉芽孢杆菌,菌株K1可以抑制灰葡萄孢菌的菌丝生长、孢子萌发等代谢过程。向亚萍等[18]发现解淀粉芽孢杆菌B1619菌株分泌的脂肽类抗生素对番茄枯萎病菌生长有强烈的抑制作用。徐大勇等[19]从番茄植株内部分离筛选到菌株XF136,经形态特征、生理生化特性和16S rDNA序列分析鉴定为解淀粉芽孢杆菌,其对灰葡萄孢菌有较强拮抗作用,浓度为20%的发酵滤液对番茄灰霉病的防治效果高于50%多菌灵600倍液。秦健[20]发现巨大芽孢杆菌B196可以对水稻稻瘟病菌等7种植物病原菌有较强的抑菌活性。
实验室分离出的生防菌株往往在生产实践中得不到预期的效果,这主要是因为实验室环境和外界土壤环境存在相当大的差异,外界环境的不确定性导致单一的微生物防治方法难以进行大规模推广[21-22]。因此,我们需要改良传统防治方法,将微生物防治方法与其他的防治方法进行有机结合[23],形成新颖的综合防治方法。例如,牛芳胜[24]发现哈茨木霉菌与啶酰菌胺联合使用后,对番茄灰霉病的抑制率为61.17%,而二者单独使用的抑制率分别为48.19%和0.97%。毛雪琴等[25]的田间小区试验结果表明菌株MT-06和2 mg/mL甲霜锰锌混配后,对小麦赤霉病的防治效果超过了5 mg/mL甲霜锰锌单独施用的效果。因此,将微生物菌剂和化学药剂或者植物精油[26]配合使用可以获得更强的抑菌结果,得到1+1>2的防治效果,这会是未来防治植物病害的研究以及发展方向。
4 结论本研究从番茄病果上分离到了1株病原菌,命名为BC2016-2,根据ITS序列分析的结果和菌株形态特征,将菌株BC2016-2鉴定为灰葡萄孢菌。以菌株BC2016-2为指示菌,筛选到了3株抑制作用明显的菌株,分别为CM3、Y-30和Y-48,其中菌株CM3和Y-48为解淀粉芽孢杆菌,菌株Y-30确定为巨大芽孢杆菌。盆栽实验结果显示,3株菌对灰葡萄孢菌BC2016-2引起的番茄灰霉病有良好的生物防治效果,防治效果分别为65.58%、54.1%和72.13%。
| [1] | 赵杨, 苗则彦, 李颖, 等. 番茄灰霉病防治研究进展[J]. 中国植保导刊, 2014, 34(7): 21–29. |
| [2] | 纪军建, 张小风, 王文桥, 等. 番茄灰霉病防治研究进展[J]. 中国农学通报, 2012, 28(31): 109–113. |
| [3] | 黄静, 赵佳, 陈哲, 等. 抗草莓灰霉病的芽孢杆菌CM3的分离与筛选[J]. 北方园艺, 2016(11): 113–116. |
| [4] | Kilani-Feki O, Khedher SB, Dammak M, et al. Improvement of antifungal metabolites production by Bacillus subtilis, V26 for biocontrol of tomato postharvest disease[J]. Biological Control, 2016, 95 (5): 73–82. |
| [5] | 张莹莹. 绿针假单胞菌HL5-4对番茄灰霉病的抑制活性及其初步研究[D]. 郑州: 河南农业大学, 2013. |
| [6] | 黄亚丽, 王淑霞, 杜晓哲, 等. 一株具有诱导抗性木霉菌株的筛选及其对黄瓜灰霉病诱导抗性的初步研究[J]. 植物保护, 2013, 39(1): 38–43. |
| [7] | 连清贵, 甘良, 马青, 等. 番茄灰霉病菌胁迫下壮观链霉菌SC11对寄主的促生作用及防病机理[J]. 植物病理学报, 2016, 46(3): 401–408. |
| [8] | 关鑫. 三株生防酵母菌对番茄灰霉病生物防治的比较研究[D]. 哈尔滨: 东北农业大学, 2014. |
| [9] | 陈哲, 黄静, 赵佳, 等. 解淀粉芽孢杆菌拮抗成分的研究进展[J]. 生物技术通报, 2015, 31(6): 37–41. |
| [10] | 张芳芳, 丁群英. 利用微生物和植物提取物防治番茄灰霉病研究进展[J]. 新疆农垦科技, 2016, 39(10): 24–27. |
| [11] | 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979. |
| [12] | 陆家云. 植物病原真菌学[M]. 北京: 中国农业出版社, 2001. |
| [13] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2002. |
| [14] | 王瑞虎, 关鑫, 陈秀玲, 等. 番茄灰霉病菌的鉴定及系统发育树分析[J]. 北方园艺, 2013(6): 127–131. |
| [15] | 李诚, 蒋军喜, 赵尚高, 等. 猕猴桃灰霉病病原菌鉴定及室内药剂筛选[J]. 植物保护, 2014, 40(3): 48–52. |
| [16] | 时健. 番茄根际灰霉病拮抗菌的筛选和遗传多样性研究[D]. 泰安: 山东农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10434-1014156753.htm |
| [17] | 王晓辉, 王贵鹏, 张庆芳, 等. 一株抗灰霉病解淀粉芽孢杆菌的筛选鉴定及抑菌蛋白的分离[J]. 东北农业科学, 2015, 40(1): 64–67. |
| [18] | 向亚萍, 周华飞, 刘永锋, 等. 解淀粉芽孢杆菌B1619脂肽类抗生素的分离鉴定及其对番茄枯萎病菌的抑制作用[J]. 中国农业科学, 2016, 49(15): 2935–2944. |
| [19] | 徐大勇, 李峰. 番茄灰霉病拮抗内生细菌的筛选、鉴定及其活性[J]. 生态学杂志, 2012, 31(4): 1461–1467. |
| [20] | 秦健. 巨大芽孢杆菌B196菌株产抗菌物质的发酵条件优化及分离鉴定研究[D]. 南宁: 广西大学, 2013. |
| [21] | Romanazzi G, Smilanick JL, Feliziani E, et al. Integrated management of postharvest gray mold on fruit crops[J]. Postharvest Biology & Technology, 2016, 113 : 69–76. |
| [22] | 洪海林, 李国庆, 刘青山, 等. 大棚番茄灰霉病的发生及防治技术[J]. 植物医生, 2016, 29(4). |
| [23] | 李旭, 李红霞, 杨晓强. 番茄灰霉病防治技术应用[J]. 吉林农业, 2016(11): 101–1. |
| [24] | 牛芳胜. 哈茨木霉菌与5种杀菌剂联合对番茄灰霉病菌的协同作用及增效机制研究[D]. 保定: 河北农业大学, 2013. http://www.cnki.com.cn/Article/CJFDTOTAL-NYXB201302007.htm |
| [25] | 毛雪琴, 彭志荣, 邱海萍, 等. 生防菌株MT-06发酵条件及复配杀菌剂对小麦赤霉病的防效[J]. 浙江农业科学, 2013, 1(7): 821–824. |
| [26] | Zamani-Zadeh M, Soleimanian-Zad S, Sheikh-Zeinoddin M, et al. Integration of Lactobacillus plantarum, A7 with thyme and cumin essential oils as a potential biocontrol tool for gray mold rot on strawberry fruit[J]. Postharvest Biology & Technology, 2014, 92 (3): 149–156. |