大豆皂苷(Soyasaponin)是大豆生长过程中的一类次生代谢产物[1]。具有许多对人体有益的生理功能[2-5],因此越来越受到人们的重视。大豆皂苷种类繁多、结构复杂,根据大豆皂苷苷元的不同目前把发现的54种大豆皂苷[6-8]分为7类:A类、B类、DDMP类、E类、H类、I类和J类皂苷[9-12]。
A类大豆皂苷是以大豆皂醇A为苷元,在其C-3和C-22位各结合一个糖基链,根据糖基链的不同A类皂苷又可分为Aa、Ab和Ao 3个系列[6, 9, 12, 13]。Aa和Ab系列C-22位上分别连有乙酰化木糖基和乙酰化葡萄糖基[14],Ao系列皂苷是不含乙酰化糖基的[15]。GmSg-1基因编码Aa和Ab皂苷合成的关键酶UGT73F4和UGT73F2(图 1)。A类皂苷C-22位末端糖基乙酰化会导致大豆及其制品味道苦涩[16],这严重影响其口感。因此,为了改善大豆制品的口感,降低和去除A类皂苷,逐渐成为目前研究的热点。

|
| 图 1 Aa和Ab皂苷合成途径 |
本研究采用高效液相色谱-电喷雾离子化串联质谱联用技术(High performance liquid chromatogr-aphy-electrospray ionization-tandern mass spectrometry,HPLC-ESI-MS/MS)测定68份大豆材料胚和子叶中Aa、Ab皂苷的含量以及籽粒发育过程中Aa、Ab皂苷的含量,利用qRT-PCR技术研究了籽粒发育过程中Aa、Ab皂苷合成的关键酶基因GmSg-1的表达量,并分析GmSg-1基因DNA序列的多态性。旨在了解大豆籽粒中大豆皂苷Aa和Ab的合成代谢机制,为降低大豆籽粒中A类皂苷含量以及改良大豆品质提供理论依据。
1 材料与方法 1.1 材料选取适宜山西种植的68份大豆材料作为实验材料,所有材料由山西农业大学大豆育种室提供。供试大豆材料于2015年种植于山西农业大学实验农场,按小区种植,3次重复。大豆种子成熟后自然晾干,分离胚和子叶,保存用于检测大豆皂苷。
开花期对晋豆52、晋遗30、千斤豆、武黑、中黄13、L-6开花时间相同且在同一部位的花进行挂牌标记,分别取开花后25、32、40、50、60和70 d的大豆荚,每荚取两粒大豆籽粒,其中一粒用于大豆皂苷的测定,低温冷冻干燥,-20℃保存备用。另一粒用于基因表达分析,并立即将籽粒于液氮中冷冻,于-80℃保存备用。每个时期取材均3次重复。
1.2 方法 1.2.1 Aa、Ab皂苷含量的测定参考岳爱琴等[17]测定大豆皂苷的方法,采用HPLC-ESI-MS/MS测定不同大豆材料胚和子叶中Aa、Ab皂苷的含量。
1.2.2 GmSg-1基因的获得和测序采用CTAB法提取材料基因组DNA,使用BioPhotometer D30核酸蛋白测定仪测定DNA的浓度和质量,将DNA稀释至20 ng/μL供后续实验使用。用Primer Premier 5软件,参照NCBI公布的GmSg-1序列(AB628091),设计引物F1/R1(F1:5'-ATGGGGTCTCTTGTCATCTTCA-3';R1:5'-TTTAGAGAACAAAAGAAGGCGTAGT-3')。以材料基因组DNA为模板,用PCR扩增目标片段。PCR体系总体积15 μL,其中DNA模板(20 ng/μL)2.1 μL、5×buffer 3.0 μL、正反引物各0.3 μL(10 μmol/L)、dNTP(2.5 μmol/L)0.4 μL、TransStart® Fast Pfu 0.3 μL和ddH2O 8.6 μL。PCR程序:95℃ 5 min;95℃ 1 min,57℃ 45 s,72℃ 1 min 48 s,35个循环;72℃ 10 min,15℃保存。用1.2%琼脂糖凝胶进行电泳,检测PCR产物,对单一目标条带进行割胶回收,送上海生工进行测序。
1.2.3 目标基因DNA序列单核苷酸多态性分析利用DNAStar软件分析GmSg-1序列的基因多态性位点。
1.2.4 qRT-PCR检测GmSg-1基因表达利用Trizol法[18]提取RNA,TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix(北京全式金)试剂盒转录cDNA。利用Primer Premier 5.0软件设计目标片段长度为100 bp左右的qRT-PCR引物F2/R2(F2:5'-TCCTGGGCGGATGACG-3';R2:5'-CGGA-ATGGAGTTCGGGG-3'),选择CYP2基因作为内参基因(引物F3:5'-CGGGACCAGTGTGCTTCTTCA-3';R3:5'-CCCCTCCACTACAAAGGCTCG-3')。反应总体积为10 μL,含SYBR Premix Ex Taq Ⅱ 5 μL,引物各1 μL(10 μmol /L),cDNA模板1 μL(100 ng/μL)和RNase Free water 3 μL。qRT-PCR程序为:95℃ 30 s;95℃ 5 s;58℃ 15 s,40次循环,每个循环采集一次信号;完成以上步骤后,65℃ 5 s;完成最后的荧光信号采集,3次重复。
2 结果 2.1 大豆皂苷组成多态性分析对山西68份大豆材料种子中的大豆皂苷组成进行多态性分析,分为Aa型、Ab型、AaAb型3种类型(图 2),所占比例分别为51.5%、44.1%和4.4%,说明本试验山西大豆材料大豆皂苷类型主要为Aa型和Ab型。其中35份大豆材料为Aa型,30份大豆材料为Ab型,3份大豆材料(晋大47、SNWS285、中黄42)为AaAb型(表 1)。

|
| 图 2 三种类型大豆的HPLC-ESI-MS/MS谱图 |
采用HPLC-ESI-MS/MS法分别测定了不同大豆材料胚和子叶中Aa、Ab皂苷的含量,结果(表 2)表明,不同大豆籽粒中Aa、Ab皂苷含量相差较大,Aa型大豆材料胚和子叶中Aa皂苷含量的变异范围分别为0.41-33.79 mg/g和0.21-8.39 mg/g,Ab型大豆材料胚和子叶中Ab皂苷含量的变异范围分别为0.85-44.96 mg/g和0.26-11.09 mg/g。胚中Aa或Ab皂苷含量均高于子叶。
采用HPLC-ESI-MS/MS法分别对3种Aa型(武黑、中黄13、L-6)、3种Ab型(晋豆52、晋遗30、千斤豆)大豆材料籽粒不同发育时期Aa和Ab皂苷含量进行测定。结果(图 3)表明,Aa型和Ab型大豆籽粒中Aa、Ab皂苷含量均在开花后40-50 d达到最大值,之后随着大豆的成熟,大豆皂苷含量降低,总体呈先增后减的变化趋势。

|
| 图 3 不同发育时期籽粒大豆皂苷含量分析 |
从NCBI得知,GmSg-1基因位于染色体7 -NC_016094.2,开放性阅读框为1383 bp,测序结果与cDNA进行比对结果表明该序列没有内含子。用GmSg-1基因特异性引物F1/R2对5种Aa型、5种Ab型大豆材料的GmSg-1基因进行扩增,电泳结果显示10个材料均在1 800 bp左右有单一条带(图 4)。对测序所得DNA序列进行比对,结果(表 3和图 5)表明GmSg-1a和GmSg-1b基因共有19个SNP位点差异,其中10个SNP位点引起氨基酸变异,其余9个SNP为同义突变。

|
| 图 4 GmSg-1基因PCR结果检测 M:DNA marker;CK:阴性对照;1:武黑;2:铁丰31;3:中黄13;4:汾豆56;5:L-6;6:晋豆52,;7:晋遗30;8:千斤豆;9:晋大70;10:晋科4号 |

|
| 图 5 Aa型、Ab型大豆GmSg-1基因序列比对 |
对晋遗30不同发育时期籽粒中GmSg-1基因的表达进行分析,结果(图 6)表明,GmSg-1和CYP2基因的溶解曲线峰值单一,引物的特异性好,所得实验数据可靠。GmSg-1基因相对表达量在开花后25、32、40、50、60 d呈现先增后减的趋势,开花后70 d时相对表达量变高(图 7)。开花后40 d GmSg-1基因相对表达量显著高于25 d和32 d,开花后50 d、60 d表达量显著降低。GmSg-1基因相对表达量变化趋势与籽粒皂苷含量变化趋势基本一致(图 3),最后一个时期GmSg-1基因相对表达量与皂苷含量变化趋势不一致,可能是其他基因调控所致,还有待进一步研究。
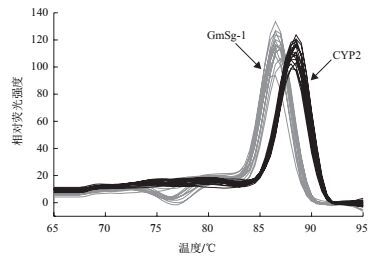
|
| 图 6 目标基因的溶解曲线 |

|
| 图 7 晋遗30不同发育时期表达量分析 差异显著用不同字母表示(P < 0.05) |
大豆皂苷是大豆发育过程中的一种重要次生代谢产物[1],具有许多对人体有益的生理功能[2-5]。目前发现大豆皂苷由54种皂苷组成[8],其中A类皂苷中Aa、Ab皂苷C-22位末端糖基乙酰化是导致大豆及其制品味道苦涩的主要原因[6, 14]。A类皂苷缺失的大豆材料其大豆制品口感较好[13]。前人研究表明大豆皂苷在不同大豆种质材料中具有丰富的遗传变异[19]。因此,对大豆种质资源的皂苷组成和含量进行研究,不断筛选出皂苷组成和含量特异材料,不仅可以用于大豆皂苷的代谢机制研究,还可以用于大豆皂苷品质的遗传改良。本研究利用HPLC-ESI-MS/MS对具有代表性的68份山西大豆材料种子中大豆皂苷组成进行多态性分析,发现供试材料分为Aa、Ab、AaAb 3种类型,并且主要为Aa和Ab型。Takahashi等[20]对我国3 731份野生大豆资源大豆皂苷类型进行鉴定,结果也表明Aa型和Ab型为主要类型,同时他们发现了一份Aa和Ab皂苷均缺失的Ao类型野生大豆材料。本研究供试材料中未发现Ao类型,但研究发现Aa和Ab皂苷含量存在较大的变异范围,Aa和Ab皂苷含量低的大豆材料可用于今后改良大豆皂苷品质的改良。
通过研究不同品种大豆籽粒中Aa、Ab皂苷含量以及大豆籽粒成熟过程中皂苷Aa、Ab的积累和GmSg-1基因的表达量发现,参试大豆材料籽粒胚和子叶中Aa、Ab皂苷变异范围大,说明我国拥有的大豆资源Aa、Ab皂苷变异丰富,对今后研究大豆皂苷品质育种工作具有重要意义。
本研究对晋遗30大豆籽粒不同发育时期的GmSg-1基因相对表达量进行研究,结果表明GmSg-1基因表达量呈现先增后减的趋势,与其Ab含量的变化趋势基本一致。但GmSg-1基因在大豆开花后70 d籽粒中表达量达到最大,这可能说明是GmSg-1基因是大豆皂苷Aa、Ab合成的关键酶基因,但是大豆皂苷Aa、Ab合成过程中是否还有其他基因调控,仍有待于进一步研究。
4 结论本研究发现,68个品种大豆中Aa型大豆胚和子叶中Aa皂苷的变异范围分别是0.41-33.79 mg/g,0.21-8.39 mg/g;Ab型大豆胚和子叶中Ab皂苷的变异范围分别是0.85-44.96 mg/g,0.26-11.09 mg/g。大豆不同发育时期籽粒Aa、Ab皂苷含量呈现先增后减的趋势,在开花后40-50 d皂苷含量达到最大值。测序发现Aa、Ab型大豆材料GmSg-1基因共有19个SNP多态性位点,其中10个SNP引起氨基酸变异。对不同发育时期表达量进行分析,发现变化趋势呈先增后减,与皂苷含量变化趋势基本一致。
| [1] | Palukaitis P, Roossinck MJ, Dietzgen RG, et al. Cucumber mosaic virus[J]. Advances in Virus Research, 1992, 41 (1): 281–348. |
| [2] | Guiu-Aragone's C, Monforte AJ, Saladie M, et al. The complex resistance to cucumber mosaic cucumovirus(CMV)in the melon accession PI161375 is governed by one gene and at least two quantitative trait loci[J]. Molecular Breeding, 2014, 34 (2): 351–362. DOI:10.1007/s11032-014-0038-y |
| [3] | Ding SW, Anderson BJ, Haase HR, et al. New overlapping gene encoded by the cucumber mosaic virus genome[J]. Journal of Virology, 1994, 198 (2): 593–601. DOI:10.1006/viro.1994.1071 |
| [4] | Brigneti G, Voinnet O, Li WX, et al. Viral pathogenicity determinants are suppressors of transgene silencing in Nicotiana benthamiana[J]. Europe Molecular Biology Organization Journal, 1998, 17 (22): 6739–6746. DOI:10.1093/emboj/17.22.6739 |
| [5] | Hayes RJ, Buck KW. Complete replication of a eukaryotic virus RNA in vitro by a purified RNA-dependent RNA polymerase[J]. Cell, 1990, 63 (2): 363–368. DOI:10.1016/0092-8674(90)90169-F |
| [6] | Ding SW, Li WX, Symons RH. A novel naturally occurring hybrid gene encoded by a plant RNA virus facilitates long distance virus movement[J]. Europe Molecular Biology Organization Journal, 1995, 14 (23): 5762–5772. |
| [7] | Ding B, Li QB, Nguyen L, et al. Cucumber mosaic virus 3a protein potentiates cell-to-cell trafficking of CMV RNA in tobacco plants[J]. Virology, 1995, 207 (2): 345–353. DOI:10.1006/viro.1995.1093 |
| [8] | Li QB, Ryu KH, Palukaitis P. Cucumber mosaic virus-plant interactions:identification of 3a protein sequences affecting infectivity, cell-to-cell movement, and long-distance movement[J]. Molecular Plant-Microbe Interactions, 2001, 14 (3): 378–385. DOI:10.1094/MPMI.2001.14.3.378 |
| [9] | Perry KL, Zhang L, Shintaku MH, et al. Mapping determinants in cucumber mosaic virus for transmission by Aphis gossypii[J]. Virology, 1994, 205 (2): 591–595. DOI:10.1006/viro.1994.1686 |
| [10] | Kaplan IB, Zhang L, Palukaitis P. Characterization of cucumber mosaic virus[J]. Virology, 1998, 246 (2): 221–231. DOI:10.1006/viro.1998.9192 |
| [11] | Roossinck MJ. Evolutionary history of cucumber mosaic virus, deduced by phylogenetic analyses[J]. Journal of Virology, 2002, 76 (7): 3382–3387. DOI:10.1128/JVI.76.7.3382-3387.2002 |
| [12] | Shahideh N, Falk BW, Groves RL. A new satellite RNA is associated with natural infections of cucumber mosaic virus in succulent snap bean[J]. Archives of Virology, 2012, 157 (2): 375–377. DOI:10.1007/s00705-011-1154-1 |
| [13] | 向本春, 谢浩, 崔星明, 等. 新疆辣椒轻微斑驳病毒的分离鉴定[J]. 病毒学报, 1994, 10(3): 240–245. |
| [14] | 席德慧, 林宏辉, 向本春. 黄瓜花叶病毒2个分离物的亚组鉴定及株系分化研究[J]. 植物病理学报, 2006, 36(3): 232–237. |
| [15] | 程朝玲, 向本春, 崔百明, 等. 新疆石河子、伊宁地区黄瓜花叶病毒株系分化[J]. 植物保护学报, 2013, 40(2): 115–120. |
| [16] | 高瑞, 刘金亮, 兰玉菲, 等. 黄瓜花叶病毒外壳蛋白基因的克隆、原核表达及抗血清制备[J]. 植物保护学报, 2007, 34(3): 335–336. |
| [17] | 秦云霞, 曾华金, 刘志昕, 等. 黄瓜花叶病毒CP基因原核表达及抗血清的制备[J]. 中国生物工程杂志, 2004, 24(8): 73–76. |
| [18] | 程朝玲, 梁学超, 向本春, 等. 新疆石河子南瓜和加工番茄CMV卫星RNA与RNA3序列分析[J]. 西北农业学报, 2013, 22(5): 83–90. |
| [19] | 郑轩, 成巨龙, 赵震, 等. 五种烟草病毒TMV、CMV、TEV、PVY及TVBMV的多重RT-PCR同步检测[J]. 植物病理学报, 2011, 41(2): 146–153. |
| [20] | 都业娟, 石宝萍, 李成亮, 等. 加工番茄病毒病田间发生情况及毒原的分子检测[J]. 植物保护, 2013, 39(4): 110–115. |
| [21] | García-Arenal F, Escriu F, Aranda MA, et al. Molecular epidemiology of Cucumber mosaic virus and its satellite RNA[J]. Virus Research, 2000, 71 (1): 1–8. |
| [22] | Palukaitis P, Garcia-Arenal F. Cucumoviruses[J]. Advances in Virus Research, 2003, 62 : 241–323. DOI:10.1016/S0065-3527(03)62005-1 |
| [23] | 葛菊芬, 颜彤, 欧阳炜, 等. 新疆辣椒产业现状及发展对策建议[J]. 辣椒杂志, 2010(2): 8–10. |
| [24] | 许文博, 都业娟, 黄家风. 加工番茄CMV与ToMV的ELISA检测及其相关性分析[J]. 石河子大学学报:自然科学版, 2009(27): 199–201. |
| [25] | 乔亚红, 田桂英, 郑银英, 等. 抗CMV和ToMV RNAi载体的构建及加工番茄遗传转化[J]. 西北农林科技大学学报:自然科学版, 2014(24): 102–110. |






