2. 中国农业科学院生物技术研究所,北京 100081
2. Institute of Biotechnology, Chinese Academy of Agricultural Sciences, Beijing 100081
启动子是基因的重要组成部分,它就像“开关”,调节着下游基因的活性。启动子是指位于结构基因5'端上游的一段DNA序列,它与RNA聚合酶作用后开始基因表达的转录过程。RNA聚合酶只有和启动子结合才可以开始基因的转录过程,启动子是基因转录调控重要的顺式作用元件[1]。
绿色组织在植物的生长发育过程中起着重要的作用。光合作用是植物的重要生理过程,植物的叶片是光合作用的场所,植物利用叶片中的叶绿素等光合色素,在可见光的照射下,将二氧化碳和水转化为有机物,并释放出氧气。蒸腾作用也发生在植物的叶片组织,蒸腾作用促进植物从根系吸收水分和矿质元素,同时降低植物叶片的叶面温度。植物的茎是植物体内物质运输的主要通道,植物叶片制造的有机物通过茎输送到植物体的各部分,同时根部吸收的水分和无机物也通过茎运输到植物的不同部位。植物的绿色组织也是病虫侵害的主要部位。绿色组织特异表达启动子的克隆,能够使外源基因在受体作物中定点、高效地表达[2]。
普通野生稻(Oryza rufipogon)是亚洲栽培稻(Oryza sativa)的近缘祖先种,具有丰富的遗传多样性,是栽培稻改良的重要种质资源[3]。本研究从普通野生稻基因组中克隆了绿色组织特异表达启动子OrGSP,并构建表达载体转化拟南芥验证其功能,为作物分子育种提供了新的调控元件。
1 材料与方法 1.1 材料 1.1.1 植物材料普通野生稻(由本实验室保存),拟南芥哥伦比亚生态型。
1.1.2 载体与菌株pBinGlyRed3-35S-GUS载体(由本实验室保存),pEASY-T1 Simple克隆载体(Transgen Biotech),农杆菌EHA105,Trans-T1 Phage Resistan化学感受多态细胞(Trans Biotech)。
1.2 方法 1.2.1 OrGSG基因表达模式的验证在本实验室前期构建的普通野生稻cDNA文库中筛选到1个FPKM值在苗期叶中远大于根的基因(苗期叶:3682.44033;苗期根:2.214723825),命名为OrGSG。分别提取普通野生稻苗期的根、叶和成熟期的根、茎、叶的总RNA,反转录成cDNA。以cDNA文库中预测的OrGSG基因的CDS序列为模板,设计引物(FP:5'-TTCACCAGCTTCACT CGCC-3',RP:5'-ATCGAAACCGAAGTCTCCC-3')。通过RT-PCR,验证OrGSG基因在苗期的根、叶和成熟期的根、茎、叶中的表达模式,选用OsActin(No.AB047313)作为内参基因(FP:5'-TTGTGTTGGACTCTGGTGA-TG-3',RP:5'-AAGCTCGTAGCTCTTCTCCAC-3'),设置26、28和30循环数梯度。
1.2.2 OrGSG基因启动子的克隆及序列分析将OrGSG基因的CDS序列在NCBI(https://www.ncbi.nlm.nih.gov/)数据库进行Blast比对,得到OrGSG基因的CDS序列比对上的粳稻染色体以及基因。OrGSG基因的启动子命名为OrGSP。比对上的完整基因ATG起始密码子A碱基下游部分序列和上游部分序列为克隆OrGSP启动子的模板,OrGSP启动子扩增引物(FP:5'-ATCTCAT GAAGTTTAGCTTGCCG-3',RP:5'-GAAGACGATGAAATAGATGGGTG-3')。使用PlantCARE在线软件(http://bioinformatics.psb.ugent.be/we)分析启动子的特征元件。
1.2.3 OrGSP-GUS表达载体的构建用加接头的引物(FP:5'-ACGCGTAAGGGGATCC ATCTCAT GAAGTTTAGCTTGCCG-3',RP:5'-GATCTACCATGAATTCGAAGACGATGAAATAGATGGGTG-3')从普通野生稻基因组DNA中克隆带接头序列的OrGSP启动子,其中GGATCC为Bam HI酶切位点,GAATTC为EcoRI酶切位点。将OrGSP启动子和pBinGly-Red3-35S-GUS表达载体骨架进行重组,得到OrGSP-GUS融合的pBinGlyRed3-OrGSP-GUS表达载体。
1.2.4 拟南芥遗传转化及分子鉴定利用冻融法将pBinGlyRed3-35S-GUS和pBinGlyRed3 -OrGSP-GUS表达载体转化到根癌农杆菌EHA105中,其中含35S启动子的pBinGlyRed3-35S-GUS表达载体作为对照。将这两种表达载体通过农杆菌介导的蘸花法转化拟南芥。pBinGlyRed3-35S -GUS和pBinGlyRed3-OrGSP-GUS表达载体都含有红光标记基因,分别转化拟南芥后收获成熟的T0代种子,在绿光灯下,用红色眼镜挑选种子,各挑选显示红色的转基因T0代种子20粒,记为20个株系。当T1代幼苗一个月后取叶片提取基因组DNA,在启动子区域和GUS基因编码区设计引物进行PCR扩增验证。其中转pBinGlyRed3-35S-GUS表达载体T1代幼苗PCR鉴定引物为(FP:5'-gtaagg gatgacgcacaatcc-3',RP:5'-ggtcgtgtagattttcaccgg-3'),转pBinGlyRed3-OrGSP -GUS表达载体T1代幼苗PCR鉴定引物为(FP:5'-cagtacggatgcaatgtgtgt-3',RP:5'-cag cttgctttcgtaccac-tt-3')。
1.2.5 转基因拟南芥的GUS组织化学分析转基因阳性拟南芥T1代种子取一部分在1/2MS培养基上培养。分别取4 d、7 d、14 d、21 d的拟南芥进行GUS染色分析,GUS染色方法见Zhou等[4];转基因阳性拟南芥T1代种子再取一部分在培养基质(珍珠岩:蛭石:拟南芥种植专用土体积比1:1:2)中培养,待其开花后,取其根、茎、叶、花、荚果进行GUS染色分析。
1.2.6 转基因拟南芥的GUS活性分析选5个株系的T1代转基因阳性拟南芥种子,在培养基质中培养。一个月后分别取苗期的根和叶,待拟南芥开花后取成熟期的根、茎和叶,进行GUS活性检测,GUS活性检测方法见文献[5]。
2 结果 2.1 OrGSG基因表达模式验证与序列分析通过RT-PCR验证OrGSG基因在不同发育时期的根、茎、叶的表达模式,结果(图 1)表明该基因在幼苗的叶中表达,在根中不表达,在成熟期的茎和叶中表达,在根中不表达。

|
| 图 1 OrGSG基因表达模式的循环数梯度RT-PCR验证 1:苗期的根;2:苗期的叶;3:成熟期的根;4:成熟期的茎;5:成熟期的叶 |
OrGSG基因的CDS序列99%比对到粳稻9号染色体26810号基因上的16288855到16289372位置。26810号基因长度为2 947 bp,可以编码265个氨基酸,预测功能为可以合成捕光叶绿素a/b结合蛋白。
2.2 启动子OrGSP的克隆与序列分析以普通野生稻基因组DNA为模板,扩增OrGSG基因的启动子序列,扩增出1条约825 bp的条带(图 2),与预期大小一致。

|
| 图 2 启动子OrGSP的PCR产物电泳结果 M:Marker Trans2K;1:启动子OrGSP |
启动子OrGSP长度为825 bp,与比对上的栽培稻序列相似性为100%。对启动子OrGSP序列的顺式作用元件分析,结果(表 1)显示,该启动子的正链以及互补链上存在着多种顺式作用元件,包括决定着转录的起始和方向的核心启动子元件TATA-box和在调控基因转录效率中发挥着重要作用的基本顺式作用元件CAAT-box;6种光响应元件,如TCCC-motif、Sp1、G-box、I-box、GA-motif和as-2-box,其中as-2-box还是茎特异表达元件;2种激素诱导元件,如水杨酸诱导元件TCA-element和赤霉素诱导元件GARE-motif;1种胁迫防御元件TC-rich repeats。
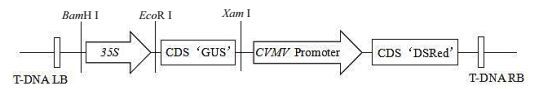
将OrGSP启动子替换pBinGlyRed3-35S-GUS表达载体上的35S启动子,构建绿色组织特异表达的表达载体pBinGlyRed3-OrGSP-GUS(图 3,图 4)。
|
| 图 3 pBinGlyRed3-35S-GUS表达载体图谱 |

|
| 图 4 pBinGlyRed3-OrGSP-GUS表达载体图谱 |
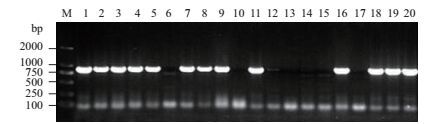
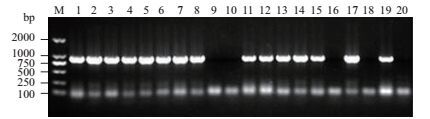
转pBinGlyRed3-35S-GUS和pBinGlyRed3-OrGSP-GUS表达载体的拟南芥T0代红色种子各取20粒,在培养基质中培养一个月后,取T1代幼苗取叶片进行PCR鉴定。从图 5和图 6可知,转pBinGlyRed3-35S-GUS表达载体的拟南芥T1代有13个株系(泳道1、2、3、4、5、7、8、9、11、16、18、19和20)扩增出大小约为850 bp的片段,为阳性株系;转pBinGlyRed3-OrGSP-GUS表达载体的拟南芥T1代有15个株系(泳道1、2、3、4、5、6、7、8、11、12、13、14、15、17、19)扩增出大小约为850 bp的片段,为阳性株系。
|
| 图 5 转pBinGlyRed3-35S-GUS拟南芥T1代幼苗PCR检测 M:Marker Trans2K;1-20:T1代拟南芥20个不同的株系 |
|
| 图 6 转pBinGlyRed3-OrGSP-GUS拟南芥T1代幼苗PCR检测 M:Marker Trans2K;1-20:T1代拟南芥20个不同的株系 |
分别对转pBinGlyRed3-35S-GUS和pBinGlyRed3-OrGSP-GUS表达载体的阳性拟南芥T2代株系进行GUS染色,染色材料为:4 d、7 d、14 d和21 d时的幼苗整株和成熟期的拟南芥根、茎、叶、花和果实。结果(图 7,图 8)显示:幼苗期时,转pBinGlyRed3-35S-GUS表达载体的拟南芥植株在4 d、7 d、14 d和21 d时所有组织中均可以染出颜色,转pBinGlyRed3-OrGSP-GUS表达载体的拟南芥植株在4 d、7 d、14 d和21 d时的根部染不出颜色,其余组织中可以染出颜色;成熟期时,转pBinGlyRed3-35S-GUS表达载体的拟南芥的根、茎、叶、花和角果中都能染出颜色,转pBinGlyRed3-OrGSP-GUS表达载体的拟南芥的根、花和角果染不出颜色,茎和叶中可以染出颜色。这就表明OrGSP启动子在幼苗期和成熟期时都可以调控GUS基因在绿色组织中表达,OrGSP启动子为绿色组织特异表达启动子,OrGSP调控的基因OrGSG为绿色组织特异表达基因。

|
| 图 7 幼苗期转基因阳性拟南芥GUS染色 35S:转pBinGlyRed3-35S-GUS表达载体的拟南芥;OrGSP:转pBinGlyRed3-OrGSP-GUS表达载体的拟南芥 |

|
| 图 8 成熟期转基因阳性拟南芥各组织GUS染色 35S:转pBinGlyRed3-35S-GUS表达载体的拟南芥;OrGSP:转pBinGlyRed3-OrGSP-GUS表达载体的拟南芥 |
转pBinGlyRed3-OrGSP-GUS表达载体的T2代阳性拟南芥苗期叶中的GUS活性远比根中高,经计算,叶中活性约为根中活性的256倍;在成熟期时,转pBinGlyRed3-OrGSP-GUS表达载体的T2代阳性拟南芥茎和叶中的GUS活性远远比根中高,经计算,茎中活性约为根中的310倍,叶中活性约为根中的325倍(图 9)。

|
| 图 9 启动子OrGSP在转基因阳性拟南芥不同组织中的GUS活性检测 苗根:苗期的根;苗叶:苗期的叶;成根:成熟期的根;成茎:成熟期的茎;成叶:成熟期的叶 |
植物绿色组织特异表达启动子的克隆,可以为植物基因工程提供调控元件,使外源基因能在受体作物中定点、高效表达。近年来,在水稻[6-9]、棉花[10]、马铃薯[11]、裂叶牵牛[12]、拟南芥[13]、玉米[14]、番茄[15]等多种植物中克隆出绿色组织特异表达启动子。普通野生稻是亚洲栽培稻的祖先种,广泛分布于东南亚、南亚以及我国的南方地区,具有丰富的遗传多样性[16],但对普通野生稻绿色组织特异表达启动子的研究还未见报道。
本研究从本实验室前期构建的普通野生稻cDNA文库中筛选到一个绿色组织特异表达基因OrGSG。该基因的CDS序列99%比对到粳稻9号染色体26810号基因上的16288855到16289372位置。26810号基因长度为2 947 bp,功能预测为可以合成捕光叶绿素a/b蛋白。捕光叶绿素a/b结合蛋白与光合色素所形成的色素蛋白复合体(LHC)是一类吸收、传递光能并引起光合作用的光反应的色素蛋白复合体。色素蛋白复合体(LHC)在维持叶绿体囊状结构薄膜结构,调节光系统I和光系统II之间激发能的分配以及适应不同环境等方面都起着重要的作用[17]。捕光叶绿素a/b结合蛋白基因的启动子之前报道为绿色组织特异表达启动子[18],李为民等[19]从金华中棉中克隆得到捕光叶绿素a/b结合蛋白基因Gacab转录起始位点上游1 009 bp的启动子GacabP,构建GacabP和GUS基因融合的表达载体转化烟草,GUS组织化学分析发现,GacabP调控GUS基因在转基因阳性烟草的叶片表达,表明GacabP是一个叶特异表达启动子。
本研究克隆了普通野生稻绿色组织特异表达启动子OrGSP,长度为825 bp,其正链及互补链上有多种顺式作用元件,除含有决定转录的起始和方向的核心启动子元件TATA-box和在调控基因转录效率中发挥着重要作用的基本顺式作用元件CAAT-box外,还存在一些与光反应、激素诱导和胁迫防御相关的顺式作用元件。转OrGSP和GUS基因融合的表达载体的T2代阳性拟南芥GUS组织化学分析表明OrGSP为绿色组织特异表达启动子。转基因拟南芥植株的GUS活性检测结果显示,在苗期和成熟期时,绿色组织中的GUS活性都比根中明显提高。
植物的绿色组织是病虫侵害的主要部位,稻瘟病、纹枯病和白叶枯病主要发生在水稻的绿色组织中[20-22]。Cai等[8]将水稻绿色组织特异表达启动子PD540与cry1AC基因融合的表达载体转化水稻,结果显示,转基因阳性水稻不仅在抗稻纵卷叶螟上有着明显的优势,而且水稻胚乳中检测不到cry1AC的表达,说明该启动子在转基因抗虫水稻的培育和和转基因生物安全方面有着重要的应用价值。Yang等[23]利用合成型绿色组织特异表达启动子pGreen和合成型抗虫基因融合表达载体转化水稻,结果表明,转基因阳性水稻对水稻二化螟和棉铃虫有着良好的抗性。
4 结论本研究克隆了普通野生稻的启动子OrGSP,在拟南芥中验证了功能,该启动子为绿色组织特异表达启动子。
| [1] | Porto M, Pinheiro M, Batista V, et al. Plant promoters:An approach of structure and function[J]. Molecular Biotechnology, 2014, 56 (1): 38–49. DOI:10.1007/s12033-013-9713-1 |
| [2] | Chen L, Jiang B, Wu C, et al. The characterization of GmTIP, a root-specific gene from soybean, and the expression analysis of its promoter[J]. Plant Cell, Tissue and Organ Culture, 2015, 121 (2): 259–274. DOI:10.1007/s11240-014-0682-2 |
| [3] | Tian X, Long Y, Wang J, et al. De novo transcriptome assembly of common wild rice(Oryza rufipogon Griff.)and discovery of drought-response genes in root tissue based on transcriptomic data[J]. PLoS One, 2015, 10 (7): e0131455. DOI:10.1371/journal.pone.0131455 |
| [4] | Zhou Y, Huang W, Liu L, et al. Identification and functional characterization of a rice NAC gene involved in the regulation of leaf senescence[J]. BMC Plant Biology, 2013, 13 : 132. DOI:10.1186/1471-2229-13-132 |
| [5] | Banerjee J, Sahoo D, Raha S, et al. A region containing an as-1 element of Dahlia mosaic virus(DaMV)subgenomic transcript promoter plays a key role in green tissue-and root-specific expression in plants[J]. Plant Mol Biol Reporter, 2015, 33 (3): 532–556. DOI:10.1007/s11105-014-0766-5 |
| [6] | Ye R, Zhou F, Lin Y. Two novel positive cis-regulatory elements involved in green tissue-specific specific promoter activity in rice(Oryza sativa L ssp.)[J]. Plant Cell Report, 2012, 31 (7): 1159–1172. DOI:10.1007/s00299-012-1238-8 |
| [7] | Yang Z, Lu Q, Wen X, et al. Functional analysis of the rice rubisco activase promoter in transgenic Arabidopsis[J]. Biochemical and Biophysical Research Communications, 2012, 418 (3): 565–570. DOI:10.1016/j.bbrc.2012.01.073 |
| [8] | Cai M, Wei J, Li X, et al. A rice promoter containing both novel positive and negative cis-elements for regulation of green tissue-specific gene expression in transgenic plants[J]. Plant Biotechnology Journal, 2007, 5 (5): 664–674. DOI:10.1111/pbi.2007.5.issue-5 |
| [9] | Thilmony R, Guttman M, James G, et al. The LP2 leucine-rich repeat receptor kinase gene promoter directs organ-specific, light-responsive expression in transgenic rice[J]. Plant Biotechnology Journal, 2009, 7 (9): 867–882. DOI:10.1111/pbi.2009.7.issue-9 |
| [10] | 刘聚波, 张玉娟, 陈洁, 等. 棉花GhRCA1基因启动子的克隆及序列分析[J]. 分子植物育种, 2014, 12(4): 701–711. |
| [11] | Qu D, Song Y, Li W, et al. Isolation and characterization of the organ-specific and light-inducible promoter of the gene encoding rubisco activase in potato(Solanum tuberosum)[J]. Genetics and Molecular Research, 2011, 10 (2): 621–631. DOI:10.4238/vol10-2gmr1088 |
| [12] | 杨予涛, 杨国栋, 刘石娟, 等. 一个光合组织特异表达强启动子的分离及功能分析[J]. 中国科学(C辑生命科学), 2003, 33(4): 298–306. |
| [13] | 王利军, 范三红, 郭蔼光. 拟南芥ats1A基因启动子的克隆和功能分析[J]. 西北植物学报, 2004, 24(10): 1856–1860. DOI:10.3321/j.issn:1000-4025.2004.10.015 |
| [14] | Taniguchi M, Izawa K, Ku M, et al. The promoter for the maize C4 pyruvate, orthophosphate dikinase gene directs cell-and tissue-specific transcription in transgenic maize plants[J]. Plant Cell Physiology, 2000, 41 (1): 42–48. DOI:10.1093/pcp/41.1.42 |
| [15] | Kyozuka J, McElroy D, Hayakawa T, et al. Light-regulated and cell-specific expression of tomato rbcS-gusA and rice rbcS-gusA fusion genes in transgenic rice[J]. Plant Physiology, 1993, 102 (3): 991–1000. DOI:10.1104/pp.102.3.991 |
| [16] | Kovach M, Sweeney M, McCouch S. New insights into the history of rice demestication[J]. Trends In Genetics, 2007, 23 (11): 578–587. DOI:10.1016/j.tig.2007.08.012 |
| [17] | Kong F, Zhou Y, Sun P, et al. Identification of light-harvesting chlorophyll a/b-binding protein genes of zostera marina L. and their expression under different environmental conditions[J]. Oceanic and Coastal Sea Research, 2016, 15 (1): 152–162. |
| [18] | 王淼, 王旭静, 唐巧玲, 等. 高等植物绿色组织特异表达启动子研究进展[J]. 中国农业科技导报, 2010, 12(2): 33–37. |
| [19] | 李为民, 王志兴, 裴新梧, 等. 中棉光诱导基因Gacab启动子的克隆及其功能分析[J]. 农业生物技术学报, 2004, 12(3): 253–257. |
| [20] | 章琦. 中国杂交水稻白叶枯病抗性的遗传改良[J]. 中国水稻科学, 2009, 23(2): 111–119. |
| [21] | 夏更寿. 水稻抗纹枯病基因OsSeh1的克隆及功能鉴定[J]. 核农学报, 2016, 30(2): 231–239. DOI:10.11869/j.issn.100-8551.2016.02.0231 |
| [22] | 何秀英, 王玲, 吴伟怀, 等. 水稻稻瘟病抗性基因的定位、克隆及育种应用研究进展[J]. 中国农学通报, 2014, 3(6): 1–12. DOI:10.11924/j.issn.1000-6850.2013-1123 |
| [23] | Yang Y, Mei F, Zhang W, et al. Creation of Bt rice expressing a fusion protein of Cry1Ac and Cry1I-Like using a green tissue-specific promoter[J]. Journalof Entomology, 2014, 107 (4): 1674–1679. |





