植物角质层蜡质是一层覆盖在植物叶片表面的表皮细胞的脂肪性物质,它具有防止植物体内水分丧失[1-3]、对抗非生物胁迫干旱[4]、保护植物抵御紫外辐射以及帮助叶片免受积聚灰尘、花粉和空气污染[5]的影响、抵抗细菌和真菌类病原菌[6-8]等作用。研究表明,有蜡质(白霜状)表型的材料其抗旱节水性和产量都要高于无蜡质表型的材料[9, 10]。双子叶植物拟南芥是典型的叶片角质蜡质含量低的植物,叶片表面缺乏蜡质晶体,而单子叶模式植物水稻叶片角质蜡质含量丰富。水稻作为重要的模式作物,其蜡质调控基因的研究将有利于提高其抗逆能力。目前,在拟南芥中对表皮蜡质的合成基因的调控研究较多[11-15],而对水稻蜡质合成途径研究较少。迄今,在水稻中已克隆了13个蜡质相关基因,其中wda1是水稻中第一个被克隆的蜡质基因,wda1突变体花药表面蜡质晶体减少,花粉小孢子发育受阻,花粉外壁发育缺陷,从而雄性不育。wsl1基因是第一个克隆到的、影响水稻叶片表面蜡质含量的基因,编码水稻KCS基因家族一员。大多蜡质基因过表达能够显著提高植物的抗旱性,但是部分附带着一些不利农艺性状:如矮化、育性低等形态特点,限制了这些蜡质基因的进一步应用。
为进一步研究水稻叶片蜡质合成的作用机理,利用本实验室前期建立的一个水稻大容量T-DNA插入突变体库[17],从突变体库筛选获得15份叶片不粘水的突变体。本研究对其中一份无蜡质突变体wcl1(Wax Crystal-Sparse Leaf 1)开展研究,从遗传、表型特征上进行分析,并图位克隆控制突变体wcl1的基因,进一步探索利用水稻无蜡基因提高水稻耐旱的可能性。
1 材料与方法 1.1 材料水稻无蜡质突变体wcl1来自本实验室所创制的粳稻品种日本晴(Oryza sativa L. japonica cv. Nipponbare)T-DNA插入突变体库。经过多次自交,突变体wcl1性状稳定遗传,后代无性状分离。
1.2 方法 1.2.1 遗传规律和表型性状统计将突变体wcl1种植农科院试验基地,观察表型。水稻成熟后统计其农艺性状。同时将突变体wcl1和野生型进行正反交,统计F2代分离规律。
1.2.2 突变体wcl1和野生型水稻叶片的扫描电镜观察在正常大田生长条件下,在抽穗期取野生型和突变体的剑叶,置于空气中自然风干,将样品置于JEOUFC-1600镀膜机上喷金后,在扫描电子显微镜(JSM-6380LV)下观察、拍照。
1.2.3 图位群体的构建将突变体wcl1与籼稻广亲和亲本Dular进行正反交,收获F1、F2种子,将F2种于大田,取隐性单株进行遗传定位和基因克隆。定位群体、日本晴及Dular的叶片DNA提取参照改进的CTAB法[18]。初定位用3个混池,每个混池由3个隐性单株组成,同时提取500份隐性表型单株DNA用于精细定位。
1.2.4 图位克隆 1.2.4.1 分子标记设计及PCR扩增基于不同水稻品种产生的基因组插入与缺失差异,应用网上公布的粳稻日本晴与籼稻9311全基因组序列的比对结果,寻找具有差异的基因组片段来设计引物。引物设计所用软件为DNAMAN VERSION 4.0,用于对日本晴和Dular的DNA进行PCR扩增,来获取多态性。累计设计了初定位引物共200对,实际检测可用引物110对,12条染色体中平均3 Mbp设计一对引物。
PCR扩增体系(20 µL):2×buffer 10 µL,20 pmol/L引物(正向+反向)2 µL,模板DNA(100 ng)2 µL,2.5 mmol/L dNTPs 1µL,rTaq DNA聚合酶1 µL,ddH2O补足为10 µL。反应程序:94℃预变性5 min;94℃变性30 s,58℃复性30 s,72℃延伸30 s,30个循环;72℃总延伸5 min。根据PCR产物片段差异的大小选择4%的琼脂糖凝胶电泳(插入或缺失片段16 bp以上)或10%的聚丙烯酰胺凝胶电泳(插入或缺失片段5 bp以上)检测,结果用凝胶成像仪记录下来。
1.2.4.2 精细定位应用图位克隆[18]技术,利用初定位引物对3个DNA混池、日本晴及Dular进行PCR扩增和凝胶电泳,确定连锁关系,得到共分离引物后,在区间内设计精细定位引物,扩大定位群体,逐渐缩小定位区间。
根据凝胶电泳结果,将与隐性亲本带型一致的标为1型带,与显性亲本一致的标为2型带,同时具有双亲本带型的标为3型带,统计各带型数量和分布规律。
1.2.4.3 突变基因分析对精细定位区段内的候选基因进行测序,寻找到突变基因,并对该基因和突变位点进行生物信息学相关分析,进一步阐明表型与基因的对应关系。
1.2.4.4 干旱胁迫分析利用20%PEG4000的水培营养液模拟干旱胁迫环境,对生长至三叶期的野生型和wcl1突变体进行PEG4000干旱处理。每隔1 d对野生型和突变体进行表型观察、拍照。并统计突变体wcl1和野生型叶片在干旱条件下(0-8 h)叶片水分散失率(注:在正常生长条件下,突变体与野生型水稻散失率没有显著区别)。
2 结果 2.1 突变体wcl1形态学特征和细胞学特征与野生型日本晴相比,突变体wcl1的农艺性状(株高、分蘖数、花期等)没有显著差别(图 1-A)。但是,在粘水后,两者呈现显著的差别,因野生型叶皮有蜡质,呈现出粘水特性,而突变体wcl1叶片因缺少蜡质,表现为不粘水(图 1-B)。扫描电镜(SEM)观察显示,与野生型相比,突变体wcl1表皮叶片蜡质晶状体密度降低、含量减少,乳突数量减少。这可能是突变体wcl1呈现不粘水的主要原因(图 1-C、D)。

|
| 图 1 突变型与野生型表型比较图 A:野生型(NIP)与突变体wcl1的形态学比较(Bar=10 cm);B:野生型与突变体wcl1的粘水试验;C:野生型叶片的扫描电镜图(Bar= 0.5 μm);D:突变体wcl1叶片的扫描电镜图(Bar= 0.5 μm) |
由于叶片角质层与非气孔水分散失的功能有关,突变体水稻的耐旱性很可能也会改变。为了验证该假设,对萌发3叶期的野生型和突变体wcl1进行干旱处理。处理前两者生长状态基本一致(图 2-A),干旱处理3 d时,发现突变体wcl1已基本卷曲枯萎,而野生型有80%植株表现绿色(图 2-B),结果表明突变体wcl1是一个干旱敏感突变体(图 2-C)。

|
| 图 2 野生型和突变体wcl1干旱试验比较图 A:干旱处理前(Bar=2 cm);B:干旱处理3 d后(Bar=2 cm);C:不同处理时间下的失水率 |
为了研究突变体wcl1的遗传规律,我们进行了突变体wcl1与野生型的正交与反交,F1代叶片表面蜡质表型表现为野生型,表明该表型由隐性核基因控制。统计了F2代植株的分离比(突变体表型:野生型表型)结果(表 1)显示差异显著,符合孟德尔1:3的分离规律,表明突变体表型受一对单隐性核基因控制。
用均匀分布于全基因组的110对初定位引物对日本晴和Dular的3个混池、进行PCR扩增和凝胶电泳检测,发现3个混池和9号染色体长臂上的Indel1-1和Indel1-2分子标记连锁。再用Indel1-1和Indel1-2分子标记对17株F2代单株进行进一步连锁分析,结果表明该分子标记确实与突变位点连锁,将基因锁在分子标记Indel1-1(图 3-A)和Indel1-2(图 3-B)之间。
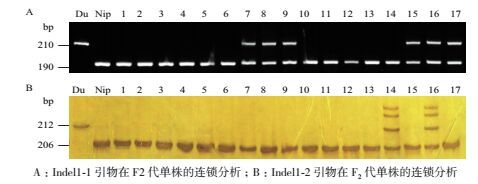
|
| 图 3 突变体wcl1基因连锁分析电泳图 A:Indel1-1引物在F2代单株的连锁分析;B:Indel1-2引物在F2代单株的连锁分析 |
利用F2代群体,将基因WCL1锁定在分子标记Indel1-1和Idel1-2的区间内(图 4-A),在区间内再设计新的分子标记P1和P2,并进一步缩小了区间(图 4-B)。对该区间4个候选基因Os09g25830、Os09g25840、Os09g25850、Os09g25860(图 4-C)在突变体wcl1中进行PCR扩增并测序,发现在Os09g25850中的一个碱基鸟嘌呤(G)颠换为胸腺嘧啶(T)(图 4-D),经生物信息学分析,该突变导致转录提前终止。

|
| 图 4 基因wcl1图位克隆 A:突变体wcl1的初定位;B:突变体wcl1的精细定位;C:候选区域;D:LOC_e基因在突变体wcl1中的序列分析及等位基因wsl2 |
本研究通过筛选水稻T-DNA突变体库,获得了一个稳定遗传的隐性无蜡质的突变体wcl1,相对于野生型,其具有叶片失水率快,不耐干旱等特点。对成熟期叶片进行扫描电镜观察,发现突变体wcl1叶片表面缺少蜡质,这可能是使植物叶片不粘水的主要原因。虽然突变体wcl1是从T-DNA插入突变体库筛选获得,但是其不是由T-DNA插入引起。我们通过图位克隆该基因,其突变位点在LOC_OS09g25850基因第10外显子上,发生鸟嘌呤(G)颠换为胸腺嘧啶(T),造成基因转录提前终止,从而致使基因失活,且该基因等位于wsl2[19]。LOC_OS09g25850编码β-酮脂酰辅酶A合成酶(LOC_OS09g25850),是超长链脂肪酸延伸过程中的关键酶,负责蜡质成分前体的合成。虽然它与wsl2基因等位,但是其属于不同的突变方式,在wcl1中 LOC_OS09g25850基因提前终止,而在wsl2中LOC_OS09g25850基因的第六外显子与内含子不能正确剪切,wcl1的突变位置位于第10外显子处,相较wsl2,wcl1可能属于一个弱突变。该研究结果明确了突变体wcl1的表型特征与遗传基础。
干旱等非生物逆境造成农作物的生长抑制和严重的减产[20, 21]。植物从水生的藻类进化到陆生植物,处于最外层的表皮蜡质提供了必需的保护层以阻挡体内水分流失,使得植物能够适应干旱等不利环境[22]。目前虽然已经发现了多个蜡质代谢相关基因参与了植物对干旱环境的适应,但是大部分均没有用于改良农作物的抗旱性实践。突变体wcl1对干旱敏感特性为进一步利用wcl1基因用于植物的耐旱性遗传改良提供了新的启示。
4 结论本实验筛选获得1个无蜡质突变体wcl1。克隆了WCL1基因,虽然它与WSL2基因等位,但是其属于不同的突变方式,wcl1是提前终止,而wsl2不能正确剪切。
| [1] | Kerstiens G. Cuticular water permeability and its physiological significance[J]. J Exp Bot, 1996, 47 (305): 1813–1832. |
| [2] | Riederer M, Schreiber L. Protecting against water loss:analysis of thebarrier properties of plant cuticles[J]. J Exp Bot, 2001, 52 : 2023–2032. DOI:10.1093/jexbot/52.363.2023 |
| [3] | Goodwin SM, Jenks M. Plant cuticle function as a barrierto water loss[M]//Jenks Ma, Hasegawa PM. Plant Abiotic Stress, Wiley-Blackwell, 2005:4-36. |
| [4] | Costaglioli P, Joubeè J, Garcia C, et al. Profiling candidate genes involved in wax biosynthesis in Arabidopsis thaliana by microarray analysis[J]. Biochim Biophys Acta, 2005, 1734 : 247–258. DOI:10.1016/j.bbalip.2005.04.002 |
| [5] | Jenks MA, Tuttle HA, et al. Leaf epicuticular waxes of the eceriferu-mmutants in Arabidopsis[J]. Plant Physiol, 1995, 108 : 369–377. DOI:10.1104/pp.108.1.369 |
| [6] | Gan L, Wang XL, Cheng ZJ, et al. Wax crystal-sparse leaf 3 encoding a b-ketoacyl-CoA reductase is involved in cuticular wax biosynthesis in rice[J]. Plant Cell Rep, 2016, 35 : 1687–1698. DOI:10.1007/s00299-016-1983-1 |
| [7] | Reicosky DA, Hanover JW. Physiological effects of surface waxes. I. Light reflectance for glaucous and nonglaucous Picea pungens[J]. Plant Physiol, 1978, 62 : 101–104. DOI:10.1104/pp.62.1.101 |
| [8] | Kunst L, Samuels AL. Biosynthesis and secretion of plant cuticular wax[J]. Prog Lipid Res, 2003, 42 : 51–80. DOI:10.1016/S0163-7827(02)00045-0 |
| [9] | Jenks MA, Joly RJ, PetersPJ, et al. Chemically induced cuticle mutation affecting epidermalconductance to water vapor and disease susceptibility in Sorghum bicolor(L.)moench[J]. Plant Physiol, 1994, 105 : 1239–1245. DOI:10.1104/pp.105.4.1239 |
| [10] | Febrero A, Fernández S, Molina-Cano JL, et al. Yield, carboniso-tope discrimination, canopy reflectance and cuticular conductance of barleyisolines of differing glaucousness[J]. J Exp Bot, 1998, 49 : 1575–1581. DOI:10.1093/jxb/49.326.1575 |
| [11] | Saneoka H, Ogata S. Relationshipbetween water use efficiency and cuticular wax deposition in warm season forage crops grown underwater deficit conditions[J]. Soil Sci Plant Nutr, 1987, 33 (3): 439–448. DOI:10.1080/00380768.1987.10557590 |
| [12] | Goodwin SM, Rashotte AM, et al. Wax constituents on the inflores-cence stems of double eceriferum mutants in Arabidopsis reveal complex gene interactions[J]. Phytochemistry, 2005, 66 : 771–780. DOI:10.1016/j.phytochem.2005.02.001 |
| [13] | Rowland O, Lee R, Franke R, et al. The CER3 wax biosynthetic gene from Arabidopsis thaliana is allelic to WAX2/YRE/FLP1[J]. FEBS Letters, 2007, 581 : 3538–3544. DOI:10.1016/j.febslet.2007.06.065 |
| [14] | Rashotte AM, Jenks MA, Feldmann KA. Cuticular waxes on eceriferum mutants of Arabidopsis thaliana[J]. Phytochemistry, 2001, 57 : 115–123. DOI:10.1016/S0031-9422(00)00513-6 |
| [15] | Samuels L, De Bono A, Lam P, et al. Use of Arabidopsis eceriferum mutants to explore plant cuticle biosynthesis[J]. Journal of Visualized Experiments, 2008 : 1–2. |
| [16] | 周小云. 水稻叶表皮蜡质发育及蜡质相关转录因子基因OsWTF1和OsWTF2的克隆与鉴定[D]. 长沙: 湖南农业大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10537-2008048455.htm |
| [17] | Wan SY, Wu JX, Zhang ZG, et al. Activation tagging, an efficient tool for functional analysis of the rice genome[J]. Plant Mol Biol, 2009, 69 : 69–80. DOI:10.1007/s11103-008-9406-5 |
| [18] | Liu YG, Chen YL. High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J]. Bio Techniques, 2007, 43 (5): 649–656. |
| [19] | Mao BG, Cheng ZJ, Lei C, et al. Wax crystal-sparse leaf2, a rice homologue of WAX2/GL1, is involved in synthesis of leaf cuticular wax[J]. Planta, 2012, 235 : 39–52. DOI:10.1007/s00425-011-1481-1 |
| [20] | 严企松. 水稻抗逆性与育种[J]. 安徽农业科学, 1990, 43(1): 9–14. |
| [21] | 陈秀晨, 熊冬金. 植物抗逆性研究进展[J]. 湖北农业科学, 2010, 49(9): 2253–2256. |
| [22] | Shepherd T, Griffiths DW. The effects of stress on plant cuticular waxes[J]. New Phytologist, 2006, 171 : 469–499. DOI:10.1111/j.1469-8137.2006.01826.x |





