甲状腺激素(Thyrodi hormone,TH)对生物生长、分化、发育和保持代谢平衡具有十分重要的作用[1-3]。TH的生理作用主要是通过甲状腺激素受体(Thyrodi hormone receptor,THR)进行[4]。冯绮文等[5]表明甲状腺激素受体(THR)是一种重要的核受体超家族的成员,THR分子可分成6个区,从氨基端到羧基端依次为A-F区,它们组成3个功能域。其中A区和B区合称为A/B区,组成转录激活域,其内参与转录激活作用的区域称为AF1区;C区形成DNA结合域(DBD),E区形成配体结合(LBD),而F区的功能则不很清楚[6, 7]。甲状腺激素受体作为一种核受体不仅可以直接作用于靶基因调节转录[8, 9],也可与相关蛋白发生相互作用。近年来有相关研究表明甲状腺激素对microRNA的表达有一定的影响[10-12],但两者之间的相互作用尚未清楚。microRNA是进化上保守的非编码RNAs,长度约为22个碱基,通过参与动植物的转录后调控,在基因表达调控中发挥重要的作用[13, 14]。microRNA合成与加工成熟主要受核糖核酸内切酶Ⅲ Drosha酶和Dicer酶发挥作用[15]。其中Drosha酶主要负责细胞核内将miRNA前前体pri-miRNA切割成前体pre-miRNA[16],随后Dicer将其加工成成熟的miRNA[17]。同时张红梅等[18]研究发现,牙鲆变态期间甲状腺激素对Drosha基因的表达有一定的影响。
因此,本实验以HEK293细胞为材料,利用免疫共沉淀的方法获得蛋白免疫复合物,再经Western blot检测和质谱分析,从而验证甲状腺激素受体与Drosha之间是否存在相互关系,为探究甲状腺激素调控microRNA的作用机制提供实验依据。
1 材料与方法 1.1 材料本实验以HEK293细胞为材料,由本实验室保存;DMEM、胎牛血清购自Gibco公司;上样缓冲、细胞裂解液(上海威奥);蛋白酶抑制剂(Bio-Rad);proteinA琼脂糖珠购自上海翊圣生物;Thyroid Hormone Receptor Antibody(C3)多抗(编号MA1-215)和Drosha Antibody单克隆抗体(编号MA5-14783)购自Thermo公司;脱脂奶粉、蛋白Marker、ECL化学发光试剂盒、HRP标记的鼠二抗和HRP标记的兔二抗购自上海生工。
1.2 方法 1.2.1 细胞培养及总蛋白提取将HEK293细胞用含10%的胎牛血清的DMEM培养基在37℃、5% CO2条件下在CO2恒温培养箱中培养,显微镜观察培养瓶中细胞生长处于对数期时,将培养瓶中的293细胞去除培养液,用预冷PBS清洗细胞2次,每次5 min,吸取PBS,加入0.5 mL蛋白酶(0.25%),摇匀使其与细胞充分接触,显微镜观察当多数细胞变为圆形即将脱壁加入含FBS的培养基终止消化,用移液器吹打使细胞脱壁,将细胞移至1.5 mL EP管中,1 000 r/min离心5min,收集细胞。加入预冷的含蛋白酶抑制剂(裂解液:PMSF=99:1)的细胞裂解液,现配现用,混匀后在冰上轻微摇晃5-10 min;充分裂解后离心,条件13 000 r/min、4℃、5 min,取上清置干净的离心管中,分装使用或者冻存(-80℃),用于后续试验。
1.2.2 BCA法测定蛋白浓度将蛋白样品按0、1、2、4、8、12、16和20 μL分别加入到96孔酶标板中,并相应加入dH2O缓冲液至每个样品反应液体积为20 μL,再各加入200 μL BCA工作液并充分混匀;将板放置37℃恒温箱反应30 min;酶标板冷却至室温后放入酶标仪,562 nm波长下读数;根据绘制的标准曲线结果计算蛋白浓度;将蛋白按测定浓度比例加入5×SDS-PAGE上样缓冲液煮沸5 min,-80℃保存。
1.2.3 免疫共沉淀(Co-Immunoprecipitation)将上述提取的含1mg总蛋白细胞裂解液中分别加入1 μg甲状腺激素受体抗体和Drosha抗体中,两者分别都以1:50的比例稀释;用锡纸包住上述混合液,4℃缓慢摇晃过夜;Protein A琼脂糖珠准备,取30 μL Protein A琼脂糖珠,用适量细胞裂解清洗3次,3 000 r/min,3 min,吸取Protein A琼脂糖珠时将tip减掉一部分,避免破坏珠子;将预处理过的Protein A琼脂糖珠加入到与抗体孵育过夜的细胞裂解液中4℃ 2-4 h,使Protein A琼脂糖珠来捕获抗原抗体复合物;免疫沉淀反应后,4℃以3 000 r/min离心5 min,将上清吸去,收集珠子抗原抗体复合物,用细胞裂解液清洗珠子4次,加入15 μL 2×SDS上样缓冲液,100℃煮沸5 min,使抗原、抗体、琼脂糖珠分离,离心吸取上清进行电泳。用于Western blot和质谱分析。
1.2.4 Western Blot检测分析将上述免疫沉淀复合物产物分别进行SDS-PAGE电泳检测,半干法转膜,将转膜后的PVDF膜用TBST洗膜两次,每次10 min,加入适量的新鲜配制的脱脂奶粉封闭液,在摇床上缓慢摇晃封闭2 h;封闭完后,按照一抗抗体(1:1 000)说明书用TBST缓冲液书稀释Thyroid Hormone Receptor Antibody(C3)混合抗体和Drosha Antibody单克隆抗体抗体,4℃孵育过夜;TBST洗膜两次,每次10min,按照二抗说明书(1:2 000)要求用TBST稀释HRP标记的鼠抗羊IgG和HRP标记的羊抗兔,将PVDF膜与稀释液充分接触室温孵育2 h;ECL曝光、显色,拍照。
1.2.5 质谱检测分析将免疫沉淀复合物进行SDS-PAGE电泳后,切取含蛋白质Marker和目标蛋白的凝胶进行染色及脱色,脱色完成后切割所要的目的条带,将样品冻干,加入40 μL Trypsin buffer,37℃ 16-18 h。进行毛细管高效液相色谱分离,液相A液为0.1%甲酸水溶液,B液为0.1%甲酸乙腈水溶液(乙腈为84%),色谱柱Thermo scientific EASY column(2 cm×100 μm 5 μm-C18)以95%的A液平衡。每份样品经毛细管高效液相色谱分离后用Q-Exactive质谱仪(Thermo Sceientific)进行质谱分析,质谱鉴定原始文件使用Mascot软件版本为Mascot 2.2搜库,最后得到鉴定蛋白结果。
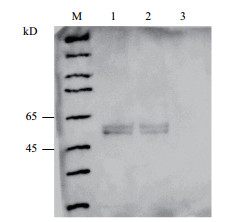
2 结果 2.1 Western Blot检测免疫沉淀复合物通过对HEK293细胞总蛋白提取,采用购自于Thermo公司THR(C3)THR多抗与其进行免疫沉淀,获得免疫复合物。将免疫复合物进行电泳转膜后,再用Drosha抗体进行免疫印迹分析,检测HEK293细胞总蛋白免疫复合物中是否存在Drosha蛋白。结果(图 1)显示,免疫复合物中含有Drosha蛋白,并且蛋白位置与HEK293细胞总蛋白中经Western blot检测到的Drosha蛋白位置一致;同时,进行反向免疫沉淀,采用购自于Thermo公司单抗Drosha抗体与HEK293细胞总蛋白反应,获得免疫复合物。将免疫复合物电泳转膜后,用THR抗体进行免疫印迹,检测HEK293细胞总蛋白免疫复合物中是否存在THR。结果(图 2)显示,免疫印迹检测到THR蛋白,并且该位置与HEK293细胞总蛋白中经Western blot检测到的THR位置一致。揭示THR与Drosha蛋白之间存在相互作用。

|
| 图 1 Western blot检测免疫复合物中Drosha蛋白 1:阳性对照;2:细胞THR抗体免疫共沉淀;3:阴性对照 |
|
| 图 2 Western Blot检测免疫复合物中THR 1:阳性对照;2:细胞Drosha抗体免疫共沉淀;3:阴性对照 |
实验通过Drosha抗体与HEK293细胞总蛋白进行免疫沉淀。将免疫复合物SDS电泳后,获得含有目的蛋白的胶条泳道,经MS鉴定分析,结果(表 1)显示:免疫复合物中含有甲状腺激素受体α、β氨基酸肽段序列,分子量分别为14.02 kD和91.72 kD,理论等电点(pI)分别为6.21和6.64,均与报道相符合,并且具有可信的Score。结果证明Drosha蛋白与甲状腺激素受体有作用。
利用THR抗体进行免疫沉淀后,将免疫复合物经SDS电泳,割取含目标蛋白胶条泳道,MS分析显示,免疫复合物中含有Drosha肽段序列,其分子量为159.31 kD,pI为8,与报道相符合,并且具有可信的Score。结果证明甲状腺激素受体与Drosha有作用。
2.3 共同作用蛋白系统分析结果利用上述质谱鉴定结果,筛选出两者共同作用蛋白分子54个,应用Go系统聚类分析(图 3-A)发现其不仅参与甲状腺激素受体及Drosa蛋白的生物学作用,而且也参与了细胞迁移、细胞生物合成途径、细胞凋亡、细胞周期、蛋白代谢途径、炎症反应、免疫应答、信号通路调节、转录调控、视觉神经调节和真菌细菌的防御体系等多种生物途径。细胞内组成成分分析(图 3-B)显示,检测出的蛋白主要是细胞膜和细胞核中成分,分子功能分析结果(图 3-C)显示,检测出的蛋白涵盖了核酸结合、蛋白结合、ATP结合、细胞骨架结合、酶活性修饰等。

|
| 图 3 GO聚类分析结果 A:生物途径;B:细胞成分;C:分子功能 |
Drosha在microRNA合成与加工成熟机制中发挥着重要作用。有相关研究证明在细胞核内Drosha将前前体pri-miRNA切割为前体pre-miRNA[19],然后经Dicer加工为成熟的miRNA。Drosha作为microRNA上游关键调控因子,其表达量异常理论上可以引起下游一系列microRNA的改变。有研究报道将Drosha基因沉默后前前体pri-miRNA表达量几乎不变而成熟的microRNA表达显著降低,同时沉默后细胞凋亡现象加剧[18]。
近年来研究表明,甲状腺激素对microRNA的表达具有作用[10-12],但其作用机制尚不清楚。由于Drosha在microRNA加工成熟方面起着关键作用,因此本实验从Drosha酶入手,研究甲状腺激素受体与Drosha酶之间的相互关系,进而初步探究其作用机制。实验通过从HEK293细胞中提取总蛋白利用Co-IP的方法来检测细胞内蛋白之间的相互作用,该技术是一种经典而成熟的方法[20]。在细胞内自然状态下利用特异性抗体去捕获抗原及与之相互作用的蛋白复合物,然后用免疫印迹和MS的方法确定蛋白相互作用,该方法能真实反应生理条件下蛋白相互作用。我们先用TR抗体捕获相互作用蛋白,经Western Blot检测存在Drosha酶,再用Drosha抗体捕获相互作用蛋白,经Western Blot也检测到TR的存在,由此初步验证两者之间有相互作用。为了更进一步加以验证,我们将上述免疫共沉淀复合物进行质谱鉴定分析,结果发现TR抗体免疫复合物中质谱鉴定到Drosha蛋白,Drosha抗体免疫复合物中也鉴定到TR存在,这进一步证实两者之间确实存在相互作用。基于上述结论可知甲状腺激素对microRNA的影响可能是作用于Drosha进而对microRNA起调控作用。
同时,质谱分析结果显示与两者共同作用的蛋白有54个,经GO功能聚类分析这些蛋白主要是细胞膜和细胞核中成分,这与研究证明的甲状腺激素受体膜蛋白及Drosha酶的细胞核内剪切的细胞内分布有一定联系,这些蛋白不仅参与甲状腺激素受体及Drosa蛋白的生物学作用,也参与细胞迁移、细胞生物合成、细胞凋亡、细胞周期、蛋白代谢、炎症反应、信号通路调节、免疫应答、转录调控、视觉神经调节和真菌细菌的防御体系,并且具有钙离子结合、核酸结合、蛋白结合、ATP结合、核糖体构成、细胞骨架结合、酶活性修饰等分子功能。有研究报道Drosha基因在血管平滑肌信号通路上起着关键作用,敲除后会降低血管平滑肌细胞中信号蛋白的表达,引起信号通路的改变,导致小鼠早期胚胎死亡[21]。在研究对虾中发现将Drosha基因敲降后出现更多的病毒感染[22],说明Drosha参与了免疫应答反应。又有相关研究表明甲状腺激素受体影响细胞的周期及直接的调节转录或调节其他途径的活性[23]。这些研究与本实验质谱鉴定出的互作蛋白功能分析结果相一致。
4 结论本研究成功鉴定甲状腺激素受体与Drosha蛋白之间存在相互关系,初步探讨甲状腺激素受体与microRNA之间作用的信号通路。
| [1] | Kogai T, Brent GA. Thyroid Hormones(T4, T3)[J]. Endocrinology, 2005 : 267–281. |
| [2] | Zhang Z, Boelen A, Bisschop PH, et al. Hypothalamic effects of thyroid hormone, 2017. doi. org/10.1016/j.mce.2017.01.018 |
| [3] | Oetting A, Yen PM. New insights into thyroid hormone action[J]. Best Practice & Research Clinical Endocrinology & Metabolism, 2017, 21 (2): 193–208. |
| [4] | Power DM, Llewellyn L, Faustino M, et al. Thyroid hormones in growth and development of fish[J]. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp, 2002, 130 (4): 447–59. |
| [5] | 冯绮文, 苏青, 罗敏. 甲状腺激素受体研究进展[J]. 国际内分泌代谢杂志, 2003, 23(1): 44–46. |
| [6] | Puzianowskakuznicka M, Krystyniak A, Madej A, et al. Functionally impaired TR mutants are present in thyroid papillary cancer[J]. Journal of Clinical Endocrinology & Metabolism, 2002, 87 (3): 1120–1128. |
| [7] | Yen PM. Physiological and molecular basis of thyroid hormone action[J]. Physiological Reviews, 2001, 81 (3): 1097–1142. |
| [8] | Satoh T, Katano-Toki A, Tomaru T, et al. Coordinated regulation of transcription and alternative splicing by the thyroid hormone receptor and its associating coregulators[J]. Biochemical & Biophysical Research Communications, 2014, 451 (1): 24–29. |
| [9] | Tata JR. The road to nuclear receptors of thyroid hormone[J]. Biochimica et Biophysica Acta(BBA)-General Subjects, 2013, 1830 (7): 3860–3866. DOI:10.1016/j.bbagen.2012.02.017 |
| [10] | Lin YH, Wu MH, Liao CJ, et al. Repression of microRNA-130b by thyroid hormone enhances cell motility[J]. Journal of Hepatology, 2015, 62 (6): 1328–1340. DOI:10.1016/j.jhep.2014.12.035 |
| [11] | Diniz GP, Takano AP, Barreto-Chaves ML. MiRNA-208a and miRNA-208b are triggered in thyroid hormone-induced cardiac hypertrophy -role of type 1 Angiotensin Ⅱ receptor(AT1R)on miRNA-208a/α-MHC modulation[J]. Molecular & Cellular Endocrinology, 2013, 374 (1-2): 117–124. |
| [12] | Boguslawska J, Piekielko-Witkowska A, Wojcicka A, et al. Regula-tory feedback loop between T3 and microRNAs in renal cancer[J]. Molecular & Cellular Endocrinology, 2014, 384 (1-2): 61–70. |
| [13] | Ameres SL, Zamore PD. Diversifying microRNA sequence and fun-ction[J]. Nature Reviews Molecular Cell Biology, 2013, 14 (8): 475–488. DOI:10.1038/nrm3611 |
| [14] | Ha M, Kim VN. Regulation of microRNA biogenesis[J]. Nature Reviews Molecular Cell Biology, 2014, 15 (8): 509. DOI:10.1038/nrm3838 |
| [15] | Kwon SC, Nguyen TA, Choi YG, et al. Structure of Human DROSHA[J]. Cell, 2015, 164 (1-2): 81. |
| [16] | Lee Y, Ahn C, Han J, et al. The nuclear RNase Ⅲ Drosha initiates microRNA processing[J]. Nature, 2003, 425 (6956): 415. DOI:10.1038/nature01957 |
| [17] | Bernstein E, Caudy AA, Hammond SM, Hannon GJ. Role for a bidentate ribonuclease in the initiation step of RNA interference[J]. Nature, 2001, 409 (6818): 363. DOI:10.1038/35053110 |
| [18] | 张红梅. 牙鲆变态发育中Drosha蛋白与甲状腺激素受体的相互作用及其对microRNA的调控[D]. 上海: 上海海洋大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10264-1015974884.htm |
| [19] | Yamagata K, Fujiyama S, Ito S, et al. RETRACTED: Maturation of MicroRNA is hormonally regulated by a nuclear receptor[J]. Molecular Cell, 2014, 54 (3): 536. |
| [20] | 郭纯. 免疫共沉淀技术的研究进展[J]. 中医药导报, 2007, 13(12): 86–89. DOI:10.3969/j.issn.1672-951X.2007.12.041 |
| [21] | Fan P, Chen Z, Tian P, et al. miRNA biogenesis enzyme Drosha is required for vascular smooth muscle cell survival[J]. PLoS One, 2013, 8 (4): e60888. DOI:10.1371/journal.pone.0060888 |
| [22] | Huang T, Xu D, Zhang X. Characterization of shrimp Drosha in virus infection[J]. Fish & Shellfish Immunology, 2012, 33 (3): 575–581. |
| [23] | Pascual A, Aranda A. Thyroid hormone receptors, cell growth and differentiation[J]. Biochimica et Biophysica Acta(BBA)-General Subjects, 2013, 1830 (7): 3908–3916. DOI:10.1016/j.bbagen.2012.03.012 |





