甘露醇是一种被广泛应用于食品、医药、化工等领域的功能糖醇[1],目前主要的合成方法有天然提取法、化学催化法[2]、以及酶转化法和微生物细胞转化法。前两种方法因产率低、副产物比例高、产物分离纯化困难等因素限制了其在甘露醇生产上的应用;而后两种方法,因细胞内或胞外起关键作用的酶的催化特异性强,使得底物转化为甘露醇的转化率高,且反应条件温和、无山梨醇等副产物产生,产品的收率高[3]。
合成甘露醇的关键酶是甘露醇脱氢酶(Mannitol dehydrogenase,EC:1.1.1.67),它可直接催化底物果糖生成甘露醇,同时需要辅酶NADH或NADPH[4],无论是全细胞合成还是酶法合成,关键是甘露醇脱氢酶的表达活性和催化条件,除此之外,细胞对底物的消耗、辅酶和能量供应的不平衡、产物的分解利用及转运等因素也都会对产量产生影响。因此,构建代谢工程菌合成甘露醇是一个很好的选择,如Gaspar[4]、王小芳[5]等通过对甘露醇脱氢酶过表达,以及对甘露醇分解途径、果糖和辅酶消耗途径的阻断,来实现甘露醇的高效合成。但在构建工程菌时,首先需要对关键酶的功能和催化活性进行分析和评价,选择酶分子量大小合适、在宿主细胞中表达活性高、作用条件温和的酶作为工程菌构建的基因来源。因此,本研究利用大肠杆菌表达来源于氧化葡萄糖酸杆菌的甘露醇脱氢酶,并对酶的活性和转化果糖生成甘露醇的条件进行优化,为进一步在大肠杆菌中构建产甘露醇代谢工程菌奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株氧化葡萄糖酸杆菌(Gluconobacter oxydans),大肠杆菌(Escherichia coli,E.coli)BL21(DE3)、E. coli JM109、克隆表达载体pET-28a(+)、克隆载体pMD19-T simple均为本实验室保存。
1.1.2 培养基山梨醇液体培养基:山梨醇20 g/L;酵母提取物5 g/L;K2HPO4 3 g/L;MgSO4·7H2O 1 g/L;味精1 g/L;固体培养基添加2 g/L琼脂,用于氧化葡萄糖酸杆菌培养,28℃、220 r/min摇床振荡培养。LB液体培养基:蛋白胨10 g/L;酵母提取物5 g/L;氯化钠10 g/L;pH7.0,固体培养基添加2%琼脂,用于大肠杆菌培养,37℃、220 r/min摇床振荡培养。固体和液体培养基在需要时添加卡那霉素(Kanamycin)至终浓度50 mg/L。
1.1.3 试剂异丙基硫代半乳糖苷(IPTG),甲基乙二胺(TEMED)、卡那霉素、还原型辅酶Ⅱ二钠盐(NADPH)、咪唑、二硫苏糖醇(DTT)购自Sigma公司,其余试剂均为国产或进口分析纯;Taq DNA聚合酶、dNTPs、solutionⅠ连接酶、限制性内切酶EcoRⅠ和Hind Ⅲ购自TaKaRa公司;DNA分子量标准、纯化DNA片段的琼脂糖凝胶回收试剂盒、DNA纯化回收试剂盒、质粒快速提取试剂盒和蛋白质分子量标准等均购自上海生物工程有限公司;PCR引物由北京华大基因技术有限公司合成。
1.1.4 主要仪器凝胶成像仪、蛋白电泳仪(美国Bio-Rad公司);Agilent高效液相色谱仪(美国安捷伦公司);超声破碎仪(宁波新艺超声设备有限公司);TU-1810型紫外可见分光光度计(北京普析通用仪器有限责任公司);高速低温离心机(德国Eppendorf公司);HW SY21-K电热恒温水浴锅(江苏国华仪器厂)。
1.2 方法 1.2.1 重组菌株的构建按DNA提取试剂盒(天根生化科技有限公司)操作步骤提取氧化葡萄糖酸杆菌总基因组DNA。质粒的提取方法参考文献[6]所述方法进行。根据GenBank报道的Gluconobacter oxydans 621H中甘露醇脱氢酶基因(mdh)全序列进行引物设计,见表 1。
PCR扩增条件为:95℃ 5 min;94℃ 35 s,57℃ 35 s,72℃ 1.5 min,30个循环;72℃延伸10 min。
用限制酶Eco R Ⅰ和Hind Ⅲ双酶切扩增得到甘露醇脱氢酶基因片段,将得到的酶切片段mdh连接到双酶切后的载体pET-28a(+)上生成表达质粒pET28a-mdh,转化到宿主细胞大肠杆菌E.coli JM109感受态细胞中,通过卡那霉素抗性平板筛选转化子,然后对转化子质粒分别用双酶切法和PCR进行鉴定。
1.2.2 目的蛋白的诱导表达、纯化及SDS-PAGE分析将重组质粒pET28a-mdh转化入表达宿主菌E.coli BL21(DE3)中,同时用载体质粒pET-28a(+)转化入表达宿主菌E.coli BL21(DE3)作为对照。分别挑取单菌落接种到5 mL LB液体培养基中(终浓度50 μg/mL Kan),37℃、220 r/min振荡培养过夜,按2%接种量转接于装有200 mL液体LB培养基的500 mL三角瓶中培养至OD600达到0.8-1.0,加入异丙基硫代半乳糖苷(IPTG)至终浓度为0.5 mmol /L,16℃、160 r/min诱导振荡培养18 h后,4℃、8 000 r/min离心10 min收集菌体,将菌体悬浮于30mL Lysis bufer中超声处理破碎细胞,破碎后12 000 r/min离心30 min,收集上清液。超声条件:工作时间3 s;间歇4 s;共超声30 min;裂解频率55 Hz。将上清液与1 mL镍硅胶4℃结合1-2 h后,加入层析柱中,收集下液,再倒回柱子中,重复3次,然后换收集管,向柱子中加入10 mL DNA Wash buffer洗脱硅胶,换收集管,再用5 mL Elution buffer过柱子,收集到的液体即为纯化后的蛋白。SDS-PAGE分析重组蛋白的纯化结果。分离胶的浓度为12%,浓缩胶的浓度为5%,考马斯亮蓝染色。
1.2.3 酶活的测定甘露醇脱氢酶酶活的测定参见文献[7]所述方法测定。酶活计算公式为:
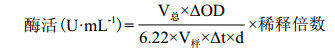
配制pH分别为4.3、4.8、5.3、5.8、6.3和6.8的醋酸钠缓冲液,以20%的果糖为底物,溶解于不同pH的缓冲液,10 mL果糖溶液加酶量100 U,加入NADPH的终浓度为9 mmol/L,置于40℃,150 r/min的水浴摇床,转化30 min,HPLC检测甘露醇的生成量。
1.2.4.2 温度对甘露醇脱氢酶转化果糖生成甘露醇的影响以20%的果糖为底物,加酶量为10 U/mL,加入NADPH的终浓度为9 mmol/L,反应初始pH为5.8,分别在20、30、40、50、60和70℃的水浴摇床150 r/min转化30 min,HPLC检测甘露醇的生成量。
1.2.4.3 底物浓度对甘露醇脱氢酶转化果糖生成甘露醇的影响分别以10%、20%、30%、40%和50%的果糖为底物,加酶量为10 U/mL,加入NADPH的终浓度为9 mmol/L,初始pH为5.8,于40℃,转速为150 r/min的水浴摇床转化30 min,HPLC检测甘露醇的生成量。
1.2.4.4 NADPH对甘露醇脱氢酶转化果糖生成甘露醇的影响以20%的果糖为底物,加酶量为10 U/mL,分别在体系中加入终浓度为3、6、9、12和15 mmol/L的NADPH,反应初始pH5.8,在40℃、150 r/min的水浴摇床转化30 min,HPLC检测甘露醇的生成量。
1.2.5 HPLC检测含量转化后的样品经加热灭活后,12 000 r/min离心10 min,取上清备用。糖的利用率和产物测定使用高效液相色谱法(HPLC)进行分析[8]。糖和甘露醇的测定使用Prevail Carbohydrate ES色谱柱,柱温维持在30℃,流动相为乙腈:水=75:25,以1 mL/min的流速进行洗脱。使用蒸发光检测器进行分析,通过对比保留时间进行定性和定量分析。

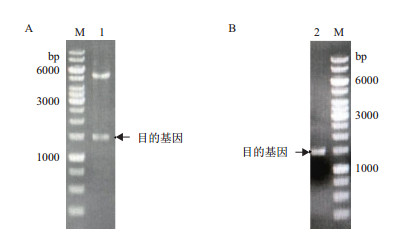
将重组质粒经EcoRⅠ和Hind Ⅲ双酶切鉴定,如图 1-A,小片段为1 500 bp左右的目的基因,大片段为5 500 bp左右的pET-28a(+)载体,PCR验证结果如图 1-B,片段为1 500 bp,大小正确,表明目的基因已插入到pET-28a(+)载体上。
|
| 图 1 重组质粒pET28a-mdh双酶切及PCR验证电泳图 M:1 kb DNA ladder;1:重组质粒的双酶切验证;2:重组质粒的PCR验证 |
将纯化后的蛋白进行SDS-PAGE电泳分析后得到的结果(图 2)可知,蛋白的条带单一,大小为54 kD,与预测一致,纯化效果较好。同时对纯化后的重组酶的酶活进行测定,酶活达到270 U/mL。

|
| 图 2 蛋白纯化的SDS-PAGE分析 M:Protein molecular weight marker;1-2:纯化后的蛋白 |
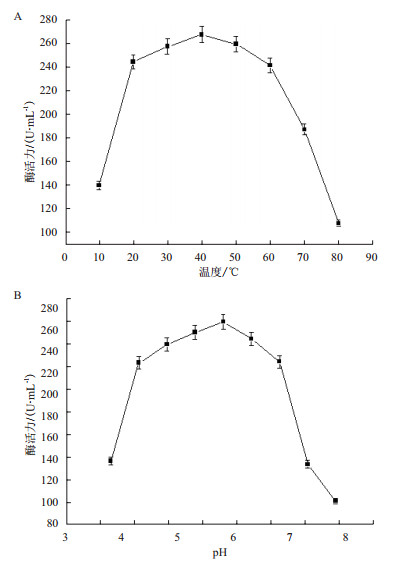
为了有效地选取转化条件的范围,对甘露醇脱氢酶的酶学性质进行了研究。由图 3-A可知,当温度在20-60℃之间时,酶活力较稳定且均较高;当温度低于20℃或高于60℃时,酶活力大幅下降。由图 3-B可知,当pH值在4.3-6.8之间时,酶活力较高且变化趋势较小,而当pH值低于4.3或高于6.8时,酶活力明显大幅下降。因此,得到甘露醇脱氢酶的酶学性质为:温度稳定范围为20℃-60℃,最适温度为40℃;pH稳定范围为4.3-6.8,最适pH5.8。
|
| 图 3 甘露醇脱氢酶的温度和pH稳定性 |
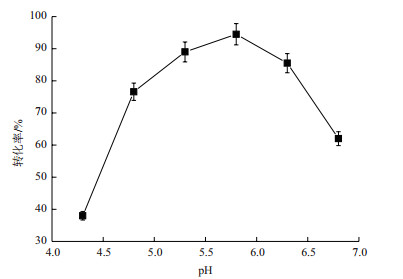
通过不同初始pH条件下进行的甘露醇脱氢酶转化实验,得到的结果如图 4所示,在pH为5.8的时候,甘露醇转化率最高,达到了93.5%。当pH为4.3时,甘露醇的转化率最低,仅为38.5%。pH在4.8-6.3时,甘露醇的转化率均高于75%,pH为6.8时,转化率下降到61.3%,说明了pH偏酸的条件适合酶的转化,酸性和中性条件下都不利于甘露醇的生成。因此反应最适pH选为5.8。
|
| 图 4 初始pH对甘露醇脱氢酶转化的影响 |
在不同温度下进行甘露醇脱氢酶转化果糖合成甘露醇的实验,结果如图 5所示,40℃时,甘露醇转化率达到最大值96%,而随着温度的上升或下降,甘露醇的转化率均下降。故40℃为最适反应温度。

|
| 图 5 反应温度对甘露醇脱氢酶转化的影响 |
在其他条件相同的情况下添加不同浓度的底物,结果如图 6所示。当果糖底物浓度为300 g/L时,转化率可以达到96.7%。果糖浓度小于300 g/L时,甘露醇的转化率随着底物浓度增加而增加。而果糖浓度大于300 g/L时,转化率随底物浓度的增加下降,到500 g/L时下降为87.6%。因此,300 g/L浓度的果糖是最合适的。

|
| 图 6 底物浓度对甘露醇脱氢酶转化的影响 |
NADPH是甘露醇脱氢酶转化果糖生成甘露醇必需的辅酶因子,通过添加不同浓度的NADPH来检测其浓度对转化的影响。结果(图 7)显示,随着NADPH浓度的增加,甘露醇的转化率也随之提高,浓度达到9 mmol/L时,转化率达到最大值为97.4%,之后,随着NADPH浓度的增加转化率基本不变。因此,最佳的NADPH浓度为9 mmol/L。

|
| 图 7 NADPH浓度对甘露醇脱氢酶转化的影响 |
大肠杆菌作为目前研究最透彻的模式生物,其遗传背景、代谢机理清晰,遗传操作方法和培养条件成熟、完善,被认为是用来表达外源蛋白和合成目标产物的最适底盘微生物。王芳[9]、陈艳[6]和程雅韵[10]等利用大肠杆菌分别表达了不同来源的甘露醇脱氢酶,其酶活力均小于20 U/mL,酶活力较低,但利用表达后的酶可以将底物果糖转化为甘露醇。
另外,构建合成甘露醇的大肠杆菌工程菌,除需对酶进行过量表达外,还需考虑辅酶NADH或NADPH[11, 12]的合成和消耗情况。选择NADH依赖型的甘露醇脱氢酶,因细胞内NADH含量低,需要通过额外的NADH再生系统提供辅酶,Reshamwala等[13]、Kaup等[14]通过构建甲酸脱氢酶还原系统,磷酸盐/亚磷酸盐还原系统等来再生NADH;而选用NADPH依赖型的甘露醇脱氢酶,则可通过增强细胞本身的HMP途径而增加NADPH的生成量,如Wasylenko[15]、Papagianni[16]等通过限制EMP途径的碳流量,提高HMP途径的碳流量,从而调控NADPH的生成量,为催化反应提供足够的NADPH。本研究对NADPH依赖型甘露醇脱氢酶进行了表达、纯化并优化了其在体外转化果糖生成甘露醇的转化条件,为之后构建产甘露醇的大肠杆菌代谢工程菌株奠定了基础。
4 结论本研究通过将来源于氧化葡萄糖杆菌的NADPH依赖型甘露醇脱氢酶基因克隆到表达载体pET28a(+)上,构建了重组表达菌株BL21(DE3)/pET28a-mdh,通过IPTG诱导表达后,将目的蛋白进行纯化,并通过聚丙烯酰氨凝胶电泳显示纯化蛋白大小为54 kD,与目的蛋白大小一致,并测得纯化后的酶活为270 U/mL。用纯化后的酶液对甘露醇脱氢酶酶法转化果糖的条件进行了优化,得到最终的优化条件为:最适转化温度为40℃,最适转化pH为5.8,最适底物浓度为300 g/L,最适的NADPH终浓度为9 mmol/L。
| [1] | Saha BC, Racine FM. Biotechnological production of mannitol and its applications[J]. Applied Microbiology and Biotechnology, 2011, 89 (4): 879–891. DOI:10.1007/s00253-010-2979-3 |
| [2] | 应伟丽, 韩晓颖, 李媚, 等. 电化学法合成甘露醇[J]. 广西民族大学学报:自然科学版, 2005, 11(3): 85–87. |
| [3] | 张晓卿. 微生物转化制备甘露醇的研究[D]. 南宁: 广西大学, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10593-2004096651.htm |
| [4] | Gaspar P, Neves AR, Ramos A, et al. Engineering Lactococcus lactis for production of mannitol: high yields from food-grade strains deficient in lactate dehydrogenase and the mannitol transport system[J]. Applied & Environmental Microbiology, 2004, 70 (3): 1466. |
| [5] | 王小芳. 利用代谢工程构建D-甘露醇生产菌株[D]. 天津: 天津科技大学, 2013. http://www.cqvip.com/QK/92387X/201310/47561536.html |
| [6] | 陈艳, 田康明, 李玉, 等. 以蔗糖为底物利用重组大肠杆菌合成甘露醇[J]. 微生物学通报, 2014, 41(11): 2182–2190. |
| [7] | Ortiz ME, Fornaguera MJ, Raya RR, et al. Lactobacillus reuteri CRL 1101 highly produces mannitol from sugarcane molasses as carbon source[J]. Applied Microbiology and Biotechnology, 2012, 95 (1): 991–999. |
| [8] | Saha BC, Racine FM. Effects of pH and corn steep liquor variability on mannitol production by Lactobacillus intermedius NRRL B-3693[J]. Applied Microbiology and Biotechnology, 2010, 87 (2): 553–560. DOI:10.1007/s00253-010-2552-0 |
| [9] | 王芳. 甘露醇发酵及甘露醇脱氢酶的克隆表达[D]. 石家庄: 河北科技大学, 2009. http://d.wanfangdata.com.cn/Thesis/Y1473561 |
| [10] | 程雅韵, 王新, 郑琳, 等. 假肠膜明串珠菌甘露醇脱氢酶基因的克隆及表达[J]. 食品科学, 2016, 37(13): 153–156. DOI:10.7506/spkx1002-6630-201613027 |
| [11] | 林谦. 乳酸细菌甘露醇脱氢酶研究进展[J]. 科技传播, 2010(19): 134–135. |
| [12] | Weckbecker A, Gröger H, Hummel W. Regeneration of nicotinamide coenzymes: principles and applications for the synthesis of chiral compounds[J]. Advances in Biochemical Engineering/Biotechnology, 2010, 120 (120): 195–242. |
| [13] | Reshamwala SM, Pagar SK, Velhal VS, et al. Construction of an efficient Escherichia coli whole-cell biocatalyst for d-mannitol production[J]. Journal of Bioscience & Bioengineering, 2014, 118 (6): 628–631. |
| [14] | Kaup B, Bringer-Meyer S, Sahm H. Metabolic engineering of Escherichia coli: construction of an efficient biocatalyst for D-mannitol formation in a whole-cell biotransformation[J]. Applied Microbiology and Biotechnology, 2016, 68 (2): 235–240. |
| [15] | Wasylenko TM, Ahn WS, Stephanopoulos G. The oxidative pentose phosphate pathway is the primary source of NADPH for lipid overproduction from glucose in Yarrowia lipolytica[J]. Metabolic Engineering, 2015, 30 : 27–39. DOI:10.1016/j.ymben.2015.02.007 |
| [16] | Papagianni M, Legiša M. Increased mannitol production in Lactobacillus reuteri ATCC 55730 production strain with a modified 6-phosphofructo-1-kinase[J]. Journal of Biotechnology, 2014, 181 (10): 20–26. |





