3-羟基丙酸(3-hydroxypropionic acid,3-HP)又名β-羟基丙酸,是一种三碳非手性有机酸,也是一种性质优良的化学中间体,可以用来合成涂料、胶黏剂、水处理化学品、个人护理用品等一批重要的化工产品,具有较高的市场价值和良好的工业应用前景[1]。目前市售的3-HP均由化学合成法制得,如3-羟基丙腈水解法、β-丙内酯水解法、丙烯酸水合法等[2],但化学法使用不可再生资源、副产物多、分离困难、污染严重[3]。相对而言,生物法合成3-HP是以甘油或葡萄糖为底物进行微生物发酵,可以避免化学法所带来的一系列问题,而针对国际市场上甘油过剩的现状,各国学者积极开展以甘油为底物生产3-HP的研究工作。
在以甘油为底物,两步法生产3-羟基丙酸的过程中,涉及到两个关键酶——甘油脱水酶(DhaB)和醛脱氢酶(AldH)。首先,甘油脱水酶在辅酶VB12的参与下将甘油还原为3-羟基丙醛(3-HPA);然后,醛脱氢酶依赖NAD(P)+将3-羟基丙醛转化成3-羟基丙酸。近年来,Rathnasingh等[4-8]学者报道了多种来源的DhaB和AldH,使得3-HP的产量有了大幅度提高,然而仍然存在着AldH活力偏低、需外源添加VB12、辅酶循环再生、3-HPA的累积毒性、产物3-HP积累毒性等问题[9]。而低活力的AldH作为限速步骤,限制了3-HP的产量,因此,寻找新的醛脱氢酶或对其进行定向改造以提高其活性具有重要的研究意义。
本研究对来源于Azospirillam brasilense的新型醛脱氢酶α-酮戊二酸半醛脱氢酶(KGSADH)进行同源建模和结构分析,确定了7个定点突变位点,通过双点突变获得了相对酶活较高的突变酶,并着重考察了突变酶的酶学性质。
1 材料与方法 1.1 材料 1.1.1 菌种α-酮戊二酸半醛脱氢酶(KGSADH)来源为Azospirillam brasilense基因(GenBank:AB241137),并成功构建E. coli BL21/pET-28b-kgsadh(菌种编号ZJB 12043);E. coli BL21(DE3)为实验室保藏。
1.1.2 LB培养基(g/L)蛋白胨10,酵母粉5,NaCl 10。固体培养基补加20 g/L琼脂粉。
1.1.3 主要工具酶和试剂DpnⅠ限制性内切酶、Primer start聚合酶购自TaKaRa公司;质粒提取试剂盒购自爱思进生物技术有限公司;异丙基-β-D-硫代半乳糖吡喃糖苷(Isopropyl β-D-1-thiogalactopyranoside,IPTG)、卡那霉素(Kanamycin,Kan)购于生工生物工程(上海)股份有限公司;烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD+)购于北京经科宏达生物有限公司;Unstained Protein Ladder、2×Unstained Prot Loading Buffer购于上海博彩生物科技有限公司;Profinity IMAC Ni-Charged Resin购于美国伯乐(BIO-RAD)公司;酵母粉、蛋白胨购自OXOID公司。
1.2 方法 1.2.1 定点突变通过一步反向PCR法扩增拟突变KGSADH氨基酸位点的质粒,然后用DpnⅠ将质粒进行去甲基化,热击法转化入E. coli BL21(DE3)中,筛选出重组菌落,提取质粒进行序列测定。
1.2.2 菌株的诱导表达将过夜活化的突变菌株转接入LB培养基中,接种量体积分数为2%,37℃培养至菌体浓度OD600为0.6-0.8,添加浓度为0.1 mmol /L IPTG进行诱导表达,28℃诱导10 h,离心收集菌体备用。
1.2.3 KGSADH酶活的测定吸取50 μL 0.1 mol /L Tris-HCl(pH8.0)、50 μL体积分数1%的乙醛、50 μL 0.1 mol /L KCl、50 μL酶液(根据需要进行一定的稀释)于96孔板,37℃保温1 min,加入50 μL 5 mmol /L NAD+,340 nm测1 min内NAD+的动态变化值,定义每分钟产生1 μmol NADH所用的酶蛋白量为1 U。
1.2.4 KGSADH纯酶的制备将1.2.2离心收集到的菌体用pH8.0 Tris-HCl缓冲液重悬后进行超声破碎,破碎液离心10 min,取上清获得粗酶液。粗酶液通过Ni-NTA柱分离纯化获得蛋白,将上述蛋白移于透析袋(截留分子量14 kD),一起放置于0.1 mol /L Tris-HCl(pH8.0)缓冲液中,0℃透析过夜,获得的酶液进行后续研究。
1.2.5 KGSADH酶学性质的考察最适反应温度:分别在不同反应温度下测定KGSADH酶活。(1)热稳定性:将酶液分别保温在不同温度下,每隔一段时间取样测残余酶活。最适反应pH:分别在不同pH条件下测定KGSADH酶活。(2)pH稳定性:将酶液分别保温在不同pH条件下,每隔一段时间取样测残余酶活。(3)金属离子的影响:反应体系中分别添加2 mmol /L的金属离子,测定KGSADH酶活。酶促反应动力学:改变酶反应体系中乙醛的浓度,测定KGSADH酶活;选取10-200 mmol/L乙醛浓度绘制动力学曲线,根据双倒数作图法,求出Km和Vmax。
2 结果 2.1 KGSADH突变酶的获得根据KGSADH氨基酸序列从PDB数据库中查找到相似性为40%的3JZ4(PDB ID),利用软件modoller 9.12同源建模,三维结构见图 1。参考软件Swiss-PDBV4.10对三维结构的分析以及PoPMuSIC 2.0对各个氨基酸突变后的能量变化,选取能量降低明显的7个氨基酸位点进行突变(表 1),其中120E、163K、219P为保守区域位点,177K为辅酶结合附近位点,225K、252E、278K为活性中心附近位点。

|
| 图 1 KGSADH同源建模三维结构图 |
以pET-28b-kgsadh为模板,通过一步反向PCR扩增完成7个位点突变。测取的比酶活,结果(图 2)显示,252E、278K位点突变使KGSADH完全失活,E120D、K177R、P219A位点有较大提高,经过叠加突变,突变酶TU-KGSADH(E120D/P219A)酶活力达6.03 U/mg,比原始酶比酶活提高了322 %,且通过测序分析,确定突变位点与设计的目标位点一致。后续以菌株E.coli BL21/pET-28b-kgsadh(E120D/P219A)(菌种编号ZJB15026)为目标菌株进行考察。

|
| 图 2 KGSADH突变酶的比酶活 |
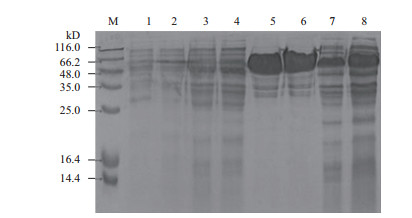
原始菌株ZJB12043和突变菌株ZJB15026经过发酵处理之后获得的粗酶液,经SDS-PAGE电泳(图 3泳道7和泳道8),与对照组E. coli BL21(泳道1)、E. coli BL21/pET-28b(泳道2)和未诱导(泳道3,4)的电泳图比较,泳道7和8在48-65.2 kD之间有大量的可溶异源蛋白表达,这和KGSADH的预测分子量50.8 kD基本一致。经检测酶活,表明KGSADH正确表达。
|
| 图 3 ZJB12043和ZJB15026的表达与纯化的SDS-PAGE分析 M:蛋白Marker;1:E. coli BL21;2:E. coli BL21/pET-28b;3:未诱导ZJB12043;4:未诱导的ZJB15026;5:ZJB12043纯酶;6:ZJB15026纯酶;7:ZJB12043粗酶液;8:ZJB15026粗酶液 |
KGSADH带有6个His组成的“标签”,故利用Ni-NTA琼脂糖作为亲和介质,组氨酸与Ni2+之间形成配位相互作用,选择性地将KGSADH吸附在Ni柱上,再用不同浓度咪唑进行洗脱,最终分离纯化出KGSADH。ZJB12043、ZJB15026纯化酶的SDS-PAGE电泳结果见图 3,泳道5和泳道6仅带有少许杂蛋白条带,其纯度已满足后续实验要求。
2.4 KGSADH突变前后的酶学性质 2.4.1 最适温度及热稳定性由表 2可以看出,原始KGSADH最适温度为35℃,而突变KGSADH最适温度降为30℃。为进一步研究酶的热稳定性变化,实验以0 h酶活为基准,分别考察了40℃、50℃酶的稳定性。从图 4可以看出,40℃分别保温3 h和7 h,原始KGSDAH剩余酶活分别是96.3%和89.6%,突变KGSDAH剩余酶活分别是86.1%和58.8%。50℃保温7 h,原始KGSDAH剩余酶活是84.8%,而突变KGSDAH剩余酶活是47.4%。表明突变后KGSADH的热稳定性降低。

|
| 图 4 原始和突变KGSADH的热稳定性 1:40℃保温3 h;2:40℃保温7 h;3:50℃保温3 h;4:50℃保温7 h |
如图 5所示,原始KGSADH最适pH在8.5,突变KGSADH最适pH在8.0。与原始KGSADH相比,突变KGSADH在pH 6.0-8.0下的酶活显著增加。将原始酶与突变酶置于不同pH缓冲液中,20 h后取样测定KGSADH活性。从图 6可以看出,原始酶的pH稳定性较好,当pH≥6.0时,其相对酶活仍保持在85%以上,而突变KGSADH在pH 6.0-8.0条件下,酶活保留在85%以上,在pH 8.0-9.0条件下,KGSADH的稳定性显著下降。

|
| 图 5 pH对原始和突变KGSADH酶活力的影响 |

|
| 图 6 原始和突变KGSADH的pH稳定性 |
由于KGSADH具有金属离子中心,因此部分金属离子和表面活性剂会对KGSADH的酶活与催化能力产生一定的影响。实验考察了金属离子Cu2+、Cu+、Co2+、Ni2+、Mn2+、Ca2+、Mg2+、Ba2+、Zn2+、Fe3+、Fe2+和表面活性剂EDTA对KGSADH酶活的影响。从表 2中可以看出,突变前后金属离子对KGSADH酶活的影响变化不大。Zn2+对KGSADH的酶活有较强的抑制作用,而Co2+、Fe3+、Fe2+对KGSADH的酶活有较大的激活作用。在酶的动力学方面,KGSADH对乙醛的Km为7.58 mmol/L,Vmax为10.6 U/mg。突变KGSADH对乙醛的Km为6.28 mmol/L,Vmax为12.3 U/mg。突变后KGSADH的Km值降低且Vmax有所升高,说明突变后酶对底物的亲和力增加。
3 讨论Díaz Sánchez等[10]初步推测了醛脱氢酶的两步法催化机制:酰化作用和脱酰作用,并指出其可能的活性中心是286位Cys。本实验通过对活性中心附近位点252E、278K突变,发现KGSADH完全失活,这与Díaz Sánchez推测的活性中心相符。
通过酶学性质的分析与比较,TU-KGSADH的最适pH由8.5降为8.0,酶活在pH 6.0-8.0条件下有所提高,这与刘清利[11]、周百灵[12]、蒋宇[13]发现不同乙醛脱氢酶最适pH均在7.0-8.0相符。利用AutoDock软件以3-HPA为配体对KGSADH突变前后进行分子对接(图 7),发现突变位点E120D、P219A与活性中心286 Cys没有形成氢键的能力,但是E120D突变使肽链走向改变,使159Asn与3-HPA距离小于0.30 nm形成氢键,进而增强活性中心附近催化残基的氢键作用,使酶催化能力升高。这可能就是突变KGSADH酶活力升高的原因。在偏酸的环境下活性中心附近催化残基的氢键作用减弱,使酶催化能力降低,而突变KGSADH活性中心附近的氢键作用强于原酶,在酸性条件下的酶活性相对更高,这就解释了突变酶的最适pH下降和pH稳定性向酸性偏移的现象。

|
| 图 7 3-HPA与原始(A)和突变KGSADH(B)活性中心分子对接 |
TU-KGSADH的最适温度由35℃降低为30℃,热稳定性降低,而酶的热稳定性与盐桥的形成、二硫键的引入、脯氨酸的含量及芳香族氨基酸的相互作用等因素有关[14]。据统计,耐热性的蛋白中脯氨酸的含量比耐中温蛋白高40%-50%,而嗜冷蛋白中脯氨酸的含量明显低于耐中温蛋白[15],尤其脯氨酸残基位于α-helix的第一位和β-turn的第2位上时,脯氨酸残基的刚性结构对蛋白质的热稳定性有较大的贡献[16]。将KGSADH α-helix结构中219位脯氨酸突变为丙氨酸,破坏了脯氨酸残基的刚性结构,这可能是突变酶最适温度和热稳定性降低的原因。
4 结论本研究对来源于Azospirillam brasilense α-酮戊二酸半醛脱氢酶(KGSADH)基因同源建模和结构分析,采用定点突变方法得到高活力突变酶TU-KGSADH(E120D/P219A),并对该酶诱导表达、分离纯化,随后探讨了KGSADH突变前后酶学性质的变化。结果表明TU-KGSADH的最适温度由35℃降低为30℃,且热稳定性降低,最适pH为8.0,在pH 6.0-8.0条件下酶活有所提高。Co2+、Fe3+、Fe2+对酶活具有促进作用,而Zn2+对酶活具有较强的抑制作用。突变KGSADH酶对乙醛的Km由7.58降为6.28 mmol/L,Vmax由10.6提高为12.3 U/mg。对酶学性质改变的可能因素分析发现,120位突变与最适pH下降和pH稳定性向酸性偏移有关,219位突变可能是最适温度和热稳定性降低的原因,突变降低了酶的热稳定性,但增强酶对产物3-HP的耐受力。
| [1] | 牛坤, 张志伟, 柳志强, 等. 3-羟基丙酸分批发酵过程中的pH控制策略研究[J]. 工业微生物, 2013, 43(6): 1–6. |
| [2] | 温丽瑗, 陈小平, 郎春燕. 3-羟基丙酸合成途径研究进展[J]. 天然气化工, 2012, 37(4): 62–67. |
| [3] | 程嫚, 罗晖, 常雁红, 等. 微生物产3-羟基丙酸研究进展[J]. 化学与生物工程, 2012, 29(11): 9–12. DOI:10.3969/j.issn.1672-5425.2012.11.003 |
| [4] | Rathnasingh C, Raj SM, Jo JE, et al. Development and evaluation of efficient recombinant Escherichia coli strains for the production of 3-hydroxypropionic acid from glycerol[J]. Biotechnology and Bioengineering, 2009, 104 (4): 729–739. |
| [5] | Kim K, Kim SK, Park YC, et al. Enhanced production of 3-hydroxypropionic acid from glycerol by modulation of glycerol metabolism in recombinant Escherichia coli[J]. Bioresource Technology, 2014, 156 (0): 170–175. |
| [6] | Huang Y, Li Z, Shimizu K, et al. Co-production of 3-hydroxypropionic acid and 1, 3-propanediol by Klebseilla pneumoniae expressing aldH under microaerobic conditions[J]. Bioresource Technology, 2013, 128 : 505–512. DOI:10.1016/j.biortech.2012.10.143 |
| [7] | Ashok S, Sankaranarayanan M, Ko Y, et al. Production of 3-hydroxy-propionic acid from glycerol by recombinant Klebsiella pneumoniae ΔdhaT ΔyqhD which can produce vitamin B12 naturally[J]. Biotechnology and Bioengineering, 2013, 110 (2): 511–524. DOI:10.1002/bit.24726 |
| [8] | Chu HS, Young SK, Chan ML, et al. Metabolic engineering of 3-hydroxypropionic acid biosynthesis in Escherichia coli[J]. Biotechnology and Bioengineering, 2015, 112 (2): 356–364. DOI:10.1002/bit.v112.2 |
| [9] | 牛坤, 秦海彬, 柳志强, 等. 甘油发酵生产3-羟基丙酸的代谢改造工程菌研究进展[J]. 食品与发酵工业, 2015, 41(6): 234–240. |
| [10] | Díaz Sánchez áG, González SL, Rudi?o PE, et al. Novel NADPH-cysteine covalent adduct found in the active site of an aldehyde dehydrogenase[J]. Biochemical Journal, 2011, 439 (3): 443–452. DOI:10.1042/BJ20110376 |
| [11] | 刘清利, 杨国武, 郭蔼光, 等. 乙醛脱氢酶高产菌株Z07-J01的选育与酶学特性[J]. 西北农业学报, 2006, 15(5): 251–254. |
| [12] | 周百灵, 高秀峰, 吴晓婷, 等. 酿酒酵母胞浆中乙醛脱氢酶的提取和研究[J]. 酿酒科技, 2009(6): 28–30. |
| [13] | 蒋宇, 邵蔚蓝. 嗜热厌氧乙醇杆菌组氨酸融合双活性乙醇脱氢酶的克隆, 表达和酶学性质[J]. 食品与生物技术学报, 2006, 25(5): 15–19. |
| [14] | 杨浩萌, 姚斌, 范云六. 木聚糖酶分子结构与重要酶学性质关系的研究进展[J]. 生物工程学报, 2005, 21(1): 6–11. |
| [15] | 杨浩萌, 柏映国, 李江, 等. 木聚糖酶XYNB的N46D突变、表达及酶学性质变化[J]. 中国生物化学与分子生物学报, 2006, 22(3): 31–31. |
| [16] | Watanabe K, Masuda T, Ohashi H, et al. Multiple proline substitutions cumulatively thermostabilize Bacillus cereus ATCC7064 oligo-1, 6-glucosidase. Irrefragable proof supporting the proline rule[J]. European Journal of Biochemistry, 1994, 226 (2): 277–83. DOI:10.1111/ejb.1994.226.issue-2 |






