利福霉素是一类由地中海拟无枝酸菌(Amycolatopsis mediterranei)产生的重要安莎类抗生素,主要用于治疗肺结核和其他分枝菌酸感染引起的疾病,如麻风和艾滋病等[1-3]。利福霉素可以特异性地抑制依赖于DNA的RNA聚合酶的活性,使病原菌不能正常合成RNA产物,从而达到抑菌目的[4]。地中海拟无枝酸菌发酵得到的利福霉素是由利福霉素A、B、C、D、SV等多种组分构成的,其中利福霉素SV是利福平、利福喷丁等利福霉素类药物的直接合成前体[5-7]。
地中海拟无枝酸菌作为利福霉素的生产菌,长期以来主要以诱变育种为主,Pietro等[8]通过传统NTG诱变—筛选的方法得到了利福霉素B的高产菌株A. mediterranei HP-130,金玉坤等[9]利用UV诱变再经L-色氨酸、氯化铯等类似物作耐受处理,使利福霉素SV的产量提高10%左右。但这种化学或物理的诱变方法具有诱变方向难以掌握,突变体难以集中多个理想性状、筛选工作量大等局限性。此外,Priscila等[10]通过构建携带血红蛋白基因vgb的地中海拟无枝酸菌-大肠杆菌穿梭载体,在地中海拟无枝酸菌中过表达了透明颤菌(Vitreoscilla stercoraria)的vgb基因,使利福霉素B的产量提高了13.9%,但其发酵过程中必须添加抗生素,才能保持工程菌中质粒的稳定性。目前,我国主要以发酵利福霉素SV为主,发酵单位较低,生产水平在5 000 U/mL左右[11]。
赵维等[12]于2010年对A. mediterranei进行了全基因组序列测定和注释,明确了利福霉素SV生物合成及前体供给的途径。丙二酰CoA和甲基丙二酰CoA在3-氨基-5-羟基苯甲酸(AHBA)的基础上经过缩合、环化和后修饰而形成利福霉素SV。而丙二酰CoA既是脂肪酸生物合成的前体,又是利福霉素生物合成的前体。因此,本研究利用融合PCR构建S-丙二酰转移酶基因的同源重组载体,将脂肪酸合成途径中的S-丙二酰转移酶基因fabD进行失活,弱化脂肪酸的合成,旨在而提高利福霉素SV的产量。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒地中海拟无枝酸菌(A. mediterranei,由河北欣港药业有限公司提供),大肠杆菌(E. coli)DH5α,质粒pUC19和pSET152均由本实验室保存。
1.1.2 试剂高保真的DNA聚合酶、T4连接酶由谦泰生物技术有限公司提供,PCR纯化试剂盒购自Axygen公司,限制性内切酶购自大连宝生物工程有限公司。Trizol试剂盒购自Invitrogen公司,M-MLV反转录试剂盒购自TaKaRa公司,氨苄青霉素和安普霉素购自Sbase公司。引物由金唯智生物科技有限公司合成(表 1)。
葡萄糖1.5%,黄豆饼粉1.0%,蛋白胨1.0%,KNO3 0.05%,CaCO3 0.1%,KH2PO4 0.01%,淀粉1.5%,pH7.0。
1.1.3.2 发酵培养基葡萄糖10%,黄豆饼粉1.0%,鱼粉0.5%,蛋白胨1.0%,KNO3 0.8%,CaCO3 0.3%,KH2PO4 0.02%,CoCl2 0.0003%。
1.1.3.3 培养大肠杆菌用LB培养基培养,培养温度为37℃;制备地中海拟无枝酸菌的电击感受态细胞时用YEME,地中海拟无枝酸菌电击转化后的孵育及筛选用本氏培养基,培养温度为28℃。
1.2 方法 1.2.1 S-丙二酰转移酶基因部分序列的克隆用改进的Vingataramin等[13]方法提取地中海拟无枝酸菌的染色体DNA作模板,以Fabd-F/R为引物,PCR扩增了S-丙二酰转移酶基因fabD(3.8 kb),连接到pUC19上,命名为pUC19-fabd。
1.2.2 fabD基因的同源重组载体构建以融合PCR扩增中间为抗性标记基因、两侧为左右同源臂的DNA片段,连接到pUC19而构建fabD基因的同源重组载体pUC19-fabdF-apr-fabdR。
第一轮PCR(常规PCR):以pUC19-fabd为模板,以ZF/ZR为引物,扩增为710 bp的左同源臂fabD-F,反应条件为:98℃ 3 min;98℃ 30 s,58℃ 30 s,72℃ 22 s,30个循环;72℃ 10 min。以YF/YR为引物,扩增为1 170 bp的右同源臂fabD-R,反应条件为:98℃ 3min;98℃ 30 s,58℃ 30 s,72℃ 36 s,30个循环;72℃ 10 min。以质粒pSET152为模板,以APR-F/R为引物,扩增出长度为1 200 bp的安普霉素抗性基因AprR。反应条件为:98℃ 3 min;98℃ 30 s,57℃ 30 s,72℃ 36 s,30个循环;72℃ 10 min。
第二轮PCR(融合PCR):探索融合PCR反应的条件,最终以3种第一轮PCR产物作模板各取0.5 µL,添加3%的DMSO,不加任何引物进行扩增,其原理是利用扩增片段末端的反向互补序列进行自身退火并结合,使安普霉素抗性基因两侧与fabD基因的左右同源臂相连,反应条件为:98℃ 3 min;98℃ 30 s,47℃ 30 s,72℃ 93 s,10个循环。
第三轮PCR:以第二轮的PCR产物作为模板,以ZF/YR为引物,扩增3 044 bp的融合DNA片段,反应条件为:98℃ 3 min;98℃ 30 s,59℃ 30 s,72℃ 93 s,30个循环;72℃ 10 min。
1.2.3 地中海拟无枝酸菌的电击转化采用樊菲等[14]的方法将同源重组载体pUC19-fabdF-apr-fabdR导入到地中海拟无枝酸菌中,涂布于含安普霉素抗性的平板,7-10 d后挑取转化子进行验证。
1.2.4 突变菌株的验证将疑似菌株传代培养5次,以Verify-F/R为引物,提取染色体DNA进行PCR验证。以原始菌株与疑似菌株RNA反转录得到的cDNA作为模板,以Test-F/R(设计在突变体中被替换掉的区域)为引物,进行RT-PCR验证。以16S rRNA为管家基因,用相对定量2-ΔΔCT法计算fabD基因在突变菌株与原始菌株之间的相对表达水平[15],重复3次。
1.2.5 发酵将A. mediterranei突变菌株与原始菌株分别接种于装有10 mL种子培养基的100 mL三角瓶中,220 r/min振摇培养48 h后,以10%的接种量接种于装有20 mL发酵培养基的100 mL三角瓶中,发酵136 h后离心去除菌体,上清液按照改进的文献[16]方法进行HPLC检测利福霉素SV的产量。
2 结果 2.1 构建同源重组载体pUC19-fabdF-apr-fabdR第1轮PCR扩增得到了预期长度为710 bp的fabD基因左同源臂、1 170 bp的fabD基因右同源臂和1 200 bp的安普霉素抗性基因表达盒(图 1-A,图 1-B)。
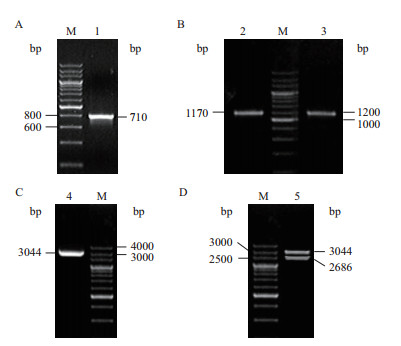
|
| 图 1 重组载体pUC19-fabdF-apr-fabdR的构建与验证 M:200 bp Ladder Marker;1:fabD左同源臂;2:fabD右同源臂;3:安普抗性基因(AprR);4:融合PCR产物;5:pUC19-fabdF-apr-fabdR的酶切产物 |
第2轮PCR通过3个第1轮PCR产物末端的反向互补序列相互退火结合,构建成安普霉素抗性基因表达盒两端分别连接有fabD基因左、右同源臂的DNA融合体。但是此时该融合体的量比较少,经过第3轮PCR特异性地扩增,成功得到了预期为3 044 bp的fabD同源重组片段(图 1-C)。
将融合PCR产物连接到pUC19上,重组载体经EcoR Ⅰ酶切验证。结果(图 1-D)显示,重组载体酶切得到了预期为2 686 bp的线性pUC19和3 044 bp的融合PCR片段。重组载体测序结果表明,同源重组片段基因与预期结果一致。
2.2 fabD基因失活突变菌株的验证以染色体DNA为模板进行的PCR验证,结果(图 2)显示,以Verify-F/R作为引物,与预期的结果一样,原始菌株染色体DNA扩增的是预期1.2 kb的DNA片段,fabD失活的突变菌株染色体DNA扩增的是1.85 kb DNA片段(目的失活片段的相对位置见图 3,设计PCR验证引物时左右同源臂之间缺失550 bp片段)。

|
| 图 2 A.mediterranei △fabD菌株的PCR验证电泳图 M:200 bp Ladder Marker;1:A.mediterranei △fabD;2:A. mediterranei |

|
| 图 3 目的基因失活片段和引物的相对位置 |
为了进一步验证fabD基因的失活,提取原始菌株和突变菌株的总RNA,以反转录得到的cDNA为模板,Test-F/R为引物,进行RT-PCR。以16S rRNA为管家基因,用相对定量2-ΔΔCT法计算fabD基因在突变菌株与原始菌株之间的相对表达水平,其结果如图 4。设定原始菌株的表达量为1,由定量PCR结果可知,在突变菌株A. mediterranei △fabD中,fabD的表达量极少,证明了fabD基因功能被破坏。

|
| 图 4 原始菌株与突变菌株fabD基因的相对表达量 |
突变菌和原始菌发酵液中利福霉素含量的HPLC检测结果,见图 5。原始菌株发酵液中利福霉素SV平均含量为152.88 mg/L,突变菌株发酵液中利福霉素SV含量为168.08 mg/L。与原始菌株相比,突变菌株利福霉素SV的产量增加了9.94%。

|
| 图 5 原始菌株与突变菌株发酵液的HPLC检测结果 |
基因失活能够有目的地缺失染色体DNA序列的部分片段,是最直接、最有说服力的遗传育种手段之一。融合PCR技术[17]是根据PCR技术的原理和特点,采用具有互补末端的引物扩增目的片段,使扩增片段相互搭桥、拼接的一种方法。与传统方法相比,融合PCR构建同源重组载体进行基因失活,过程快捷、简便、成本低廉并且克服了常规的酶切连接中对于酶切位点的选择限制的缺点[18]。目前,融合PCR技术已成为基因失活同源重组载体构建的的常用方法,刘小利等[19]采用融合PCR构建了亲水蛋白Dlp基因同源重组载体,获得了耐辐射异常球菌(Deinococcus radiodurans)dlp基因缺失的突变株;娄菲等[20]利用两步融合PCR技术构建了大肠杆菌(Escherichia coli)苹果酸酶基因(macA和macB)的失活同源重组载体,获得的突变株苹果酸产量提高了36%。
鉴于fabD基因有较多的常用内切酶识别序列,本研究利用一步融合法将3个片段(fabD左同源臂、安普霉素抗性基因及fabD右同源臂)进行了无缝拼接并对融合PCR条件进行了优化,构建了fabD基因失活同源重组载体。因地中海拟无枝酸菌染色体的GC含量较高,选用适当的PCR缓冲液添加适量的DMSO进行目的片段的扩增,例如融合PCR模板GC含量为60%-70%时加3% DMSO、GC含量大于70%时加5% DMSO;采用高保真DNA聚合酶进行融合PCR避免造成突变。为验证融合PCR的准确性,对目的片段进行了测序,结果未发现碱基的插入、突变及缺失,表明获得的同源重组载体可以用于后续的研究。
由fabD编码合成的S-丙二酰转移酶将丙二酰CoA的酰基转移到酰基载体蛋白(ACP),形成丙二酰ACP和游离CoA-SH,是脂肪酸途径FASII系统中关键的蛋白酶之一[21]。众所周知,大环内酯抗生素、脂肪酸以及利福霉素的脂肪环链部分都是通过丙二酰CoA等逐步缩合而成的[22]。本研究利用同源重组的方法失活了脂肪酸途径中S-丙二酰转移酶基因fabD,得到的突变菌株与原始菌株生长状态无明显差异,但该基因的破坏可能遏制了脂肪酸的合成,导致丙二酰CoA向脂肪酸的转化量减少,从而使合成脂肪酸的代谢流转向利福霉素环桥链的合成前体丙二酰CoA,增强了利福霉素SV的代谢合成,提高了利福霉素的产量。
地中海拟无枝酸菌中利福霉素SV生物合成的前体物质除丙二酰CoA外,还有AHBA和甲基丙二酰CoA[23]。樊菲等[24]为消除芳香族氨基酸对AHBA的反馈抑制作用,失活了莽草酸途径中合成芳香族氨基酸的分支菌酸基因aroC。本研究为降低脂肪酸对丙二酰CoA合成的抑制作用,失活了脂肪酸合成途径的关键酶(S-丙二酰转移酶)基因fabD,获得的突变菌株利福霉素SV的发酵单位达到了168.08 mg/L,比樊菲等改造的A. mediterranei △aroC菌株利福霉素SV的含量提高了13%左右。另外,地中海拟无枝酸菌的染色体基因组中存在2个拷贝的S-丙二酰转移酶基因(AMED_2102和AMED_3155)[25],本研究只失活了其中一个拷贝(AMED_3155)。
4 结论本文采用高保真DNA聚合酶,高GC含量的PCR缓冲液,添加3%的DMSO,模板量比例为1:1:1,最佳退火温度为47℃进行融合PCR,构建了S-丙二酰转移酶基因的重组载体。利用同源重组成功得到了地中海拟无枝酸菌S-丙二酰转移酶基因失活菌株,利福霉素SV产量相比原始菌株增加了9.94%。
| [1] | Floss HG, Yu TW. Rifamycin mode of action, resistance, and biosynthesis[J]. Chem Rev, 2005, 105 (2): 621–632. DOI:10.1021/cr030112j |
| [2] | 罗忠枚, 夏小冬, 崔玉彬, 等. 利福霉素类抗生素及其构效关系研究进展[J]. 中国抗生素杂志, 2012, 34(4): 308–319. |
| [3] | 张静霞, 王欣瑜, 唐克慧. 利福霉素类抗生素分析方法研究进展[J]. 中国抗生素杂志, 2009, 34(10): 588–592. |
| [4] | Birner J, Hodgson PR, Lane WR, et al. An Australian isolate of Nocardia mediterranea producing rifamycin SV[J]. J Antibiot, 1972, 25 (6): 356–359. DOI:10.7164/antibiotics.25.356 |
| [5] | Kohanski MA, Dwyer DJ, Collins JJ. How antibiotics kill bacteria: from targets to networks[J]. Nat Rev Microbiol, 2010, 8 (6): 423–435. DOI:10.1038/nrmicro2333 |
| [6] | 王延涛, 李爽, 夏玉朝, 等. 利福霉素的研究新进展[J]. 当代医学, 2016, 22(6): 16–17. |
| [7] | 杜吉泉, 王军峰, 储炬, 等. 甘油对利福霉素SV生物合成的影响[J]. 微生物学通报, 2006, 33(6): 34–38. |
| [8] | Peano C, Damiano F, Forcato M, et al. Comparative genomics revealed key molecular targets to rapidly convert a reference rifamycin-producing bacterial strain into an overproducer by genetic engineering[J]. Metab Eng, 2014, 26 : 1–16. DOI:10.1016/j.ymben.2014.08.001 |
| [9] | 金玉坤, 熊宗贵, 白秀峰. 利福霉素产生菌的推理选育[J]. 中国抗生素杂志, 1991, 16(4): 214–245. |
| [10] | Priscila G, Fernández FJ, Absalón AE, et al. Expression of the bacterial hemoglobin gene from Vitreoscilla stercoraria increases rifamycin B production in Amycolatopsis mediterranei[J]. J Biosci Bioeng, 2008, 106 (5): 493–497. DOI:10.1263/jbb.106.493 |
| [11] | 郑璞, 王蕾, 史朝辉. 地中海拟无枝酸菌原生质体电融合及其在提高利福霉素SV发酵效价中的应用[J]. 中国抗生素杂志, 2002, 27(5): 267–269. |
| [12] | Zhao W, Zhong Y, Yuan H, et al. Complete genome sequence of the rifamycin SV-producing Amycolatopsis mediterranei U32 revealed its genetic characteristics in phylogeny and metabolism[J]. Cell Res, 2010, 20 (10): 1096–1108. DOI:10.1038/cr.2010.87 |
| [13] | Vingataramin L, Frost EH. A single protocol for extraction of gDNA from bacteria and yeast[J]. Biotechniques, 2015, 58 (3): 120–125. |
| [14] | 樊菲, 成文玉, 金红星. 产利福霉素地中海拟无枝酸菌的电转化条件优化[J]. 中国抗生素杂志, 2015, 40(8): 575–578. |
| [15] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT Method[J]. Methods, 2001, 25 (4): 402–408. DOI:10.1006/meth.2001.1262 |
| [16] | 刘英, 张磊, 崔春英, 等. 高效液相色谱法测定利福霉素钠含量与有关物质[J]. 中国抗生素杂志, 2005, 30(2): 84–87. |
| [17] | 陈国梁, 白兴俊, 赵蓉, 等. PCR构建融合基因方法的建立[J]. 生物技术通报, 2010(8): 209–213. |
| [18] | 邝翡婷, 袁定阳, 李莉, 等. 一种载体构建的新方法:重组融合PCR法[J]. 基因组学与应用生物学, 2012(6): 634–639. |
| [19] | 刘小利, 江世杰, 薛冬, 等. 耐辐射异常球菌dlp基因缺失突变株构建及其生物学功能研究[J]. 生物技术通报, 2017(2): 155–163. |
| [20] | 娄菲, 果士婷, 赵玉姣, 等. 过表达羧化途径及失活苹果酸酶基因对大肠杆菌好氧发酵产苹果酸的影响[J]. 生物工程学报, 2016(11): 1539–1548. |
| [21] | Marcella AM, Barb AW. A rapid fluorometric assay for the S-malonyltransacylase FabD and other sulfhydryl utilizing enzymes[J]. J Biol Methods, 2016, 3 (4): e53. DOI:10.14440/jbm.2016.144 |
| [22] | Chen S, Wu Q, Shen Q, et al. Progress in understanding the genetic information and biosynthetic pathways behind Amycolatopsis antibiotics, with implications for the continued discovery of novel drugs[J]. Chem Bio Chem, 2016, 17 (2): 119–128. DOI:10.1002/cbic.v17.2 |
| [23] | 邵志会, 赵维, 赵国屏, 等. 地中海拟无枝酸菌"硝酸盐效应"的研究进展[J]. 生物工程学报, 2015, 31(6): 845–856. |
| [24] | 樊菲. 地中海拟无枝酸菌分支酸合酶基因失活的研究[D]. 天津: 河北工业大学, 2015. http://d.g.wanfangdata.com.cn/Thesis_D820507.aspx |
| [25] | Kumari R, Singh P, Lal R. Genetics and genomics of the genus amycolatopsis[J]. Indian J Med Microbi, 2016, 56 (3): 233–246. DOI:10.1007/s12088-016-0590-8 |





