随着设施农业的快速发展,连作及大量使用化肥农药,使设施土壤养分失衡,土壤酸化,土传病害频繁发生,严重制约了设施生产的可持续发展[1]。目前,主要通过生物、农业和工程三种调控措施进行设施土壤的改良。在生物途径中,有益微生物通过各种间接或直接的方式抑制植物病原菌繁殖,减轻土传病害的发生,缓解连作障碍等设施土壤质量问题[2]。针对设施生产中土壤修复、植病防控已有多种应用微生物生产的制剂,如CN100999667公开了一种设施菜地土壤改良剂及其制备方法与应用,强调作为土壤改良剂,菌剂中菌种的配比和固体菌剂载体的配比,菌剂单独发酵活菌数为1×108 CFU/mL[3]。CN101948771A公开了防病促生植物内生解淀粉芽孢杆菌及其应用,强调在牛肉膏、酵母膏和葡萄糖培养液中可获得菌数(2-4)×108 CFU/mL的发酵液,含2种抗菌物质,菌液稀释50倍处理水稻种子,对水稻恶苗病温室防效达到84.6%以上[4]。上述两种制剂中,前者发酵液菌数偏低,用量和成本必然会加大;后者处理种子时使用的菌液浓度也较高,用量和成本也较高。如果能将发酵菌液的活菌数和活性提高,减少使用量,降低生产成本,将大大节约能源和资源,利国利民。
豆制品废水(黄浆水)中富含氮、磷、钾等营养成分,如不经处理直接排出,对环境具有潜在影响[5]。据调查,太原市年排黄浆水大约在4.3万t以上,而每吨黄浆水如进行处理需投资3元左右(不包括排污工程和设备投资)。目前,国内相关发明专利提到黄浆水主要应用于生产饲料、饮料、白酒、酱油、维生素B12、酒精、乳酸、谷氨酸、核黄素和虾青素等领域,发酵用菌株有乳酸菌、酵母菌和白地霉等。如CN200610045614.7公开了利用黄浆水培养富含虾青素的红发夫酵母的方法,利用获得的细胞及从中提取的虾青素制备饲料添加剂[6]。因此,有效利用黄浆水中的营养成分生产微生物菌剂,既可降低菌剂生产成本,又是解决废水再利用的一项既经济又环保的措施。
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)属芽孢杆菌属,是一种与枯草芽孢杆菌(Bacillus subtilis)亲缘性较高的细菌。其作为植物根际有益微生物,通过分泌拮抗物质和营养竞争,在促进植物生长、防治病害方面发挥着多种有益的作用[7-9]。大量研究表明,一些芽孢杆菌可以产生对植物病原真菌有抑制作用的抗菌物质,主要包括低分子量的抗生素如肽类、脂肽类、细菌素以及高分子量蛋白质类抗菌物质等[7, 10-12],具有的广谱抗菌功能,为其在农业上的应用提供了巨大的可能。目前对解淀粉芽孢杆菌的发酵条件优化的研究很多[8-13],而本研究旨在利用黄浆水,对一株具有促生抑菌功能的解淀粉芽孢杆菌Pb-4的发酵条件进行优化,为今后该解淀粉芽孢杆菌的工业化应用提供理论依据。
1 材料与方法 1.1 材料 1.1.1 供试菌株Pb-4菌株:解淀粉芽孢杆菌(Bacillus amyloliquefaciens)由本课题组前期筛选对番茄枯萎病菌具有较好抑制效果,于营养琼脂(NA)培养基斜面保存。fq菌株:番茄枯萎病菌(Fusarium oxysporum f. sp. lycopersiici)由本课题组分离自日光温室自然发病株,于马铃薯葡萄糖琼脂(PDA)培养基斜面保存。
1.1.2 制备培养基试剂与材料蛋白胨,酵母粉,葡萄糖,黄浆水,玉米粉等。
1.2 方法 1.2.1 种子液的制备将保存的Pb-4菌株斜面接种于种子培养基(0.5%蛋白胨,0.5%酵母粉,1.5%葡萄糖,pH 7.0-7.2)中,180 r/min、28℃摇床培养24 h,备用。
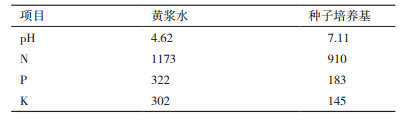
1.2.2 供试黄浆水化学特性实验选用工艺稳定的山西老字号“六味斋”豆制品加工厂的黄浆水,经15 min煮沸、八层纱布过滤后,相关成分与1.2.1中种子培养基进行比较,结果见表 1。N含量采用全自动凯氏定氮仪测定;P含量采用钒钼黄法紫外分光光度计测定;K含量采用火焰光度计测定[14]。
从表 1中可以看出,黄浆水与细菌基础培养基的成分比较接近,可以作为解淀粉芽孢杆菌Pb-4液体发酵的水相,可不添加氮(N)、磷(P)、钾(K),需调节pH值,添加适量的碳源和无机盐。
1.2.3 黄浆水发酵培养基组分的单因素筛选将黄浆水煮沸后过滤,去除滤渣,分别加入1.5%的不同碳源(葡萄糖、蔗糖、白砂糖、麦芽糖、玉米粉),分装后1×105 Pa灭菌20 min,备用。初始培养条件为:pH 7.0,250 mL三角瓶中的装液量为100 mL,接种量3%,于180 r/min、28℃条件下摇瓶培养48 h。以不添加碳源的黄浆水作对照,测定培养24 h和48 h时添加不同碳源处理Pb-4菌株活菌数,并检测抑菌活性。在灭菌后的培养皿中加入1 mL fq菌液,随后将冷却至约45℃熔融态的PDA固体培养基倒入平板,摇匀,待凝固后,用滤纸片蘸取不同碳源培养的Pb-4菌液20 μL,以对角线方向贴于含fq菌液的PDA平板上,同时将蘸有无菌培养液的滤纸片贴于平板中心作为对照CK,28℃培养。观察并记录抑菌圈直径,检测不同碳源培养的Pb-4对fq的抑菌活性[15, 16]。每个处理重复3次。从而筛选最佳碳源。
1.2.4 芽孢产生时间测定活化Pb-4菌株,按3%接种量接种于最佳碳源黄浆水液体培养基中,28℃振荡培养,从24 h开始,每2 h取菌液涂片进行芽孢染色,观察芽孢生成情况,计数每个视野中无芽孢菌体数、有芽孢菌体数、离体芽孢数[17],每次4个重复。
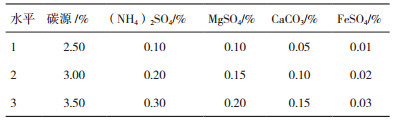
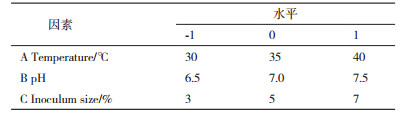
1.2.5 黄浆水培养液中无机盐成分优化选择为了进一步优化提高培养物的效价,设置因素水平为L18(35)正交试验,对黄浆水培养液中最佳碳源用量和无机盐添加比例进行优化[18]。正交实验各因素及水平见表 2。
以660 nm菌液的吸光度(OD660)表示菌体的生物量。菌液10 000 r/min离心10 min,取上清,以不接种的培养基作对照,在1 cm比色杯中于分光光度计上测定OD660。
1.2.7 响应面优化试验利用1.2.5中的最佳培养基,根据Box-Benhnken设计原理,设置3因素3水平的响应面分析试验。以培养温度、pH和接种量为自变量,以菌体生物量为响应值进行培养条件的响应面优化试验[19、20]。
1.2.8 验证试验利用1.2.5中的最佳培养基和1.2.7优化的最佳培养条件进行验证试验,确定最终优化结果。
1.2.9 数据处理用Design-Expert分析软件进行多元二次回归模型方程的建立,并作出响应面图,进一步通过数据优化程序,求得当响应面值最大时,培养条件各因素的最优水平。
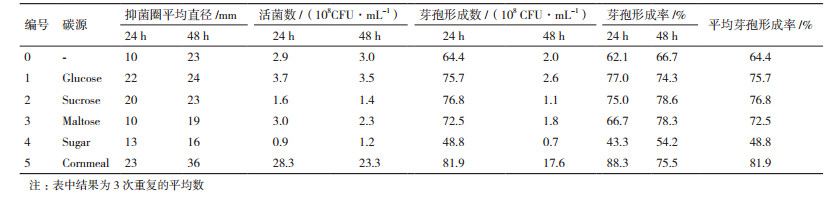
2 结果 2.1 黄浆水中添加不同碳源对Pb-4抑菌活性、活菌数和芽孢形成的影响在黄浆水中分别添加葡萄糖、蔗糖、麦芽糖、白砂糖和玉米粉5种不同碳源,测定活菌数,并检测抑菌效果,结果见表 3。与其它碳水化合物相比,添加玉米粉不仅菌数多,抑菌效果好,芽孢形成率也较高,说明玉米粉中所含有的其它营养物质,有利于Pb-4菌株的快速繁殖与生长。为此,在黄浆水液体培养基中选择玉米粉为最佳碳源。
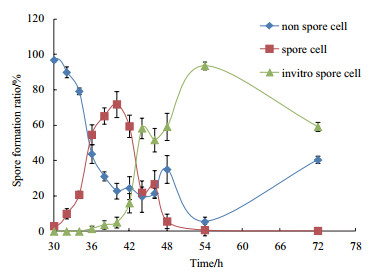
由于芽孢生成量决定产品的最终质量,因此利用黄浆水玉米粉培养基对Pb-4菌培养时间与芽孢生成的关系进行了研究。结果见图 1。Pb-4菌摇瓶培养30 h时芽孢开始生成,40 h时含芽孢菌体达到最多,之后随着芽孢的脱落,离体芽孢数逐渐增加,54 h后没有芽孢菌体存在。
|
| 图 1 黄浆水玉米粉培养基对Pb-4菌芽孢生成的影响 |
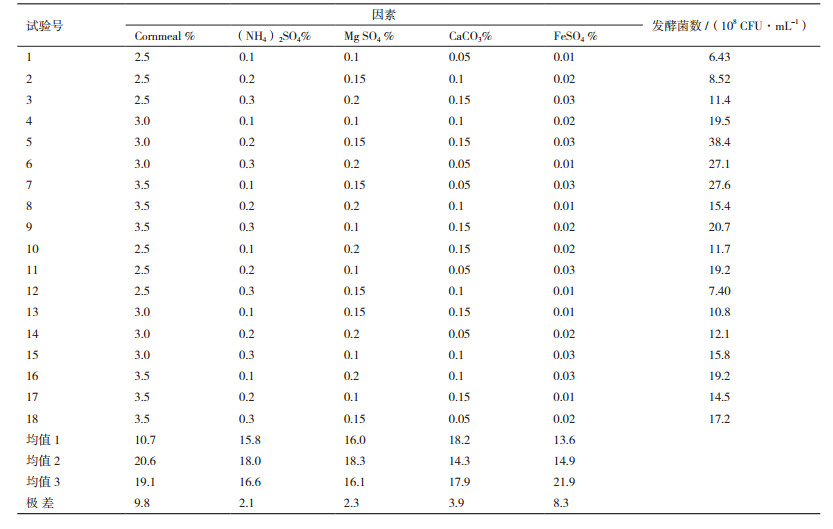
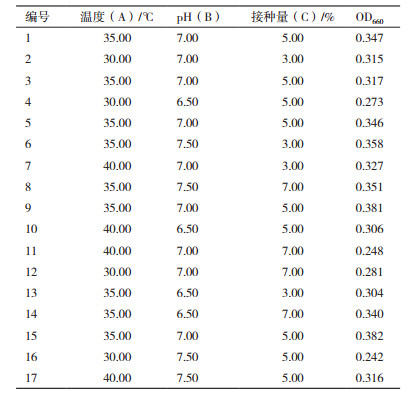
为了进一步优化提高培养物的效价,设置了因素水平为L18(35)正交试验(表 2),对黄浆水玉米粉培养液中玉米粉及无机盐成分进行优化,确定液体培养基配方,结果见表 4、表 5。优化后的Pb-4菌培养基组成:1 000 mL黄浆水中添加玉米粉30 g、(NH4)2SO4 2 g、MgSO4 1.5 g、CaCO3 1.5 g和FeSO4 0.3 g。发酵菌数可达38.4×108 CFU/mL。
根据Box-Benhnken设计原理,设置3因素3水平的响应面分析试验。以培养温度、pH和接种量为自变量,以菌体生物量为响应值进行响应面试验。选择培养基pH为7.0±5,培养温度(35±5)℃、接种量(5±2)%和菌株生物量(OD660)进行响应面实验设计优化,见表 6;测定数据见表 7。
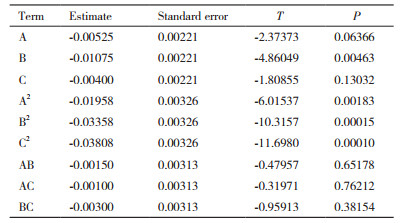
对实验结果进行分析,得到三元二次回归方程如下:Y=0.17237-0.00433A-0.01028B-0.0387C-0.02186A2-0.03219B2-0.02981C2-0.00041AB -0.00011AC-0.00108BC。对结果进行方差分析,见表 8所示。绘制响应面曲线见图 2。

|
| 图 2 A(培养温度)、B(pH)、C(接种量)交互响应曲面图 |
通过解析分析,由RSM预测Pb-4菌株最佳培养条件为:温度36.29℃;pH 7.38;接种量5%时,其理论最大生物量OD660值为0.3902。
2.5 验证结果利用2.3中的最佳培养基配方和2.4中的最佳培养条件,进行了5次摇瓶培养实验,测定OD660平均值为0.393±0.008 7,说明在精确操作的条件下,该实验条件具有较好的重复性,与预测的理论最大生物量相吻合,同时测定了发酵菌数平均值为(42.8±0.2)×108 CFU/mL,确定解淀粉芽孢杆菌Pb-4菌株优化后的发酵培养基配方为:1 000 mL黄浆水中添加玉米粉30 g、(NH4)2SO4 2 g、MgSO4 1.5 g、CaCO3 1.5 g和FeSO4 0.3 g;优化后的发酵条件为:温度36.3℃、pH7.4、接种量5%、摇瓶培养40 h。
3 讨论解淀粉芽孢杆菌(Bacillus amyloliquefaciens)是一种具有广谱抑菌活性的细菌,能抑制尖孢镰刀菌等多种植物病原真菌[11]。因此,在防治病原菌的微生物菌剂的研制方面,研究人员对解淀粉芽孢杆菌的研究越来越多。为了更好产业化发展,首先要对菌株的发酵条件进行研究。权春善等[11]确定解淀粉芽孢杆菌的培养条件为:以葡萄糖、NH4Cl、MgCl2、牛肉膏为培养基,最适培养pH值为6.0、温度为33℃;李娟等[13]确定解淀粉芽孢杆菌的培养条件为:以马铃薯、蔗糖、黄豆粉、MgCl2为培养基,发酵条件为温度30℃、初始pH 5;刘京兰等[15]确定解淀粉芽孢杆菌的培养条件为:以可溶性淀粉、胰蛋白胨、酵母粉、NaCl为培养基,最佳培养条件:pH 6.0、28℃;梁昌聪等[20]确定解淀粉芽孢杆菌的培养条件为:以蔗糖、尿素、豆粕和多种无机盐为培养基。上述研究结果表明不同菌株的最佳发酵条件不同,且解淀粉芽孢杆菌可利用各种不同的培养成分生长,但利用黄浆水发酵解淀粉芽孢杆菌的研究还未见报道。
本课题组的相关研究表明,解淀粉芽孢杆菌Pb-4菌株可以在土壤和植物体内定殖;其发酵液对多种植物土传真菌性病害具有良好的防控效果和明显的促生长作用[7]。Pb-4菌株发酵液的生产将废弃物资源化利用,施用后可减少或替代化学农药的使用,安全无毒,属环境友好型制剂,符合生态农业和可持续农业发展的需求。下一步将继续利用5 L全自动发酵罐进行发酵模拟实验,对解淀粉芽孢杆菌Pb-4菌的发酵条件进行进一步的优化,并在1 t发酵罐中进行小试,以期早日实现产业化。
4 结论本文通过系统研究,了解掌握了利用豆制品黄浆水添加玉米粉,培养解淀粉芽孢杆菌Pb-4菌的优化培养基配方和发酵条件,优化后的发酵培养基配方:1 000 mL黄浆水中添加玉米粉30 g、(NH4)2SO4 2 g、MgSO4 1.5 g、CaCO3 1.5 g和FeSO4 0.3 g;优化后的发酵条件为:温度36.3℃、pH 7.4、接种量5%、摇瓶培养40 h,理论最大生物量OD660值为0.390 2,实测OD660值为0.393,发酵菌数可达42.8×108 CFU/mL。优化的培养基的独到之处是替代了蛋白胨、酵母粉、葡萄糖等常规培养基;其工艺简单、廉价、环保,具有较好的应用前景。
| [1] | 张乃明, 常晓冰, 秦太峰. 设施农业土壤特性与改良[M]. 北京: 化学工业出版社, 2008. |
| [2] | 史静, 张乃明, 包立. 我国设施农业土壤质量退化特征与调控研究进展[J]. 中国生态农业学报, 2013, 21(7): 787–794. |
| [3] | 刘兆辉. 一种设施菜地土壤改良剂及其制备方法与应用: 中国, 200710013116. 9[P]. 2009-01-07. |
| [4] | 张淑梅. 防病促生植物内生解淀粉芽孢杆菌及其应用: 中国, 201010264520. 5[P]. 2012-05-09. |
| [5] | 王洪波, 曹龙奎. 豆制品加工中黄浆水无害化处理技术研究[J]. 农产品加工, 2007, 9(6): 33–35. |
| [6] | 孙玉梅. 利用黄浆水培养富含虾青素的红发夫酵母的方法: 中国, 200610045614. 7[P]. 2008-05-07. |
| [7] | 郭珺, 武爱莲, 闫敏, 等. 芽孢杆菌-菌株鉴定及其抑菌活性的研究[J]. 华北农学报, 2016, 24(2): 224–228. DOI:10.7668/hbnxb.2016.02.036 |
| [8] | 任争光, 张志勇, 李丹, 等. 芽孢杆菌-产抗菌物质发酵条件初探[J]. 中国农学通报, 2007, 23(5): 321–325. |
| [9] | 魏红, 刘素花, 宋庆丰, 等. 解淀粉芽孢杆菌产抗菌物质发酵工艺研究[J]. 中国农学通报, 2009, 25(11): 151–155. |
| [10] | 叶云峰, 黎起秦, 袁高庆. 枯草芽孢杆菌菌株高产抗菌物质的培养基及发酵条件优化[J]. 微生物学通报, 2011, 38(9): 1339–1346. |
| [11] | 权春善, 王军华, 徐洪涛, 等. 一株抗真菌解淀粉芽孢杆菌的分离鉴定及其发酵条件的初步研究[J]. 微生物学报, 2006, 46(1): 7–12. |
| [12] | 吴艳, 陶晶, 赵思峰, 等. 芽孢杆菌组合-发酵条件优化及其效能研究[J]. 农业工程学报, 2008, 24(7): 204–208. |
| [13] | 李娟, 夏凯丽, 王远宏, 等. 解淀粉芽孢杆菌-摇瓶发酵条件优化[J]. 生物技术通报, 2015, 31(12): 214–220. |
| [14] | 鲍士旦. 土壤农化分析[M]//第3版. 北京: 中国农业出版社, 2000: 30-171. |
| [15] | 刘京兰, 薛雅蓉, 刘常宏. 内生解淀粉芽孢杆菌产摇瓶发酵条件优化[J]. 微生物学通报, 2014, 41(1): 75–82. |
| [16] | 黄明媛, 顾文杰, 张发宝. 番茄青枯病拮抗菌筛选鉴定及其发酵条件初探[J]. 微生物学通报, 2011, 38(2): 214–220. |
| [17] | Hoben HJ, Somasegaran P. Comparison of the pour, spread, and drop plate methods for enumeration of Rhizobium spp. in inoculants made from Presterilized peat[J]. Applied and Environmental Microbiology, 1982, 44 (5): 1246–1247. |
| [18] | 赵帅, 田长彦, 史应武, 等. 黄瓜枯萎病生防菌-产抗菌物质条件的优化及抑菌作用初探[J]. 微生物学通报, 2013, 40(5): 802–811. |
| [19] | 杨实权, 张喜成, 刘军锋, 等. 响应面法优化酿酒酵母产油脂条件[J]. 微生物学通报, 2010, 34(1): 91–95. |
| [20] | 梁昌聪, 郭立佳, 刘磊, 等. 响应面法优化解淀粉芽孢杆菌发酵培养基[J]. 生物技术通报, 2014, 30(8): 169–174. |