2. 北京农学院植物科学技术学院,北京 102206;
3. 邢台市农业科学研究院,邢台 054000
2. College of Plant Science and Technology, Beijing University of Agriculture, Beijing 102206;
3. Xingtai Academy of Agricultural Sciences, Xingtai 054000
昆虫中肠内丰富的营养物质以及独特的理化环境为微生物的生长与繁殖提供了便利条件,其中大部分正常菌群对宿主无害,统称为有益菌群[1]。正常情况下有益菌群处于动态平衡中,可通过合成多种消化酶参与昆虫体内的消化过程,协助降解有毒物质[2],提高昆虫防御能力[3],进而维持虫体的正常生理机能。昆虫中肠内有益菌群的动态平衡一旦被打破,会对昆虫的生理生化机能乃至生长发育产生一定的影响。
昆虫肠道微生物包括细菌、真菌、原生动物和古生菌,其中细菌所占比例较高,为主要菌群。不同昆虫,不同发育阶段中肠内的微生物总量和优势菌群也不同。黄胜威等[4]发现暗黑鳃金龟(Holotrichia parallela)幼虫中肠微生物主要以厚壁菌门、变形菌门、拟杆菌门、放线菌门和梭杆菌门细菌为主,其中厚壁菌门和变形菌门菌群最多。张珏峰[1]发现二化螟(Chilo suppressalis)中肠细菌群落的组成及丰富度随着虫体抗药性的不同存在明显差异;王尧等[5]发现黄粉虫肠道菌群在黄粉虫蛋白质消化过程中发挥一定的作用。
华北大黑鳃金龟(Holotrichia oblita)属鞘翅目,鳃金龟科,幼虫又名蛴螬,是重要的地下害虫。苏云金芽胞杆菌(Bacillus thuringiensis,Bt)可分泌具有杀虫活性的杀虫晶体蛋白(Insecticidal crystal proteins,ICPs)和多种营养期杀虫蛋白(Vegetative insecticidal protein,VIP),对包括蛴螬在内的多种昆虫具有杀虫活性[6, 7]。昆虫中肠是消化食物的主要场所,也是Bt杀虫蛋白的靶标部位,不同昆虫饲喂Bt杀虫蛋白后对昆虫肠道细菌的影响各不相同。饲喂商业型B. thuringiensis subspecies kurstaki(DiPel DF),发现该Bt菌株对舞毒蛾(Porthetria dispar)幼虫的毒杀作用依赖于中肠微生物Enterobacter sp,饲喂舞毒蛾抗生素降低肠杆菌浓度后,Bt的杀虫活性降低[8]。与此相类似,饲喂鳞翅目小红蛱蝶(Vanessa cardui),烟草天蛾(Manduca sexta),菜粉蝶(Pieris rapae)抗生素后,改变了虫体内中肠微生物的结构组成,降低了虫体对Bt杀虫蛋白的敏感性[9]。同时研究,分别饲喂二化螟幼虫Bt杀虫蛋白Cry1Ab、Cry1Ab和Cry1Ca后,相对于对照组,幼虫的中肠微生物菌群的丰富度发生改变,优势菌群比重也发生改变[10]。由此可见,虫体内中肠微生物种群结构变化在Bt蛋白的杀虫机理中发挥重要作用。Cry8Ea对华北大黑鳃金龟幼虫有特异杀虫活性,LC50为0.267 9 μg/mL[11],本研究通过比较正常饲喂和饲喂Cry8Ea蛋白的华北大黑鳃金龟二龄幼虫中肠微生物菌群变化,揭示Cry8Ea蛋白对微生物菌群的影响。
1 材料与方法 1.1 材料 1.1.1 供试昆虫于河北省保定地区采集华北大黑鳃金龟,放入装有细土的培养箱(长50 cm,宽37 cm,高22.5 cm)中,并保持箱中细土的湿度,野外采集的榆树叶室内饲养。每日观察,至成虫发生交尾后,每周一次翻土,将初孵幼虫取出放入装有细土的小盒中(每盒10-15头)培养至二龄,分装至24孔板中饲养,避免蛴螬自相残杀。幼虫分出后即可饲喂新鲜的土豆块。
1.1.2 主要试剂DNA抽提缓冲液:1.5 mol/L NaCl,100 mmol/L磷酸盐缓冲液,100 mmol/L EDTA,100 mmol/L Tris-HCL;10 mg/mL蛋白酶K(BOSTER);1 mol/L IPTG、20 mg/mL X-gal和100 mg/mL氨苄青霉素;DNA纯化试剂盒(TIANGEN);pGEM-T Easy载体(Promega);限制性内切酶:MspⅠ,RsaⅠ和Hae Ⅲ(Promega)。
1.2 方法 1.2.1 中肠的提取与分离将正常饲喂与饲喂Cry8Ea蛋白的华北大黑鳃金龟二龄幼虫分别用无菌水漂洗30 s,晾干后用75%酒精擦拭清洁幼虫体表,75%酒精体表消毒2 min,再用无菌水漂洗以彻底去除残留体表的酒精。在无菌条件下,用已消毒的剪刀从两侧剪开幼虫虫体,取出中肠,放入1.5 mL的EP管中。
1.2.2 DNA的提取和16S rDNA片段的扩增肠道微生物总DNA的提取参照黄胜威采用的方法[4]。以提取的中肠微生物总DNA为模板,用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3'),1492R(5'-TACGGTTACCTTGTTACGACTT-3')进行PCR扩增。PCR反应体系为:模板DNA 2 µL,10×Reaction Buffer 2.5 µL,25 mmol/L MgCl2 2 µL,10 mmol/L dNTPs 0.5 µL,10 µmol/L 27F 0.5 µL,10 µmol/L 1492R 0.5 µL,Taq polymerase 0.2 µL。PCR反应程序为:94℃预变性5 min,94℃变性50 s,55℃退火45 s,72℃延伸1 min 20 s,30个循环。PCR产物进行琼脂糖凝胶电泳检测,DNA纯化试剂盒纯化回收。
1.2.3 16S rDNA文库的构建将纯化的PCR产物连接至pGEM-T Easy载体(Promega)中,构建华北大黑鳃金龟中肠细菌16S rDNA文库。连接产物转化至TG1感受态中,在含有IPTG、X-Gal和氨苄青霉素的LB平板上37℃培养过夜。挑取白色菌落,用通用引物T7(5'-TAATACGACTCACTATAGGG -3'),SP6(5'-ATTTAGGTGACACTATA-3')进行PCR扩增鉴定。PCR反应体系为:模板DNA 2 µL,10×Reaction Buffer 2.5 µL,25 mmol/L MgCl2 2 µL,10 mmol/L dNTPs 0.5 µL,10 µmol/L T7 0.5 µL,10 µmol/L SP6 0.5 µL,Taq polymerase 0.2 µL。PCR反应程序为:94℃预变性3 min,94℃变性40 s,57℃退火40 s,72℃延伸1 min 10 s,30个循环。
1.2.4 PCR-RFLP对阳性克隆所携带的16S rDNA进行PCR扩增后分别用3种限制性酶Msp Ⅰ,Rsa Ⅰ和Hae Ⅲ酶进行限制性酶切消化(37℃,3 h),用2%的琼脂糖凝胶电泳分析酶切片段多态性。根据Msp Ⅰ,Rsa Ⅰ和Hae Ⅲ 3种酶切基因片段多态图谱为基础进行分类。
1.2.5 测序及序列分析根据酶切图谱将阳性克隆送去上海生工生物技术有限公司进行测序。将测序结果通过NCBI GenBank数据库进行blast比对分析,利用clustalx1.83和MEGA6.06软件构建系统进化树。
2 结果 2.1 华北大黑鳃金龟幼虫中肠微生物总DNA的提取及16S rDNA的PCR扩增提取正常饲喂与饲喂Cry8Ea蛋白的华北大黑鳃金龟二龄幼虫中肠微生物的基因组DNA,琼脂糖凝胶电泳结果(图 1)显示所提取的基因组DNA条带完整性好,特异度高。分别以两个处理的基因组DNA为模板进行PCR扩增,得到约1 500 bp大小的目的条带(图 2),与预期结果相符,进行后续实验。

|
| 图 1 中肠微生物基因组DNA M:DNA Maker DL2000;1:正常饲喂的幼虫中肠微生物基因组DNA;2:饲喂Cry蛋白的幼虫中肠微生物基因组DNA |

|
| 图 2 16S rDNA的PCR扩增结果 M:DNA Maker DL2000;CK:阴性对照;1和2分别为:正常饲喂和饲喂Cry8Ea蛋白华北大黑鳃金龟幼虫中肠微生物总16S rDNA的PCR扩增结果 |
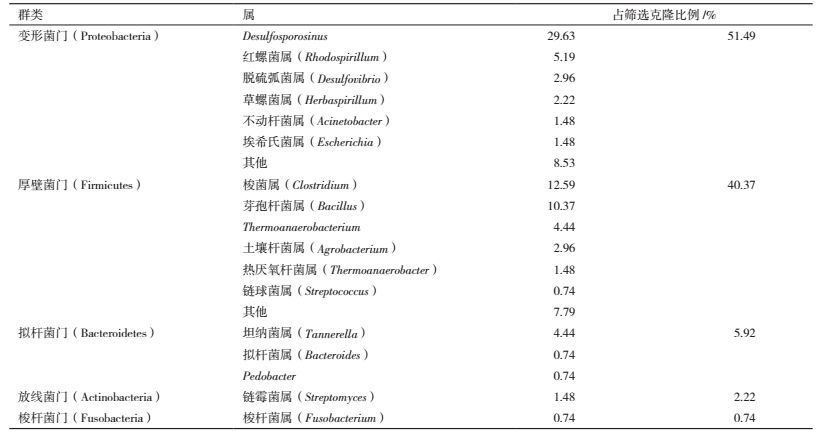
将正常饲喂组与饲喂蛋白组酶切图谱中呈现不同带型的阳性克隆送去测序(图 3,图 4)。其中正常饲喂组测序150个,饲喂蛋白组测序50个。结果表明正常饲喂组华北大黑鳃金龟幼虫中肠微生物种群含有30种细菌。系统进化树显示(图 5),分别属于5种细菌门:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和梭杆菌门(Fusobacteria),优势细菌菌群为变形菌门的Desulfosporosinus(29.63%),厚壁菌门的梭菌属(Clostridium,12.59%)和芽胞杆菌属(Bacillus,10.37%)(表 1)。饲喂蛋白组华北大黑鳃金龟幼虫中肠微生物中共检测出4种细菌(表 2),其中优势菌群为肠球菌属(Enterococcus)、链球菌属(Streptococcus)。

|
| 图 3 正常饲喂组16S rDNA阳性克隆Msp Ⅰ(A),Rsa Ⅰ(B)和Hae Ⅲ(C)部分酶切图谱 M:DNA Maker DL2000;1-18:16S rDNA PCR产物酶切结果 |

|
| 图 4 饲喂Cry8Ea组16S rDNA阳性克隆Msp Ⅰ(A),Hae Ⅲ(B)和Rsa Ⅰ(C)部分酶切图谱 M:Maker;1-17:16S rDNA PCR产物酶切 |

|
| 图 5 基于16S rDNA序列的正常饲喂的华北大黑鳃金龟幼虫中肠微生物系统发育树 |
华北大黑鳃金龟幼虫(蛴螬)属于土栖性地下害虫,体型较大,生活隐蔽,抗药性强,化学防治比较困难,农药的大量使用严重污染环境。因此,寻找新的蛴螬防治方法十分必要。近年来生物防治因其特异性好、安全性高,受到人们的重视。Bt杀虫蛋白的作用范围较广,包括鳞翅目的天蚕蛾[12]、家蚕[13],直翅目的东亚飞蝗[14],蜚蠊目的东方蜚蠊[15]。对Bt杀虫蛋白作用机制的研究:一方面认为可溶性晶体蛋白经中肠蛋白酶活化后与中肠上皮细胞受体结合,破坏细胞膜的完整性,最终导致虫体死亡[16];另有研究表明,中肠微生物Enterobacter sp在Bt杀虫蛋白对舞毒蛾幼虫的毒杀作用中发挥着至关重要的作用,而且这种现象也存在于其他鳞翅目小红蛱蝶,烟草天蛾,菜粉蝶[8, 9]。
昆虫中肠是消化食物的主要场所,也是Bt杀虫蛋白的靶标部位,不同种类、不同时期、不同地区昆虫中肠内微生物菌群结构组成差异较大[17, 18]。有研究表明橘小实蝇Bactrocera dorsalis中与免疫调控有关的PGRP-LB和 PGRP-SB基因的缺失会影响虫体中肠微生物菌落的结构与组成[19]。由此可见,中肠微生物的多样性以及丰富度与昆虫的生长发育密切相关。本实验利用16S rDNA PCR-RFLP的方法对饲喂Cry8Ea毒素蛋白后,华北大黑鳃金龟二龄幼虫中肠微生物菌群的组成和多样性进行分析结果显示,正常饲喂组华北大黑鳃金龟幼虫中肠微生物种群由30种细菌组成,优势菌群为变形菌门:(Desulfosporosinus,29.63%);厚壁菌门:梭菌属(Clostridium,12.59%)和芽孢杆菌属(Bacillus,10.37%);而饲喂杀虫蛋白后幼虫中肠微生物种类明显减少,共检测出4种细菌;优势菌群变为厚壁菌门:肠球菌属(Enterococcus)和链球菌属(Streptococcus),菌群比例也发生变化分别上升为50%与46.88%。有研究将Bt杀虫蛋白饲喂二化螟幼虫,解剖中肠检测其微生物结构组成,发现二化螟幼虫中肠细菌群落结构发生明显变化[10],与本实验结果相似。推测中肠微生物菌群的改变是由于饲喂Bt杀虫蛋白后对中肠内的pH值,离子环境等产生影响,从而改变了中肠微生物的生境,破坏了原有微生物菌群的动态平衡所致,但Bt蛋白杀虫活性的发挥是否依赖于特定的关键中肠微生物,有待进一步的研究。
4 结论正常饲喂和饲喂Cry8Ea蛋白华北大黑鳃金龟二龄幼虫中肠微生物菌群结构发生明显变化,中肠微生物菌群的多样性和丰度都有很大的差异性。
| [1] | 张珏峰, 何月平, 陈建明. 不同抗药性水平二化螟幼虫中肠细菌群落多样性分析[J]. 昆虫学报, 2013, 56(9): 1075–1082. |
| [2] | Babendreier D, Joller D, Romeis J, et al. Bacterial community structures in honeybee intestines and their response to two insecticidal proteins[J]. FEMS Microbiology Ecology, 2007, 59 (3): 600–610. DOI:10.1111/fem.2007.59.issue-3 |
| [3] | Soto LP, Frizzo LS, et al. Molecular microbial analysis of Lactobacillus strains isolated from the gut of calves for potential probiotic Use[J]. Veterinary Medicine International, 2010, 2010 : 274987. |
| [4] | 黄胜威. 暗黑鳃金龟肠道共生菌分子多态性研究[D]. 武汉: 华中农业大学, 2009. |
| [5] | 王尧. 黄粉虫幼虫肠道细菌在其蛋白质消化利用中的作用研究[D]. 杨凌: 西北农林科技大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10712-1015335057.htm |
| [6] | Schnepf E, Crickmore N, Van Rie J, et al. Bacillus thuringiensis and its pesticidal crystal proteins[J]. Microbiology and Molecular Biology Reviews, 1998, 62 (3): 775–806. |
| [7] | Chakroun M, Banyuls N, et al. Bacterial Vegetative Insecticidal Proteins(Vip)from Entomopathogenic Bacteria[J]. Microbiol-ogy and Molecular Biology Reviews, 2016, 80 (2): 329–350. DOI:10.1128/MMBR.00060-15 |
| [8] | Broderick NA, Raffa KF, Handelsman J. Midgut bacteria required for Bacillus thuringiensis insecticidal activity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103 (41): 15196–15199. DOI:10.1073/pnas.0604865103 |
| [9] | Broderick NA, Robinson CJ, McMahon MD, et al. Contributions of gut bacteria to Bacillus thuringiensis-induced mortality vary across a range of Lepidoptera[J]. BMC Biology, 2009, 7 (1): 1–9. DOI:10.1186/1741-7007-7-1 |
| [10] | 李振, 韩兰芝, 刘玉娣, 等. Bt杀虫蛋白处理后二化螟幼虫中肠细菌群落的变化[J]. 昆虫学报, 2016, 59(3): 292–300. |
| [11] | 王伟, 郭巍, 徐大庆, 等. 苏云金杆菌Cry8Ea2蛋白的分离纯化及生物活性测定[J]. 华北农学报, 2012(6): 48–52. |
| [12] | Edlund T, Sidén I, Boman HG. Evidence for two immune inhibitors from Bacillus thuringiensis interfering with the humoral defense system of saturniid pupae[J]. Infection and Immunity, 1976, 14 (4): 934–941. |
| [13] | Fedhila S, Nel P, Lereclus D. The InhA2 metalloprotease of Bacillus thuringiensis strain 407 is required for pathogenicity in insects infected via the oral route[J]. Journal of Bacteriology, 2002, 184 (12): 3296. DOI:10.1128/JB.184.12.3296-3304.2002 |
| [14] | Hoffmann, D, Brehelin M, Hoffmann JA. Modifications of the hemogram and of the hemocytopoietic tissue of male adults of Locusta migratoria(Orthoptera)after injection of Bacillus thuringiensis[J]. Journal of Invertebrate Pathology, 1974, 24 (2): 238. DOI:10.1016/0022-2011(74)90017-2 |
| [15] | Ignoffo CM, Garcia C, Couch TL. Effect of antibiotics on the insecticidal activity of Bacillus thuringiensis[J]. Journal of Invertebrate Pathology, 1977, 30 (2): 277–278. DOI:10.1016/0022-2011(77)90236-1 |
| [16] | Knowles BH. Mechanism of Action of Bacillus thuringiensis isecticidal δ-endotoxins[J]. Advances in Insect Physiology, 1994, 24 (5): 275–308. |
| [17] | Yadav KK, Datta S, Naglot A, et al. Diversity of cultivable midgut microbiota at different stages of the Asian Tiger Mosquito, Aedes albopictus from Tezpur, India[J]. PLoS One, 2016, 11 (12): e0167409. DOI:10.1371/journal.pone.0167409 |
| [18] | Raymond B, Johnston PR, Wright DJ, et al. A mid-gut microbiota is not required for the pathogenicity of Bacillus thuringiensis to diamondback moth larvae[J]. Environmental Microbiology, 2009, 11 (10): 2556–2563. DOI:10.1111/emi.2009.11.issue-10 |
| [19] | 王爱琳. PGRP-LB和PGRP-SB基因在橘小实蝇免疫及肠道微生物调控中的作用研究[D]. 武汉: 华中农业大学, 2009. |