2. 西南民族大学化学与环境保护工程学院,成都 610041
2. College of Chemistry & Environment Protection Engineering, Southwest University for Nationalities, Sichuan 610041
21世纪以来,随着社会的不断发展和进步,由自然过程或人类活动如采矿、工业和农业生产造成的重金属污染已引起了广泛的关注。在重金属污染中,镉和铅的污染最为广泛[1]。铅是“五毒”重金属元素之一,它能通过食物链的富集危害人类健康,以毒性高、滞留时间长,成为最受关注的重金属污染元素之一。人工湿地被称为天然的污水净化器,人工湿地污水处理系统是利用自然生态系统中的物理、化学和生物等因素的协同作用得以实现污水净化的[2]。与传统的物理方法,化学方法和微生物方法相比较,人工湿地污水处理技术具有投资少、能耗低、生物量大、后续处理方便、减少二次污染、操作和维护简单、处理效率高和可用于景观等诸多优点。近些年来,人工湿地处理污水技术被国内外学者深入研究并广泛应用[2]。
目前,我国在利用植物对重金属污染进行修复方面尚处于起步阶段,杨俊兴等[3]通过水培试验研究了Pb胁迫对18种挺水湿地植物的耐性及吸收的影响,表明不同湿地植物对Pb的吸收是差异显著的;周桑扬等[4]总结、分析了对重金属富集能力强的湿地植物种类及其去除废水重金属的机制,介绍了人工湿地中的植物净化含重金属废水的作用和效果。植物是人工湿地技术的核心,如何正确选择植物是重金属高效去除的关键。结合前人的研究现状,本研究选取常见的3种水生植物鸢尾(俗称黄菖蒲)、菖蒲和水葫芦,采用水培法,考察3种水生植物对污染物质的抗性及富集能力,以期为选择处理废水的人工湿地植物提供参考,为铅污染防治植物修复技术提供依据。
1 材料与方法 1.1 材料挺水植物鸢尾、菖蒲和浮水植物水葫芦,浓硝酸,硝酸铅,硝酸锌,铅标准储备液,UP水,0.45 μm水溶性滤膜,火焰原子吸收分光光度计(TAS-990),马弗炉。
1.2 方法 1.2.1 实验设计采用水培法将鸢尾、菖蒲和水葫芦在清洁塑料桶内进行饥饿培养10 d,每桶内分别注入4.5 L自来水(曝晒1 d后的自来水配置而成,未含有待测重金属离子),从3种植物中,分别选取生物量相近的植物移入桶内,使其根部浸没入培养液中,每隔2 d换1次水。每桶内分别有鸢尾、菖蒲、水葫芦各3株。之后模拟污染水质将自来水换成UP水(主要是由于Pb2+与自来水中的Cl-、SO4+、以及OH-、CO32-等离子结合产生白色悬浮物,因而要用UP水[5])并加入重金属铅,污染物以Pb(NO3)2的形态添加。Pb2+的投加浓度分别为5、10、50、100和500 mg/L,实验共设计5种处理,其中,不添加Pb(NO3)2的培养液为对照处理(Pb(NO3)2浓度为0 mg/L),水葫芦,鸢尾,菖蒲各18株用于该组实验。水葫芦又再分了一组,是Pb(NO3)2和Zn(NO3)2的复合污染,Pb2+的投加浓度均是50 mg/L,Zn2+的投加浓度分别是5、10、50、100、500 mg/L,试验共设5组处理,15株水葫芦用于该组实验,其中以Pb(NO3)2浓度为50 mg/L作为对照处理。
对植物的生长管理采用室内培养的方法,始终保持植物能够获得充足的光照和通风,室内气温变化范围为8-18℃。每隔10 d取1次水样,一共取4次样。在第4次取水样时,同时采集植物样本,并对植物体内积累的重金属含量进行测定。在此期间对植株的生长反应进行观察、记录。
1.2.2 分析方法植物收取后分成地上、地下两部分,洗净105℃下杀青1 h,然后在80℃下烘干48 h至恒重,研磨。用四分法准确量取鸢尾、菖蒲和浮水植物水葫芦样品地上与地下部分粉末各(0.4000±0.000 1)g,放入5 mL坩埚内,先在低温电炉上碳化粉末至不冒烟为止(约30 min),再将瓷坩埚转入马弗炉中在500℃下灰化6 h[6];之后将植物样消解、赶酸、过滤、定容,最后将所得溶液用火焰原子吸收法对Pb进行测定。
2 结果 2.1 湿地植物的生长状况以鸢尾和水葫芦的净株高为研究对象,由表 1可以得出,在只有硝酸铅废液中培养的鸢尾和水葫芦相比较,鸢尾的生长较为缓慢,并且随铅溶液浓度的增加,植株净株高明显受到影响,表现为生长缓慢,在铅浓度为0、5、10 mg/L溶液中培养的鸢尾有新根长出,高铅浓度溶液中的植株到培养后期没有新根长出且有缩短的现象,500 mg/L废液中的鸢尾根系变短较明显,缩短了1 cm;水葫芦生长较为明显,随铅浓度的升高,植株的生长速度变缓,到后期高浓度培养液中的植物出现叶死、芽死、茎干、植株死亡的现象。
由于天气温度低,秋天霜降,菖蒲的叶子变黄,但有新芽长出,因新芽太小无法进行精确测量,用肉眼看见含有50 mg/L废液中新芽数量少但长势好、在含有0 mg/L废液中新芽数量较多且没有腐烂现象、含有500 mg/L废液中新芽长出数量少且在培养的10 d左右开始腐烂。
Pb(NO3)2+Zn(NO3)2复合污染中的水葫芦在前期Zn浓度小于50 mg/L植株的生长速度随浓度的增加而加快,溶液中Zn浓度在100 mg/L、500 mg/L植株腐烂无法测量,总体来说生长速度明显快于Pb(NO3)2单一污染的废液中的水葫芦。
2.2 植物受害情况分析植物铅中毒表现在根功能受抑制,生长缓慢和叶卷曲、变黄长斑,严重者甚至枯萎腐烂。高浓度铅还能干扰植物对其他必需矿物营养元素的吸收和运输。由于本实验是在秋季进行,温度较低,在培养的第3 d各个浓度的菖蒲叶子枯萎变黄,但根系发育正常(图 1)。

|
| 图 1 水葫芦地上部分(A)和鸢尾地下部分(B)受害症状对照 |
根据植物种类的不同黄化和变软程度上会有差异。在各Pb浓度培养下,培养初期鸢尾就表现出受害症状,如叶片逐渐从叶尖开始变黄,直至整片叶子变黄失水且翻卷;在较低Pb浓度(≤50 mg/L)培养下,水葫芦在培养后期,出现轻微的受害症状如叶片变黄、长斑等;在较高Pb浓度(≥100 mg/L)培养液中,水葫芦在培养初期有轻微的受害症状,菖蒲长出的新芽培养初期开始腐烂。
2.2.2 根部变软、腐烂的现象在较低Pb浓度(≤50 mg/L)培养下的鸢尾在培养初期根系发霉,培养后期菖蒲原有根系表现出轻微腐烂症状;在较高Pb浓度(≥100 mg/L)培养下的鸢尾在培养后期根系基本腐烂、发霉,水葫芦在培养后期有少许根部腐烂、变软,菖蒲的原有根系在培养10 d左右开始变软。
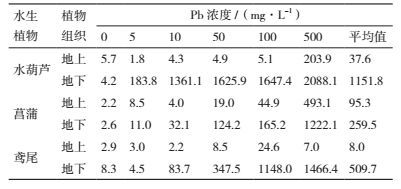
2.3 植物对重金属铅的积累量 2.3.1 单一污染时植物对重金属铅的积累对植物体中铅含量的测定结果(表 2)表明,不同种类的植物对铅的富集、吸收能力不同。通过对植物中的Pb2+积累浓度与水体中的Pb2+浓度进行一元线性回归分析可知,水葫芦、鸢尾、菖蒲地下部分中的Pb2+积累浓度随着水体中的Pb(NO3)2浓度的增加而增加,也都呈显著正相关。由表 2分析可知,各种植物对Pb2+的富集量的大小顺序是:水葫芦 > 鸢尾 > 菖蒲,这说明植物种类不同对Pb2+的富集量大小有很大的差异;各个植物的每个浓度下,地下部分重金属Pb2+的富集量远大于地上部分的富集量。
与前人研究提出的植物中有毒重金属元素的毒性阈值相比,该实验中水葫芦和鸢尾两种样品体内Pb的质量分数均超出Pb元素的植物毒性阈值(100-400 mg/kg)[7],尤其是水葫芦体内铅的质量分数是毒性阈值的3倍。
本研究将Pb-Zn复合污染与Pb单一污染条件下水葫芦的生长状态进行对比,复合污染情况下生长的水葫芦较早的表现出了叶片变黄、起斑、根部腐烂等现象,并且随着锌添加浓度的增加,水葫芦的受害现象愈加严重。Pb2+与Zn2+联合毒性均为协同,即其联合作用增加了对水葫芦的毒性
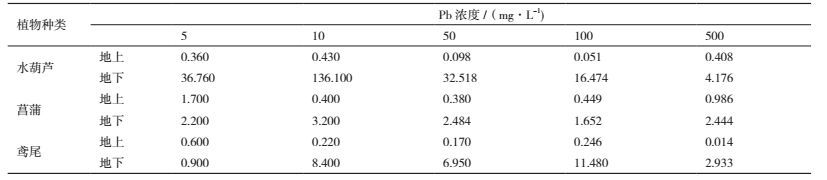
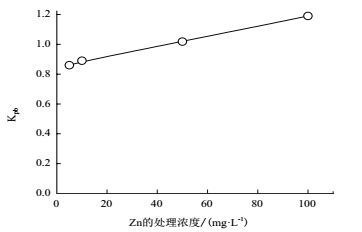
将复合污染处理中得到的植物体内重金属浓度与单一污染处理中得到的植物体内重金属浓度相比,得到一个比值Kpb。Kpb值与1比较表征了Zn的浓度对水葫芦吸收Pb的影响,在锌浓度小于100 mg/L的浓度范围内Kpb的变化趋势如图 2所示,在一定Zn浓度范围内Kpb < 1表明抑制了植物对铅的吸收,表现为拮抗作用;超过这个浓度范围Kpb > 1表明促进了植物对铅的吸收,表现为协同作用;在锌的浓度为50 mg/L左右时Kpb值在1附近,表明该锌浓度附近对水葫芦吸收铅的影响最小。
|
| 图 2 不同锌浓度下植物体内铅的浓度值 |
植物和土壤间的富集系数是植物灰分中某物质的浓度与其所生长的土壤中该物质浓度的比值,即植物灰分中某物质的含量与土壤中该物质含量的比值。由表 3可知,水体中铅浓度不同时,植物各器官的铅富集量和富集系数因植物种类的不同而有变化。水葫芦的富集系数最大值出现在铅浓度为10 mg/L,而后随浓度的增大而减小;菖蒲的富集系数最大值出现在铅浓度为5 mg/L,而后随浓度的增大富集系数呈现波动状态,没有固定的趋势;鸢尾的富集系数最大值出现在铅浓度为100 mg/L;在各个浓度阶段水葫芦的富集系数最大。
当水体浓度较低时,植物体中的铅含量与富集系数随水体中铅浓度的增加而增加,但当水体铅浓度较高时,植物体的铅富集系数反而减少,例如鸢尾的地上部分,随着水体铅浓度由0 mg/L增加到100 mg/L,铅富集系数相应增加,但当水体铅浓度达到500 mg/L时,铅的富集系数明显减少,鸢尾是3种植物中受害最为严重的植物,到最后根部全部变软腐烂叶子全部变黄,并且没有新芽长出。
随着水体铅浓度的增加,植物体铅富集量也相应的增加,包括水葫芦、菖蒲,但富集系数却有下降的趋势。这说明植物对铅的吸收是有一定限度的,这可能与铅进入植物体后较稳定、很少转运有关,同时也有可能与铅对植物的毒害作用有关[8]。
在含有50 mg/L Pb2+的培养液中加入不同浓度的Zn2+,与空白组相比较水葫芦地下部分对Pb的富集系数明显减小,Zn的存在抑制了Pb的吸收(表 4)。
目前重金属污染的治理方法以物理化学方法为主[9],而水生植物修复技术是一种更经济、更高效、更环保的治理技术更是营造湿地景观和园林水景的重要素材。植物修复在水环境污染控制与修复中具有重要的作用,应用前景十分显著。
本研究对比了3种水生植物对铅的富集能力及抗性。有研究表明[5]随着水体浓度较低时,植物体中的铅含量与富集系数随水体中铅浓度的增加而增加,但当水体的铅浓度较高时,植物体的铅富集量反而变小,本研究得出的结论与该结论相符。该实验的3种植物在每个浓度下,地下部分重金属Pb2+的富集量远大于地上部分的富集量,说明有Pb2+被植物的根部吸附,并且铅进入植物体后主要聚集在铅的吸收器官——根部[10]。根据文献[11-13],重金属主要与根皮层细胞壁结合,这可以看作是植物解毒的一种形态生理学机制,用低代谢活动将金属限制在细胞区室,还有学者认为进入根部以后与细胞中过剩的非蛋白质性物质结合成络合物,大部分被束缚在根部,很少向其他器官转移[5];Beckett等[14]提出植物体内的铅含量大于27 mg/kg便会产生毒性,该实验的3种水生植物样品中的铅含量均远远超过该阈值。植物对有毒重金属元素的抗性是指植物能够在有毒重金属元素质量分数较高的环境中存活而不出现生长率下降或死亡等毒害症状,并且植物对有毒重金属元素的抗性可以通过避性和耐性两种途径获得;高志勇等[15]曾表明水葫芦、浮萍属植物、水芹菜、蒲草属植物等具有降低废水Cd、Hg和Pb含量的优势。该实验结果得出水葫芦的富集系数和富集量最大,且对铅污染的抗性较强,是各个浓度含铅废水的理想的净化植物。
在国外,应用人工湿地处理含重金属的废水已有大量研究和较多的实例。如Nuruzzaman[16]等人利用人工湿地来工艺技术设施处理废水中的铜污染,结果表明该人工湿地对废水中铜的去除率高达70.9%;Kamarudzaman等[17]在实验室中建立人工湿地模型来种植黄泽,用以处理垃圾渗滤液中的重金属Fe和Mn,最终铁和锰的去除效率分别高达99.2%-91.5%和99.8%-94.7%。总结来看,目前国外在这方面的研究很广泛,且重金属去除率都能达到90%以上,又由于植物受环境变化影响大,夏天温度过高、冬天寒冷结冰时都不利于植物生长,因此要进行植物品种间合理搭配的深入研究,这样才能够保证湿地系统更加稳定。
4 结论本研究发现,在各个浓度条件下,水葫芦的富集系数和富集量最大,且对铅污染的抗性较强,富集量的大小关系为水葫芦 > 鸢尾 > 菖蒲;3种植物相比较菖蒲具有一定的抗性,且生命力顽强;鸢尾具有一定的吸收和富集能力,且根系较发达,但抗性很弱,在低浓度时鸢尾对铅的富集效果强于菖蒲。Pb-Zn复合污染增大了对水葫芦的毒性,使得水葫芦的长势相比单一污染中的长势较差,且影响程度与锌的浓度有关。
| [1] | 蒋雪, 温超, 曹珊珊, 等. 重金属污染水体植物修复研究进展[J]. 应用化工, 2016, 45(10): 1982–1985. |
| [2] | 刘西茹. 人工湿地污水处理系统特点及其机理[J]. 四川环境, 2014(1): 144–149. |
| [3] | 杨俊兴, 胡健, 郭庆军, 等. 铅胁迫对不同湿地植物耐性和吸收的影响[J]. 生态学杂志, 2016(10): 2738–2744. |
| [4] | 周桑扬, 杨凯, 吴晓芙, 等. 人工湿地植物去除废水中重金属的作用机制研究进展[J]. 湿地科学, 2016(5): 717–724. |
| [5] | 林芳芳, 丛鑫, 黄锦楼, 等. 人工湿地植物对重金属铅的抗性[J]. 环境工程学报, 2014(6): 2329–2334. |
| [6] | 周考文, 张斌. 火焰原子吸收法测定植物叶片中的微量铅[J]. 生命科学仪器, 2006(3): 32–34. |
| [7] | 马逍天, 梁仁君, 邱继彩, 等. 纳污湿地植物对底泥重金属吸收特性研究[J]. 环境科学与技术, 2016(1): 165–170. |
| [8] | 刘明辉. 水中重金属污染治理综述[J]. 科技创新导报, 2011(32): 61–66. |
| [9] | 李小盼. 多孔有机吸附剂的制备及其对重金属离子吸附性能的研究[D]. 杭州: 浙江大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10335-1016054518.htm |
| [10] | Stolts E, Gregor M. Accumulation properties of As, Cd, Pb and Zn by four wetland species growing in submerged mine tailings[J]. Environmental and Experimental Botany, 2004, 47 (3): 271–280. |
| [11] | 段德超, 于明革, 施积炎. 植物对铅的吸收、转运、累积和解毒机制研究进展[J]. 应用生态学报, 2014(1): 287–296. |
| [12] | 时萌, 王芙蓉, 王棚涛. 植物响应重金属镉胁迫的耐性机理研究进展[J]. 生命科学, 2016(4): 504–512. |
| [13] | 韩旭, 丁国华. 植物对重金属的耐受性和吸收·转运特性的研究进展[J]. 安徽农业科学, 2016(4): 106–109. |
| [14] | 李瑞玲, 李倦生, 姚运先, 等. 3种挺水湿地植物对重金属的抗性及吸收累积研究[J]. 湖南农业科学, 2010(17): 60–63. |
| [15] | 高志勇, 谢恒星, 刘楠楠, 等. 湿地植物在处理纺织工业废水中的应用及作用机制[J]. 北方园艺, 2016(8): 204–207. |
| [16] | Nuruzzaman M, Zhang R, Cao H, et al. Plant pleiotropic drug resistance transporters. Transport mechanism, gene expression, and function[J]. Journal of Integrative Plant Biology, 2014, 56 (8): 729–740. DOI:10.1111/jipb.v56.8 |
| [17] | Kamarudzaman AN, Ismail NS, Aziz RA, et al. Removal of nutrients from landfill leachate using subsurface flow constructed wetland planted with limnocharis flava and scirpus atrovirens[C]International Conference on Environmental and Computer Science. 2011. |