2. 清华大学分析测试中心,北京 100084
2. Analysis and Testing Center, Tsinghua University, Beijing 100084
盐胁迫是影响植物生长发育的非生物胁迫因子之一,主要通过渗透胁迫和扰乱植物细胞内离子平衡对植物造成损伤[1],进而引起一系列的生理变化,如改变细胞质膜通透性、降低光合作用[2]以及产生大量活性氧(Reactive oxygen species,ROS),而高浓度的活性氧会对细胞质膜、DNA、蛋白质造成氧化损伤,富含鸟嘌呤的端粒序列对氧化损伤高度敏感,端粒DNA的氧化损伤则导致端粒缩短和功能失调[3, 4]。
端粒酶是真核生物维持端粒长度和解决末端复制问题所必须的核糖核蛋白复合物,其核心元件由RNA模板(Telomerase RNA,TER)和具有逆转录功能的催化蛋白(Telomerase reverse transcriptase,TERT)组成[5]。端粒酶在真核生物细胞抵抗氧化损伤和DNA修复方面发挥重要作用,对人端粒酶逆转录酶hTERT的研究表明,一定程度的DNA氧化损伤可促进hTERT的表达和增加端粒酶活性,hTERT能够提高损伤DNA的修复速度,增强DNA末端合成能力,增加细胞在DNA受损伤条件下的存活率;强氧化胁迫会使端粒酶活性急剧降低,DNA损伤加剧,引发细胞死亡[6-9]。此外,氧化应激条件下端粒酶逆转录亚基TERT从细胞核内排出转位到线粒体[10],过表达TERT能够保护线粒体DNA(mtDNA),增加线粒体膜电势,减少线粒体过氧化物的产生和细胞内过氧化物水平[11]。
关于植物细胞端粒、端粒酶对非生物胁迫响应的研究极其有限。Fojtová等[12]在对植物端粒酶功能的研究中发现,镉胁迫对烟草细胞会造成氧化损伤,去除镉胁迫后,烟草细胞能够修复损伤阻止细胞凋亡,在修复阶段端粒酶活性明显升高。本实验室前期对沙冬青愈伤组织细胞的研究表明,在盐胁迫条件下沙冬青细胞端粒酶对避免细胞遭受不可逆损伤,保持染色体DNA稳定性具有一定的作用[13]。
胡杨(Populus euphratica)是荒漠和半荒漠地区唯一可形成森林的乔木树种,具有极强的盐碱适应性,是研究木本植物抗盐机制的理想材料[14]。对胡杨的抗盐机制研究主要集中在显微结构、离子运输、钙信号系统、ABA信号系统以及活性氧平衡等方面[15-20],关于盐胁迫、氧化应激和端粒酶活性的关系尚未见报道。本研究以抗盐性较强的胡杨与速生盐敏感性合作杨悬浮细胞为材料,检测不同盐胁迫下细胞生长、活性氧水平及端粒酶活性等变化,并检测H2O2处理对杨树细胞端粒酶活性的直接影响,旨在探讨盐胁迫、氧化损伤和端粒酶活性之间的关系,为胡杨抗盐机制的揭示提供新资料。
1 材料与方法 1.1 材料胡杨(Populus euphratica)悬浮细胞继代培养基:MS + 0.5 mg/mL 6-BA + 0.5 mg/mL NAA;合作杨(P. simonii×P. pyramibalis cv)悬浮细胞继代培养基:MS+0.5 mg/mL NAA+2 mg/mL 2,4-D,培养条件为25℃,摇床转数120 r/min,黑暗。
1.2 方法 1.2.1 细胞生长曲线的测定分别按1%比例将培养7 d的胡杨悬浮细胞和合作杨悬浮细胞放入40 mL液体培养基中,每2 d取样一次,测定其细胞鲜重,至悬浮培养的第15天,重复3次,绘制生长曲线。
1.2.2 盐胁迫处理将正常培养基上培养7 d的胡杨和合作杨悬浮细胞转入含有0、50、100、150、200、250、300 mmol/L NaCl的培养基中继续培养13 d,检测细胞活力、端粒酶活性及其他指标的变化,实验重复3次。
1.2.3 过氧化氢(H2O2)处理将正常培养基上培养7 d的胡杨和合作杨悬浮细胞转入含有0、5、10、20、50 mmol/L H2O2的培养基中处理24 h取样,检测端粒酶活性的变化,实验重复3次。
1.2.4 悬浮细胞活力测定将正常培养基上培养7 d的胡杨和合作杨悬浮细胞转入含有0、50、100、150、200、250、300 mmol/L NaCl的培养基中继续培养13 d,每2 d取一次样测定细胞活力。细胞活力的测定采用TTC(2,3,5-氯化三苯基四氮唑)法[21],取100 mg不同盐浓度处理的胡杨和合作杨愈伤加入10 mL离心管中,加入3 mL的TTC溶液(0.6%TTC,50 mmol/L PBS,pH7.4),避光,22℃孵育12 h,蒸馏水洗涤3次,500×g离心3 min,收集沉淀,加入3 mL 95%酒精重悬沉淀,置于60℃水浴锅水浴10 min,冷却至室温,分光光度计测定其在485 nm处的吸光值[22]。
1.2.5 超氧阴离子自由基测定取1 g悬浮细胞于研钵中,加入适量的65 mmol/L磷酸缓冲液(pH7.8),研磨成匀浆,定容至3 mL,四层纱布过滤,滤液4℃ 13 000 ×g离心20 min,取上清液1 mL,磷酸缓冲液1 mL,10 mmol/L盐酸羟胺2 mL,混合后25℃水浴1 h,取反应液2 mL,加入17 mmol/L对氨基苯磺酸2 mL和7 mmol/L α-萘胺2 mL,以加入2 mL蒸馏水作为空白对照,测定530 nm处的吸光值。用NaNO2作标准曲线,从标准曲线上求出O2.-的浓度,再换算成O2.-产生速率[23]。
1.2.6 丙二醛含量的测定取3 g悬浮细胞于预冷的研钵中,加入少许石英砂,分两次加入5 mL预冷的5% TCA(三氯乙酸)溶液,研磨至匀浆,钢网过滤,将滤液转移到15 mL离心管中,4℃ 3000 ×g离心15 min,取2 ml上清液,加入5 mL的0.5% TBA(硫代巴比妥酸)溶液,沸水浴15 min,立即放入冷水浴中。待冷却后,4℃ 3 000×g离心15 min,取3 mL上清液,分别测定532 nm、600 nm和450 nm处的吸光值[24]。
1.2.7 端粒酶活性测定TRAP法检测端粒酶活性[25],取0.3 g悬浮细胞于预冷的研钵中迅速研磨,加入800 μL预冷的CHAPS buffer,冰上裂解30 min,4℃ 16 000×g离心20 min,取上清,加入PEG 8000使其终浓度为10%,冰上沉淀30 min,每隔3-5 min颠倒混匀一次,4℃ 16 000 ×g离心10 min,弃上清,加入200 μL CHAPS buffer重悬沉淀,冰上静置30 min,4℃ 16 000×g离心10 min,取上清置于-80℃保存备用。
50 μL PCR反应体系:36 μL DEPC H2O,5 μL TRAP buffer,1 μL 10 mmol/L dNTP mixture,1 μL TS引物,5 μL上述端粒酶提取物,26℃反应45 min,94℃变性2 min,加入1.6 μL RP引物和0.4 μL Taq聚合酶,PCR扩增片段。
上述PCR产物进行12%非变性聚丙烯酰胺凝胶电泳,电泳结束后,将凝胶置于SYBR Green I染色液中,室温震荡染色30 min,置于凝胶成像仪下观察结果,用Quality one软件分析结果。
2 结果 2.1 胡杨和合作杨细胞生长特性在正常培养生长条件下,胡杨和合作杨悬浮细胞生长曲线都呈“S”型,继代5 d,开始进入对数生长期,9 d后生长缓慢,13 d之后开始衰亡,培养期间合作杨悬浮细胞生长量高于胡杨细胞(图 1)。
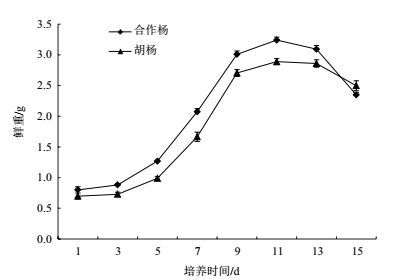
|
| 图 1 胡杨和合作杨细胞生长曲线 |
正常生长条件下(0 mmol/L)不论是胡杨还是合作杨,培养期间( < 13 d)悬浮细胞活力基本保持稳定(图 2);低浓度(50 mmol/L或100 mmol/L)NaCl处理,胡杨和合作杨悬浮细胞活力在培养初期( < 3 d)高于正常生长的悬浮细胞,随着处理时间延长,胡杨悬浮细胞7 d内依然保持了较高的细胞活力,而合作杨悬浮细胞在处理3 d后细胞活力就开始低于正常生长细胞。值得关注的是,随着NaCl处理浓度的升高(150-300 mmol/L),两种杨树的细胞活力产生不同变化:当盐浓度达150 mmol/L时,胡杨愈伤组织细胞9 d内仍能保持接近正常生长的细胞活力,而合作杨愈伤组织细胞活力在处理3 d后已经降低了31%;当NaCl处理浓度提高到200 mmol/L,胡杨愈伤组织细胞在处理7 d后仍能保持50%正常细胞活力,而合作杨愈伤组织细胞活力仅为对照组的21%;当NaCl处理浓度达到300 mmol/L,胡杨愈伤组织细胞在处理5 d后仍能保持10%正常细胞活力,而合作杨愈伤组织细胞生长基本停滞,活力接近消失(图 2)。

|
| 图 2 盐胁迫下胡杨(A)和合作杨(B)悬浮细胞活力的变化 |
非盐胁迫条件下,胡杨和合作杨悬浮细胞内超氧阴离子自由基含量均维持在一个相对稳定的水平,即使细胞生长进入衰亡期(13 d,图 1),超氧阴离子自由基含量也没有明显的变化。100-300 mmol/L盐处理13 d内使胡杨悬浮细胞超氧阴离子自由基含量随着盐浓度的增加而提高,其中在第7 d时达极显著水平(P < 0.01),此后随着培养时间延长至13 d,含量有降低趋势,但与正常培养细胞差异显著(P < 0.05),比对照增加了44.64%(图 3-A)。而合作杨悬浮细胞则表现不同,超氧阴离子自由基含量在100 mmol/L盐处理时随着盐处理时间延长增加,与正常培养细胞差异在13 d达到极显著水平(P < 0.01);200 mmol/L盐处理下合作杨悬浮细胞内超氧阴离子自由基含量增加,与正常培养细胞的差异在7 d时达到显著水平(P < 0.05),该水平一直维持到第13 d;当NaCl浓度达到300 mmol/L处理7 d时,合作杨悬浮细胞超氧阴离子自由基含量与对照(0 mmol/L)相同,盐胁迫至第13 d时超氧阴离子自由基含量比对照减少了42.54%(图 3-B)。盐处理使胡杨与合作杨悬浮细胞内超氧阴离子自由基含量的变化趋势明显不同,尤其是300 mmol/L盐处理下合作杨悬浮细胞内超氧阴离子自由基含量随着盐处理时间延长而减少,这与此时细胞活力的变化结果直接相关(图 2)。

|
| 图 3 盐胁迫对胡杨(A)和合作杨(B)悬浮培养细胞超氧阴离子自由基含量的影响 |
在无盐胁迫的正常生长条件下,不论胡杨还是合作杨,悬浮细胞中丙二醛(MDA)的含量相当,随着NaCl处理浓度增加和时间延长,胡杨和合作杨愈伤组织细胞中的MDA水平发生不同变化:100-200 mmol/L NaCl浓度处理7 d,合作杨悬浮细胞中的MDA含量增加幅度较大,100 mmol/L NaCl处理7 d比对照增加了137.45%(P < 0.05),之后MDA含量一直维持在较高水平;而100 mmol/L NaCl处理胡杨悬浮细胞MDA含量与对照差异不显著,随着盐处理浓度提高,MDA含量增加幅度较小;当NaCl浓度300 mmol/L处理13 d,胡杨悬浮细胞MDA含量与对照差异显著(P < 0.05),比对照增加61.92%;但300 mmol/L NaCl浓度处理使合作杨悬浮细胞中MDA含量随时间延长逐渐降低,至胁迫13 d时比正常水平降低了40.51%(图 4),其原因与此时的细胞活力极低密切相关(图 2),大部分细胞死亡,细胞生理活动减弱,这与超氧阴离子自由基的检测结果(图 3)较为一致。
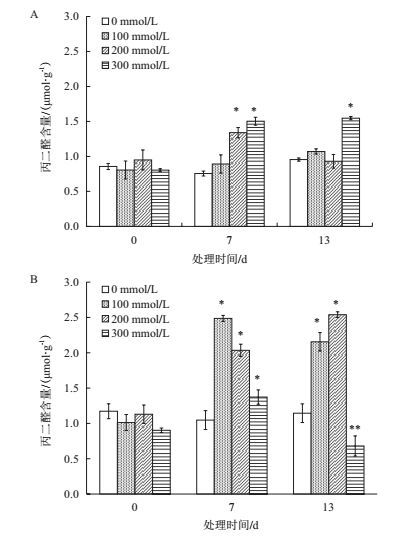
|
| 图 4 盐胁迫对胡杨(A)和合作杨(B)悬浮细胞丙二醛含量的影响 |
图 5-A和B结果显示,胡杨悬浮细胞端粒酶活性均高于合作杨悬浮细胞细胞。无盐胁迫处理条件下,胡杨和合作杨悬浮细胞端粒酶活性保持稳定;100 mmol/L NaCl处理7 d,胡杨悬浮细胞端粒酶活性提高约1.68倍(P < 0.01)(图 5-A、C),合作杨细胞提高约1.44倍(P < 0.05)(图 5-B、D),至盐处理13 d,胡杨细胞端粒酶活性升高为对照的1.71倍,而合作杨悬浮细胞端粒酶为对照1.27倍;200 mmol/L NaCl处理时,胡杨与合作杨细胞端粒酶活性均下降,但不同处理间差异不显著;但当盐浓度达到300 mmol/L时,在处理13 d内胡杨悬浮细胞端粒酶活性与对照差异不显著(图 5-A、C),而合作杨在盐胁迫13 d时悬浮细胞端粒酶活性比对照下降了31.40%(图 5-B、D),这也进一步说明,200-300 mmol/L NaCl处理均导致胡杨和合作杨悬浮细胞端粒酶活性降低,但合作杨降低的程度更大。
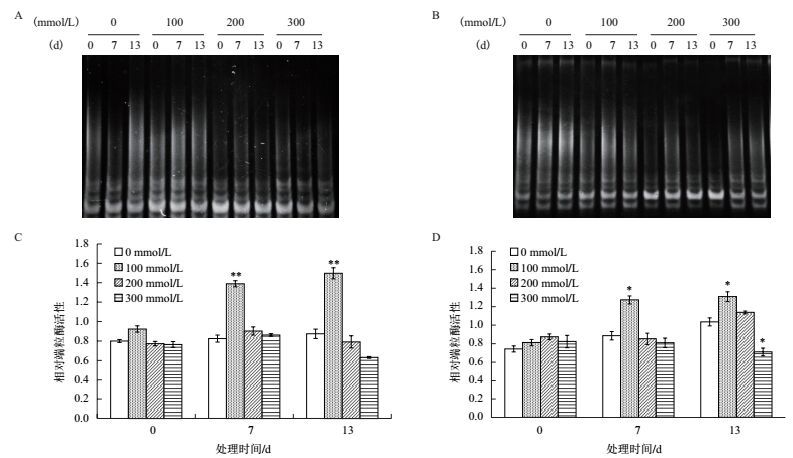
|
| 图 5 盐胁迫下胡杨和合作杨悬浮细胞端粒酶活性变化 A、C:胡杨;B、D:合作杨 |
为了确定端粒酶活性是否受到自由基的影响,本研究用不同浓度的过氧化氢(H2O2)处理胡杨和合作杨悬浮细胞24 h,实验结果(图 6-A和B)显示,不同浓度H2O2氧化胁迫胡杨悬浮细胞端粒酶活性均高于合作杨细胞;图 6-C和图 6-D显示在10 mmol/L和20 mmol/L H2O2处理下,胡杨悬浮细胞端粒酶活性为非胁迫条件下的1.79倍,差异显著(P < 0.05),在50 mmol/L H2O处理下,胡杨悬浮细胞端粒酶活性降到对照水平;H2O2氧化胁迫下合作杨悬浮细胞端粒酶活性均略有升高,但变化不显著。以上结果说明,胡杨悬浮细胞端粒酶对自由基敏感,一定浓度的H2O2能刺激提高端粒酶活性。

|
| 图 6 过氧化氢对胡杨和合作杨悬浮细胞端粒酶活性的影响 A、C:胡杨;B、D:合作杨 |
盐胁迫导致植物细胞内产生大量活性氧(Reactive oxygen species,ROS)[26],高浓度的活性氧进一步攻击DNA、蛋白质及细胞质膜,造成氧化损伤[27],膜脂过氧化产物丙二醛含量增多[28-30]。本研究结果表明,不同浓度(0-300 mmol/L NaCl)盐处理不同时间在胡杨细胞中丙二醛的水平普遍低于合作杨细胞,100 mmol/L盐处理7 d合作杨悬浮细胞内丙二醛含量即达到对照的2.46倍,说明此时合作杨悬浮细胞已经受到较严重氧化损伤,而在100 mmol/L盐处理13 d胡杨细胞内丙二醛含量依然维持在一个相对较低水平;300 mmol/L盐处理下,合作杨悬浮细胞内丙二醛含量却低于胡杨细胞,至胁迫13 d时甚至比正常水平降低了40.51%,此时合作杨悬浮细胞几乎检测不到细胞活力,细胞生长基本停滞,细胞的大量死亡导致检测到的合作杨悬浮细胞内丙二醛含量较低。与丙二醛检测结果稍有不同,胡杨细胞超氧阴离子自由基含量略高于合作杨细胞,而且不同盐浓度(0-300 mmol/L)处理不同胁迫时间(0-13 d)均呈现梯度上升趋势。已有研究发现,当ROS水平超出防御机制所及范围,细胞就处于氧化胁迫状态,但在低浓度下,ROS能在植物细胞信号转导途径中作为第二信使介导植物对激素或环境胁迫的多种应答反应[26]。胡杨细胞内不同盐浓度(0-300 mmol/L)处理7 d超氧阴离子自由基含量较高,可能对胡杨细胞信号转导起到一定作用;而在300 mmol/L高浓度盐处理7 d胡杨细胞保持了一定活力,即使到第13 d细胞活力仍为对照的3.8%,而合作杨在200-300 mmol/L高浓度盐处理第7 d细胞活力已近消失。Li等[31]发现,高浓度NaCl处理导致水稻根尖细胞发生程序性死亡,因此本研究结果表明,胡杨悬浮细胞抵抗盐胁迫导致的氧化损伤能力较强,而合作杨对盐胁迫则较敏感。
氧化损伤不仅使细胞生长受阻并能诱导程序化死亡(PCD),最终导致细胞死亡[32]。本研究结果表明,100 mmol/L NaCl浓度处理13 d,胡杨悬浮细胞超氧阴离子自由基含量大幅提高的同时,丙二醛(MDA)含量基本不变,细胞活力与对照(0 mmol/L)细胞相当,此时端粒酶活性增强;然而,100 mmol/L NaCl浓度处理合作杨悬浮细胞13 d时端粒酶活性仅比对照提高26.31%,随着盐处理时间延长端粒酶活性降低,超氧阴离子自由基和MDA含量显著增加,细胞活力在处理7 d仅为对照86.96%,以后持续降低,说明100 mmol/L NaCl盐处理13 d没有造成胡杨悬浮细胞损伤,而合作杨已受到明显的盐胁迫氧化损伤,说明胡杨悬浮细胞端粒酶活性的提高对减轻低浓度盐胁迫导致的氧化损伤起到了一定作用。端粒酶在真核生物细胞抵抗氧化损伤和DNA修复方面发挥重要作用。与染色体其他部位相比,端粒重复序列富含鸟嘌呤且位于染色体末端,更容易遭受活性氧的攻击产生DNA损伤,DNA氧化损伤导致端粒缩短,影响染色体稳定性[3, 4]。成纤维细胞过表达人端粒酶逆转录酶基因(hTERT)提高了细胞内脱氧核苷酸(dNTP)和核苷酸(NTPs)的水平,进而提高了DNA损伤修复的能力[33]。Akiyama[8]等对Y79成视网膜细胞瘤细胞的研究中发现,2-5 Gy红外辐射引起的DNA损伤能够提高细胞内端粒酶活性,大于10 Gy红外辐射引起的DNA损伤导致端粒酶活性下降。本研究中,与低浓度(100 mmol/L)相比,NaCl浓度超过200 mmol/L,胡杨悬浮细胞端粒酶活性降低,细胞内氧化损伤程度提高。前人的研究及本实验结果表明,端粒酶抵御氧化损伤的作用具有一定限度。
过氧化氢所产生的羟自由基可造成单链或双链的DNA氧化损伤[34]。10 mmol/L和20 mmol/L H2O2处理下,胡杨悬浮细胞端粒酶活性达到了正常水平的1.79倍,与100 mmol/L盐胁迫处理下端粒酶活性变化趋势一致,表明端粒酶活性的提高可能是自由基直接刺激的结果。无论是NaCl还是H2O2处理,抗盐性较强的胡杨悬浮细胞端粒酶活性都高于盐敏感的合作杨,H2O2浓度小于20 mmol/L,胡杨悬浮细胞端粒酶活性随H2O2浓度增加而提高,H2O2浓度达到50 mmol/L,端粒酶活性降低,与200 mmol/L盐胁迫处理下端粒酶活性变化结果一致;而合作杨悬浮细胞经5-50 mmol/L H2O2处理后端粒酶活性变化不显著。综合分析前人研究及本文对两种杨树的实验数据,可以作出以下推测:低浓度NaCl胁迫引起细胞内自由基升高,而H2O2等自由基作为信号分子激活或提高端粒酶活性,增强细胞抵御盐胁迫的能力;高浓度NaCl胁迫会导致自由基急剧上升,超越了细胞的防御能力,端粒酶活性下降,DNA及其他细胞组分被氧化降解。胡杨耐盐性高于合作杨,端粒酶活性对盐胁迫响应机制的不同可能是导致两种杨树抗盐性不同的原因之一。
4 结论NaCl胁迫引起胡杨细胞内自由基含量升高幅度大于合作杨,而膜脂过氧化程度却低于合作杨;10 mmol/L和20 mmol/L H2O2处理提高胡杨细胞端粒酶活性,而合作杨端粒酶对H2O2不敏感。在NaCl胁迫下胡杨细胞端粒酶对H2O2信号系统响应迅速,这可能是其抗盐性高于合作杨的机制之一。
| [1] | Gupta B, Huang B. Mechanism of salinity tolerance in plants:phy-siological, biochemical, and molecular characterization[J]. Inter-national Journal of Genomics, 2014 . DOI:10.1155/2014/701596 |
| [2] | Rodriguez P, Torrecillas A, Morales MA, et al. Effects of NaCl salinity and water stress on growth and leaf water relations of Asteriscus maritimus plants[J]. Environmental and Experimental Botany, 2005, 53 (2): 113–123. DOI:10.1016/j.envexpbot.2004.03.005 |
| [3] | Jurk D, Wilson C, Passos JF, et al. Chronic inflammation induces telomere dysfunction and accelerates ageing in mice[J]. Nature Communications, 2014, 2 : 4172. |
| [4] | Fouquerel E, Lormand J, Bose A, et al. Oxidative guanine base damage regulates human telomerase activity[J]. Nature Structural & Molecular Biology, 2016, 23 : 1092–1100. |
| [5] | Nelson ADL, Beilstein MA, Shippen DE. Plant telomeres and telomerase[M]. Molecular Biology. Springer New York: 2014: 25-49. |
| [6] | Lu C, Fu W, Mattson MP. Telomerase protects developing neurons against DNA damage-induced cell death[J]. Developmental Brain Research, 2001, 131 (1): 167–171. |
| [7] | Shin KH, Kang MK, Dicterow E, et al. Introduction of human telomerase reverse transcriptase to normal human fibroblasts enhances DNA repair capacity[J]. Clinical Cancer Research, 2004, 10 (7): 2551–2560. DOI:10.1158/1078-0432.CCR-0669-3 |
| [8] | Akiyama M, Ozaki K, Kawano T, et al. Telomerase activation as a repair response to radiation-induced DNA damage in Y79 retinoblastoma cells[J]. Cancer Letters, 2013, 340 (1): 82–87. DOI:10.1016/j.canlet.2013.07.003 |
| [9] | Kaloyianni M, Pouikli A, Kyrka L, et al. Telomerase overexpression in human mesenchymal stem cells offers protection against oxidative DNA damage accumulation[J]. Cytotherapy, 2015, 17 (6): S34–S35. |
| [10] | Haendeler J, Dröse S, Büchner N, et al. Mitochondrial telomerase reverse transcriptase binds to and protects mitochondrial DNA and function from damage[J]. Arterioscler Thromb Vasc Biol, 2009, 29 (6): 929–35. DOI:10.1161/ATVBAHA.109.185546 |
| [11] | Ahmed S, Passos JF, Birket MJ, et al. Telomerase does not counteract telomere shortening but protects mitochondrial function under oxidative stress[J]. Journal of Cell Science, 2008, 121 (7): 1046–1053. DOI:10.1242/jcs.019372 |
| [12] | Fojtová M, Fulne?ková J, Fajkus J, et al. Recovery of tobacco cells from cadmium stress is accompanied by DNA repair and increased telomerase activity[J]. Journal of Experimental Botany, 2002, 53 (378): 2151–2158. DOI:10.1093/jxb/erf080 |
| [13] | 张徐俞, 王瑾瑜, 郑广顺, 等. 盐胁迫下沙冬青细胞端粒酶活性的变化与DNA稳定性的关系[J]. 生物技术通报, 2014(10): 134–138. |
| [14] | 戴松香, 陈少良, FritzE, 等. 盐胁迫下胡杨和毛白杨叶细胞中的离子区隔化[J]. 北京林业大学学报, 2006, 28(2): 1–5. |
| [15] | Chen S, Li J, Wang S, et al. Salt, nutrient uptake and transport, and ABA of Populus euphratica; a hybrid in response to increasing soil NaCl[J]. Trees, 2001, 15 (3): 186–194. DOI:10.1007/s004680100091 |
| [16] | Junghans U, Polle A, Düchting P, et al. Adaptation to high salinity in poplar involves changes in xylem anatomy and auxin physiology[J]. Plant, Cell & Environment, 2006, 29 (8): 1519–1531. |
| [17] | Yang Y, Zhang F, Zhao M, et al. Properties of plasma membrane H+-ATPase in salt-treated Populus euphratica callus[J]. Plant Cell Reports, 2007, 26 (2): 229. DOI:10.1007/s00299-006-0220-8 |
| [18] | Wang R, Chen S, Zhou X, et al. Ionic homeostasis and reactive oxygen species control in leaves and xylem sap of two poplars subjected to NaCl stress[J]. Tree Physiology, 2008, 28 (6): 947–957. DOI:10.1093/treephys/28.6.947 |
| [19] | Zhang H, Yin W, Xia X. Calcineurin B-Like family in Populus:comparative genome analysis and expression pattern under cold, drought and salt stress treatment[J]. Plant Growth Regulation, 2008, 56 (2): 129–140. DOI:10.1007/s10725-008-9293-4 |
| [20] | Chen S, Polle A. Salinity tolerance of Populus[J]. Plant Biology, 2010, 12 (2): 317–333. |
| [21] | 卢骁, 兰小中, 杨凤娇, 等. 喜马拉雅紫茉莉瘦果粘液对种子低温萌发的保护[J]. 草地学报, 2014, 22(6): 1281–1287. |
| [22] | 何国维, 李伟光, 王瑞雪, 等. 利用2, 3, 5-三苯基氯化四氮唑(TTC)测定细胞活力的方法与应用[J]. 军事医学, 2014(5): 388–391. |
| [23] | 李忠光, 龚明. 植物中超氧阴离子自由基测定方法的改进[J]. 云南植物研究, 2005(2): 211–216. |
| [24] | 陈禹兴, 付连双, 王晓楠, 等. 低温胁迫对冬小麦恢复生长后植株细胞膜透性和丙二醛含量的影响[J]. 东北农业大学学报, 2010(10): 10–16. DOI:10.3969/j.issn.1005-9369.2010.10.003 |
| [25] | 王瑾瑜, 张徐俞, 王雅群, 等. 用改进的TRAP法测定树木端粒酶活性[J]. 应用与环境生物学报, 2012(4): 682–686. |
| [26] | Baxter A, Mittler R, Suzuki N. ROS as key players in plant stress signaling[J]. Journal of Experimental Botany, 2014, 65 (5): 1229–1240. DOI:10.1093/jxb/ert375 |
| [27] | Miller G, Shulaev V, Mittler R. Reactive oxygen signaling and abiotic stress[J]. Physiologia Plantarum, 2008, 133 (3): 481–489. DOI:10.1111/j.1399-3054.2008.01090.x |
| [28] | Ksouri R, Megdiche W, Debez A, et al. Salinity effects on polyphenol content and antioxidant activities in leaves of the halophyte Cakile maritima[J]. Plant Physiology and Biochemistry, 2007, 45 (3): 244–249. |
| [29] | 乔佩, 卢存福, 李红梅, 等. 盐胁迫对诱变小麦种子萌发及幼苗生理特性的影响[J]. 中国生态农业学报, 2013(6): 720–727. |
| [30] | Puyang X, An M, Han L, et al. Protective effect of spermidine on salt stress induced oxidative damage in two Kentucky bluegrass(Poa pratensis L.)cultivars[J]. Ecotoxicology and Environmental Safety, 2015, 117 : 96–106. DOI:10.1016/j.ecoenv.2015.03.023 |
| [31] | Li JY, Jiang AL, Zhang W. Salt stress-induced programmed cell death in rice root tip cells[J]. Journal of Integrative Plant Biology, 2007, 49 (4): 481–486. DOI:10.1111/jipb.2007.49.issue-4 |
| [32] | Pan J, Zhu M, Chen H. Aluminum-induced cell death in root-tip cells of barley[J]. Environmental and Experimental Botany, 2001, 46 (1): 71–79. DOI:10.1016/S0098-8472(01)00083-1 |
| [33] | Sharma GG, Gupta A, Wang H, et al. hTERT associates with human telomeres and enhances genomic stability and DNA repair[J]. Oncogene, 2003, 22 (1): 131–146. DOI:10.1038/sj.onc.1206063 |
| [34] | Kim SY, Kim RH, Huh TL. α-Phenyl-N-t-butylnitrone protects oxidative damage to HepG2 cells[J]. Journal of Biochemistry and Molecular Biology, 2000, 34 (1): 43–46. |




