2014年环境保护部和国土资源部公布《全国土壤污染状况调查公报》显示全国耕地土壤点位污染物超标率为19.4%,主要污染物为镉、镍、铜、砷、汞、铅、滴滴涕和多环芳烃,其中土壤镉超标率达7.0%。镉(Cd)是人类和动、植物最具有毒性的重金属污染物之一。土壤中过量的镉通过植物根系吸收对植物产生一些系列毒害的症状,包括叶片失绿、萎蔫、矿质元素代谢和碳水化合物代谢紊乱,导致植物的生长缓慢,光合结构受损进而使农作物产量和质量下降[1]。作物吸收镉再通过食物链向人类转移风险也是当今社会高度关注的问题。
不同植物物种对镉耐性不同,有些植物相对敏感,有些植物可以较好的积累镉起到修复作用。植物在长期的进化过程形成一些耐镉的机制,第一道屏障是细胞壁。一旦镉进入细胞质,植物螯合肽将与之结合[2]。此外,一些信号分子,如水杨酸、茉莉酸等参与植物的耐镉响应。水杨酸(SA)是一种酚类化合物,广泛分布于各种植物中。SA在植物中起着至关重要的作用,如种子萌发,光合作用,气孔关闭,呼吸作用,开花,衰老过程[3]。研究表明SA在许多植物中起到提高生物和非生物胁迫耐受性的作用。近年来,SA在镉耐受中的作用广受关注。SA通过稳定细胞膜的完整性、改变镉的吸收和分布、增强抗氧化防御系统和提高光合作用增强植物的耐镉能力[4]。然而,SA对植物缓解镉胁迫的作用机制尚不完全清楚[5]。本研究以新麦18为材料,利用叶绿素荧光手段探讨SA减缓小麦镉伤害的机制,为小麦适应镉污染土壤环境提供理论依据。
1 材料与方法 1.1 材料以新麦18为实验材料,小麦种子由安徽农业大学提供。
1.2 方法 1.2.1 处理方法小麦籽粒用30% H2O2消毒15 min,经去离子水充分冲洗后,种子在20℃蒸馏水中浸泡20 h,在恒温培养箱中20℃黑暗催芽5 d。待露白后,挑选长势良好的种子播种于盛有蛭石的白瓷盘中,在具有光照装置的培养箱中培养。培养条件:20℃,湿度57%,450 µmol.m-2. s-光照12 h。培养过程中,每隔2 d更换1次培养液(pH为5.5)。待幼苗长至三叶期转到培养盘(直径10 cm,高15 cm)用Hogland溶液进行培养。根据Tamas等[6]的研究,采用CdCl2(500 µmol/L CdCl2·2.5 H2O/L)进行小麦重金属胁迫处理。取4种不同SA浓度(100 µmol/L、250 µmol/L、500 µmol/L和750 µmol/L)处理镉胁迫小麦,28 d后测定根长,确定SA最优处理浓度。培养28 d,测定小麦根部镉含量,叶片叶绿素含量及荧光参数,实验重复3次。
1.2.2 镉含量测定称取样品1 g根(干重)粉粹于25 mL三角瓶,加入10 mL HNO3-HClO4混合酸(优级纯,体积比4:1) 冷消化过夜。次日,将三角瓶置于砂浴上,在170±5℃下消化,至溶液变为无色透明。稍冷却后,分别加两次约1 mL的蒸馏水排酸。蒸发浓缩消化液至2 mL左右,用5%的HCl转移并定容至10 mL比色管,用AA7003原子吸收光谱仪测定镉含量[7]。
1.2.3 叶绿素含量的测定根据Arnon[8]的方法测定,将小麦叶圆片浸于无水乙醇中,放置于黑暗中,待叶圆片完全脱色,用UV-754型分光光度计进行测定。
1.2.4 叶片叶绿素荧光参数测定参照Ruan等[9]的方法,将小麦叶片暗适应30 min后,用PAM荧光仪(PAM-2100) 测定光化学效率(Fv/Fm)、光化学猝灭系数(qP)、实际光化学效率(φPSⅡ)和非光化学猝灭系数(qN)。
1.2.5 数据处理采用EXCEAL 2003与SPSS 13.0软件对数据进行处理与分析。
2 结果 2.1 水杨酸对镉胁迫小麦根系生长的影响重金属镉抑制了小麦的根系生长。试验结果(图 1) 显示,与CK相比,Cd处理小麦根长下降了32.4%。,施用不同浓度的SA可以有效的缓解小麦根部的镉胁迫毒害症状,镉胁迫条件下,小麦根长随水杨酸浓度增加而增加,SA3和SA4处理,根长分别较Cd处理增长了46.1%和44.7%,但SA4处理与SA3处理差异不显著(P > 0.05),故SA3处理浓度是缓解小麦镉毒害处理的较适宜浓度。
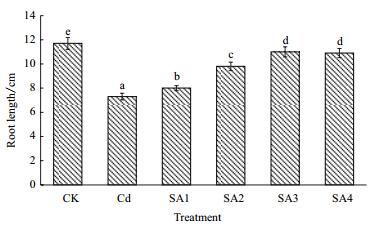
|
| 图 1 水杨酸对镉胁迫小麦根系生长的影响 不同英文字母表示不同处理间存在显著差异(P < 0.05),下同 |
根系直接暴露于镉污染环境中,根系细胞中镉的分布关系到镉对植物的毒性,同时对镉向地上部的转运有重要影响。如图 2所示,在水杨酸处理条件下,SA小麦根系的镉含量明显下降,其根系的镉含量较CK下降了41.3%。结果表明,水杨酸处理阻止了小麦对镉吸收,从而减轻镉对小麦组织机构的损伤。
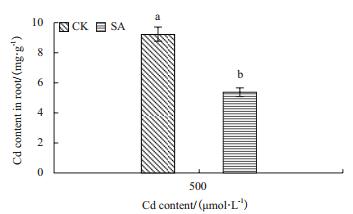
|
| 图 2 水杨酸对镉胁迫小麦根系镉含量的影响 |
叶绿素含量的变化规律是反映了植物叶片生理活性的重要指标之一,与叶片光合能力存在紧密的相关性。非镉胁迫条件下,水杨酸处理提高了叶片中叶绿素含量,但差异不显著。在镉胁迫条件下,小麦叶绿素含量发生不同程度的下降,CK叶绿素含量下降了高达30.9%,而水杨酸处理组SA叶绿素含量仅下降了13.3%(图 3)。
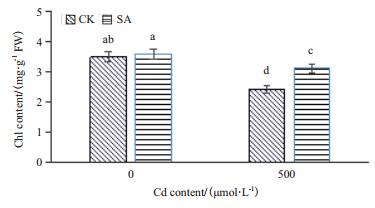
|
| 图 3 水杨酸对镉胁迫小麦叶绿素含量的影响 |
叶绿素荧光技术是快速检测植物光合机构损伤程度的最灵敏探针,它有效地反映了逆境下植物光合系统所受的伤害,也是评估镉活性的良好指标。在镉胁迫条件下,CK的Fv/Fm、φPSⅡ、qP和qN分别下降了28.4%、21.2%、33.3%和32.9%,而水杨酸处理组SA的Fv/Fm、φPSⅡ、qP和qN仅分别下降了11.6%、9.0%、10.9%和11.3%(图 4)。
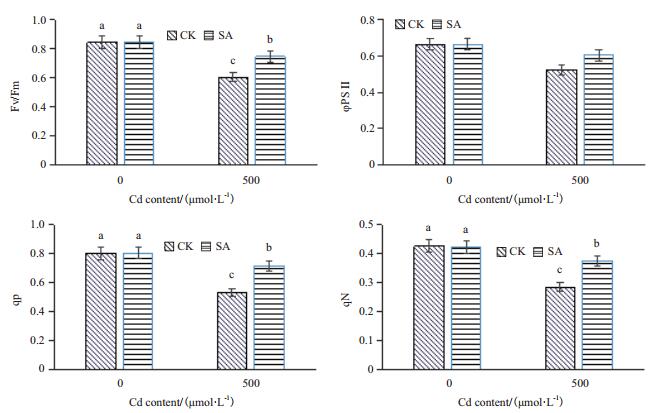
|
| 图 4 水杨酸对镉胁迫小麦叶绿素荧光参数的影响 |
镉是一种严重限制作物生长重金属,镉毒害导致叶绿素的降解、碳同化的抑制以及合电子传递下降,进而造成植物的光合能力下降[1]。水杨酸作为一种信号物质,对重金属危害起到很好的减缓作用[3]。本研究表明在镉胁迫条件,小麦种子经过水杨酸处理可以有效的降低根系镉含量,这一结果和Choudhury和Panda[10]研究相一致。叶绿素在光合作用过程中将光能转换为化学能,其含量高低与光合作用密切相关。镉胁迫常导致叶绿素的下降,进而导致光合速率下降。这主要是由于镉提高了叶绿素降解酶的活性或降低了参与叶绿素生物合成的δ氨基乙酰丙酸和原叶绿素酸酯还原酶复合体的合成[11]。镉胁迫条件下,经过水杨酸处理,小麦叶绿素含量下降的幅度明显低于CK。这可能是水杨酸阻止了镉的吸收减轻了镉对小麦根系的损伤,使其有效的吸收矿质元素和水分而能较强的光合作用的主要原因之一。
利用叶绿素荧光动力学方法可以快速、灵敏、无损伤地研究和探测各种逆境对PSII的影响。本研究通过叶绿素荧光参数分析显示镉抑制植物的PSII的光化学活性,这与Zhang等[5]研究结果是相一致的。水杨酸处理镉胁迫的小麦显著减缓了Fv/Fm、φPSⅡ和qP下降幅度,这表明在水杨酸处理后可以有效减缓镉胁迫,因此SA处理小麦的PSⅡ天线色素吸收的光能较多的用于光化学反应,表现出较高的光能转化效率。与此同时,SA处理镉胁迫的小麦qN也得到了一定程度的恢复,反映了PSⅡ天线色素吸收的光能不能用于光合电子传递部分可以热的形式及时进行耗散,起到对镉胁迫的光合机构的保护作用。
4 结论镉胁迫显著抑制了小麦的生长及光合作用,外源施用水杨酸能够有效提高小麦的耐镉性。实验确定水杨酸最佳处理浓度为500 µmol/L。外源水杨酸处理显著降低了小麦根系镉含量,提高了小麦的光能利用率。本实验表明外源水杨酸施用具有提高小麦的耐镉能力的作用。
| [1] | Azevedo H, Pinto G, Fernandes J, et al. Cadmium effects on sunflower:growth and photosynthesis[J]. J. Plant Nutr, 2005, 28: 2211–2220. DOI:10.1080/01904160500324782 |
| [2] | A Metwally VI, Safronova AA, Belimov KJ, et al. Genotypic variation of theresponse to cadmium toxicity in Pisum sativum L[J]. J Exp Bot, 2005, 56: 167–178. |
| [3] | Rivas-San Vicente M, Plasencia J. Salicylic acid beyond defence:its role in plant growth and development[J]. J Exp Bot, 2011, 62: 3321–3338. DOI:10.1093/jxb/err031 |
| [4] | Khan MIR, Asgher M, Khan NA. Alleviation of salt-induced photosynthesis and growth inhibition by salicylic acid involves glycinebetaine and ethylene in mungbean(Vigna radiata L.)[J]. Plant Physiol Biochem, 2014, 80: 67–74. DOI:10.1016/j.plaphy.2014.03.026 |
| [5] | Zhang Y, Xu S, Yang S, et al. Salicylic acid alleviates cadmium-induced inhibition of growth and photosynthesis through upregulating antioxidant defense system in two melon cultivars(Cucumis melo L.)[J]. Protoplasma, 2015, 252: 911–924. DOI:10.1007/s00709-014-0732-y |
| [6] | Tamas L, Durcekova K, Haluskova L, et al. Rhizosohere local ized cationic peroxidase from barley roots is strongly activated cadmium and correlated with root growth inhibition[J]. Chemosphere, 2007, 66: 1292–1300. DOI:10.1016/j.chemosphere.2006.07.023 |
| [7] | 刘春梅, 罗盛国, 刘元. 硒对镉胁迫下寒地水稻镉含量与分配的影响[J]. 植物营养与肥料学报, 2015, 21: 190–199. DOI:10.11674/zwyf.2015.0121 |
| [8] | Arnon DI. Copper enzymes in isolated chloroplast:Polyphenolox-ydase in Beta vulgaris[J]. Plant Physiol, 1949, 24: 1–15. DOI:10.1104/pp.24.1.1 |
| [9] | Ruan L, Chen LJ, Chen YH, et al. Expression of Arabidopsis HOMEODOMAIN GLABROUS 11 enhances tolerance to drought stress in transgenic sweet potato plants[J]. J Plant Biol, 2012, 55: 151–158. DOI:10.1007/s12374-011-9198-z |
| [10] | Choudhury S, Panda SK. Role of salicylic acid in regulatingcad-mium induced oxidative stress in Oryza sativa L. roots[J]. Bulg J Plant Physiol, 2004, 30: 95–110. |
| [11] | Van Assche F, Clijsters H. Effects of heavy metals on enzyme activity in plants[J]. Plant Cell Environ, 1990, 13: 195–206. DOI:10.1111/pce.1990.13.issue-3 |


