2. 昆明理工大学建筑与城市规划学院,昆明 650500;
3. 云南农业大学园林园艺学院,昆明 650201;
4. 云南师范大学生命科学院,昆明 650500
2. Faculty of Architecture and City Planning, Kunming University of Science and Technology, Kunming 650500;
3. Faculty of Landscape and Horticulture, Yunnan Agricultural University, Kunming 650201;
4. School of Life Sciences, Yunnan Normal University, Kunming 650500
短链还原酶家族(Short-chain dehydrogenases/reductases,SDRs)是迄今为止发现的最古老、最大的蛋白质超家族之一,存在各种生物形式中,如古细菌,原核生物,真核生物和病毒等[1-2]。SDR家族成员在脂类、氨基酸、碳水化合物、激素类、异生物质代谢和氧化还原反应传感机制中发挥重要作用。它们通常催化NADP(H)依赖的反应,其底物包括多元醇、类维生素A、类固醇、脂肪酸的衍生物和异源物质等[3-4]。已报到的SDRs具有广泛的生物学功能,不仅通过参与许多重要内固醇化合物的合成来调控植物生长发育,如油菜素内酯和强心苷等,还参与植物的胁迫应答。半定量RT-PCR分析证实,在草莓果实发育过程中,草莓短链还原酶基因FaSDR的表达量随着果实的着色快速升高,揭示该基因可能参与草莓果实成熟调控[5]。拟南芥的一个短链还原酶基因AtHSD1通过调节油菜素内酯生物合成,来调控植物的生长和发育[6, 7]。类固醇5α-还原酶(DET2)也属于SDR家族一员,是油菜素类固醇物质生物合成途径的限速酶,GbDET2基因在棉花纤维的起始和快速伸长过程中发挥着重要的作用[8]。从甘蓝型油菜中克隆的β-酮脂酰辅酶A还原酶基因BnKCR1和BnKCR2在植株中普遍表达,并在种子与根系中的表达最丰富,在酵母中异源表达这两个基因恢复了酵母脂肪酸延长酶的活性[9]。胡椒(CaMNR1)和拟南芥(AtSDR1)中的薄荷酮新薄荷醇还原酶(MNR)基因增强了植物对多种病原菌的抗性[10]。
类固醇5β还原酶5β-StR(3-o-Δ4,5 steroid 5β-reductase)也是SDR家族的一员,能够催化多种类固醇基质,在内固醇化合物生物合成途径上发挥作用。目前对于植物5β-StR的研究报道较少,Herl等[11]在2009年报道了一个拟南芥内固醇5β还原酶基因At5β-StR,其蛋白序列和三维模型都与毛花洋地黄(Digitalis lanata)黄体酮5β还原酶(Dl5β-POR)相似度较高,5β-POR是一种类固醇化合物—强心苷生物合成途径上的重要催化酶。半定量RT-PCR发现拟南芥At5β-StR在茎和根中表达量最高,并且在甘露醇诱导20 h后的表达明显增强,推测At5β-StR还参与植物渗透胁迫调控。同年,Edyta等[12]研究报道5β-StR因为其碳碳双键活性,所以催化能力要强于5β-POR。
小桐子(Jatropha curcas L.)又叫做膏桐、小油桐、老胖果、油芦子、麻疯树等。原产热带美洲,分布于我国广东、云南、四川、贵州、广西等省区[13]。小桐子果实含油率高达60%,可以提练出不含硫、无污染、符合欧四排放标准的生物柴油,是中国重点开发的绿色能源树种[14]。小桐子不择土壤,耐干旱瘠薄,又是干热河谷地区荒山造林的优良树种,具有广泛的开发利用前景[15-16]。本研究从小桐子中克隆得到一个类固醇5β还原酶基因Jc5β-StR,进行蛋白质序列和功能结构上的探讨,并分析其在不同组织和非生物胁迫下的表达变化,以期为进一步研究5β-StR基因的作用奠定基础。
1 材料与方法 1.1 材料供试材料小桐子(Jatropha curcas L.)取自于云南省昆明市昆明理工大学现代农业工程学院实验基地。取小桐子根、茎、叶、花、果皮和授粉后不同发育阶段(10、20、30、40、50和60 d)的种子,立即液氮速冻后保存在-80℃的环境中备用。每种组织从10株小桐子树上取样,来源于3株树上的组织混合作为1个组织样品,4次重复。
实验处理材料为稳定成熟期的小桐子幼苗,取长势基本一致的小桐子幼苗分别放置于NaCl(250 mmol/L)培养液、30% PEG 6000培养液和4℃培养箱中,机械损伤用消过毒的剪刀在每个小桐子叶片上各剪5下,注意不要剪断叶片主脉。4种处理后的0(对照)、3、6、12和24 h取幼嫩的叶片。各处理3次重复,材料用锡箔纸包好,立即液氮速冻后保存在-80℃的环境中备用。
1.2 方法 1.2.1 RNA的提取和cDNA第一链的合成小桐子RNA用TianGen公司植物总RNA提取试剂盒(RNAprep pure Kit,DP432) 提取,cDNA链合成用大连宝生物公司(TaKaRa PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit)试剂盒,操作过程参考说明。产物放置于-20℃备用。
1.2.2 基因克隆Jc5β-StR基因克隆特异引物设计为Jc5β-StR-F(5' -CCTCAGCCACCAACTACTA-3' )和Jc5β-StR-R(5' -GTTCAAATCAAGGCACAAT-3' ),PCR扩增用大连宝生物公司的Taq酶(TaKaRa Ex Taq Hot Start Version)和5×PCR buffer,cDNA模板加入量为2 μL,操作过程均参考说明。PCR反应程序:94℃预变性5 min,94℃变性30 s,54℃退火30 s,72℃延伸40 s,35个循环,72℃延伸5 min。将PCR产物连接到pMD18-T并双向测序,每个基因至少5个克隆。
1.2.3 cDNA序列及其编码氨基酸分析用NCBI网站中的ORF finder找出基因的开放读码框(open reading frame,ORF)和其BLASTp程序进行同源性分析; 用DNAMAN软件进行核酸翻译和多序列对比,采用MEGA7.0 Neighbor-joining方法构建进化树进行亲缘关系分析。利用ProtParam在线软件分析氨基酸残基数目、组成和蛋白质的基本性质等参数。利用ExPASy在线分析蛋白质一级结构和预测蛋白质功能位点。通过在线软件SOPMA预测蛋白质二级结构。用Modeling程序(http://swissmodel.expasy.org/)对蛋白质的三级结构进行预测。跨膜结构预测用TMHMM-2.0 server,信号肽预测用SignalP。
1.2.4 基因的表达分析用实时荧光定量PCR方法进行基因表达分析。根据测序结果设计特异引物序列为Jc5β-StR-qF(5' -GATTTGCCCAGATTAGACG-CT-3' )和Jc5β-StR-qR(5' -CAATCCCTCCTTCTTCGC-TAC-3' )。内参基因序列设计为β-actin-F(5' -GCAG-GCATCCACGAGACTACT-3' )和β-actin-R(5' -GTCA-GCAATACCAGGGAACATAG-3' )。分别对反转录后不同组织和不同处理材料叶片cDNA进行实时荧光定量PCR分析。反应体系为:2 μL cDNA模板、12.5 μL Premix TaqTM、0.5 μL Jc5β-StR-qF、0.5 μL Jc5β-StR-qR、加dd H2O至25 μL。PCR反应条件为:94℃预变性3 min,94℃预变性30 s,59℃退火1 min,72℃延伸30 s,72℃延伸5 min,35个循环。根据厂商推荐,在罗氏LightCycler 480系统上进行。每个材料做3次独立重复,采用2-ΔΔCT方法分析处理数据,在组织表达分析中用表达量最低的组织作为校正子,在种子发育过程中的时序表达分析用第一发育阶段(10 d)的样品做校正子[17]。用SPSS软件进行显著性分析,Excel 2013作图。
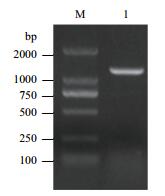
2 结果 2.1 Jc5β-StR基因的克隆用RT-PCR方法对Jc5β-StR进行克隆,琼脂糖凝胶电泳后在凝胶成像仪上观察得到一条大约1 200 bp的产物(图 1),对其测序后,用ORF finder软件分析Jc5β-StR基因编码氨基酸序列,完整的ORF框编码区为1 173 bp,编码蛋白包含390个氨基酸(图 2)。
|
| 图 1 Jc5β-StR基因电泳检测图 M:DNA marker; 1:Jc5β-StR的PCR产物 |

|
| 图 2 Jc5β-StR全长序列及其推导的氨基酸序列 |
通过ProtParam软件分析表明,Jc5β-StR蛋白相对分子量为44.23 kD,理论等电点为5.22,酸性氨基酸残基总数(Asp+Glu)为49个,碱性氨基酸残基总数(Arg+Lys)为34个,不稳定系数为41.40,为不稳定蛋白。原子总数是6 160个,分子式为C2017H3032N520O578S13。脂肪系数为84.31,疏水系数为-0.299,为亲水蛋白。
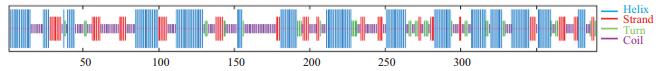
2.3 蛋白质二级结构及三级结构分析通过在线软件SOPMA对蛋白质进行二级结构预测,结果表明Jc5β-StR蛋白含有丰富的α螺旋(Alpha he1ix)占氨基酸残基总数的40.77%,其次是无规则卷曲(Random coil)占氨基酸残基总数的33.08%,延伸链(Extended strand)占氨基酸残基总数的17.18%,β-转角(Beta turn)占氨基酸残基总数的8.97%(图 3)。
|
| 图 3 Jc5β-StR蛋白质二级结构 序列全长390个氨基酸; 竖线由长及短分别是α-螺旋,延伸链,β-转角和无规则卷曲 |
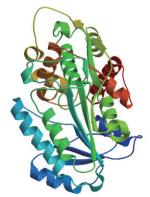
通过Prosite在线数据库分析,发现Jc5β-StR蛋白序列含有3类功能位点包括2个N-糖基化位点(N-glycosylation site),7个豆蔻酰化位点(N-myristoylation site)和7个酪蛋白激酶Ⅱ磷酸化位点(Casein kinase Ⅱ phosphorylation site)。登录http://swissmodel.expasy.org/中的MODELING,对小桐子Jc5β-StR蛋白三级建模,结果显示Jc5β-StR蛋白质三级结构模型以黄体酮5β还原酶(5β-POR)为模板,序列相似度为74.86%,建模结果如图 4所示。
|
| 图 4 Jc5β-StR蛋白质三级结构 |
蛋白质亚细胞定位预测Jc5β-StR最有可能定位在细胞质。跨膜结构预测结果表明Jc5β-StR不具有跨膜结构域。信号肽预测结果表明Jc5β-StR不具有信号肽,说明它不是一个分泌蛋白。
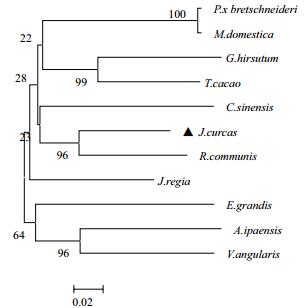
2.5 Jc5β-StR序列一致性分析通过NCBI Blast序列比对发现5β-StR基因在多种植物中均存在,Jc5β-StR与大戟科蓖麻(Ricinus communis)序列一致性最高,为87%;其次与胡桃科核桃(Juglans regia)序列一致性为83%,与梧桐科可可树(Theobroma cacao)序列一致性为82%;与蔷薇科白梨(Pyrus bretschneideri)序列一致性为81%;与芸香科甜橙(Citrus sinensis)、锦葵科陆地棉(Gossypium hirsutum)、蔷薇科苹果(Malus domestica)和梅(Prunus mume)等序列一致性为80%;与大豆(Glycine max)、辣椒(Capsicum annuum)、油菜(Brassica napus)等其他几十种植物序列一致性为75%-79%。Jc5β-StR与不同种类植物序列一致性较高,说明该基因在植物进化过程中较保守。
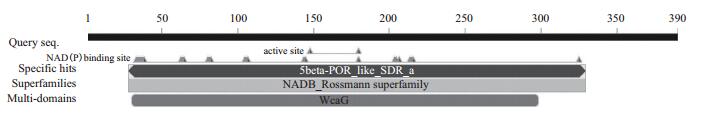
Jc5β-StR属于NADB Rossmann超家族(图 5)。该蛋白编码一个短链还原酶家族(SDRs)的黄体酮5β还原酶(5β-POR),Jc5β-StR也有含有SDRs的6个保守结构域(图 6),表明Jc5β-StR是一个短链还原酶。结构域Ⅰ-Ⅲ在所有NADP依赖的SDRs中都存在,是典型的SDRs结构域,余下的3种Ⅳ-Ⅵ结构域,不是所有的SDRs都存在,特别是Ⅴ结构域(NFYYxxED),是5β-POR类的典型结构域[11]。
|
| 图 5 Jc5β-StR保守结构域预测 |

|
| 图 6 Jc5β-StR与不同物种5β-StR氨基酸序列对比 横线序列Ⅰ-Ⅵ为SDRs的6个保守结构域; XP_012068258小桐子; NP_001310703蓖麻; XP_018836149核桃; XP 009360382白梨; XP 006472269甜橙; XP 016687805陆地棉 |
用MEAG7.0软件对Jc5β-StR蛋白氨基酸序列和其他植物的5β-StR蛋白进行进化分析,结果表明,Jc5β-StR的进化基本符合植物分类学分类,并具有明显的种属特性,如属蔷薇科的苹果和梨组成一个分支,Jc5β-StR与大戟科蓖麻聚在一枝(图 7),说明其与蓖麻亲缘关系最近。
|
| 图 7 不同植物5β-StR氨基酸序列进化树分析 标尺代表遗传距离; 数值代表从1 000次重复计算得到的Bootstrap百分比值 |
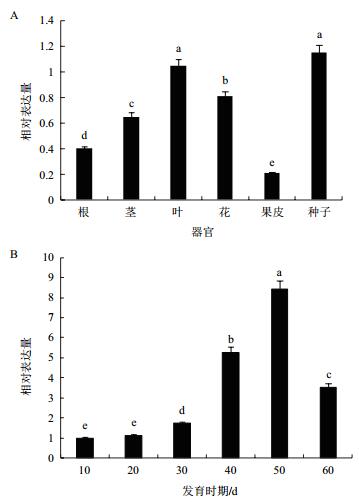
以β-actin作为内参,对小桐子Jc5β-StR在不同组织和种子不同发育阶段的表达情况进行qRT-PCR分析,分析结果表明,Jc5β-StR在小桐子根、茎、叶、花、果皮和种子中都有表达,在种子和叶片中的表达量显著高于其他组织。Jc5β-StR在种子发育过程中的定量分析(图 8) 表明,该基因在种子整个生长发育期都有表达,在种子生长发育前期其表达水平不断增加,在种子生长发育的后期(50 d)达到最高值,然后下降。
|
| 图 8 Jc5β-StR基因在不同组织(A)和种子不同发育时期(B)的表达 各柱状图上不同小写字母表示数据间差异显著(P < 0.05),下同 |
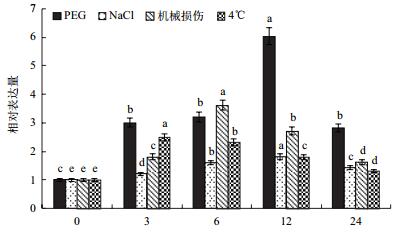
Jc5β-StR在PEG、NaCl、机械损伤和低温4℃处理下表达都不同程度提高,PEG处理下表达水平变化显著,在第12 h达到最高值,为对照样品表达量的6倍左右。NaCl处理下12 h达到最高值,为对照样品的1.8倍左右。机械损伤处理下第6 h达到最高值,为对照样品的3.7倍左右。4℃处理下Jc5β-StR在第3小时表达水平就达到最高值,为对照样品的2.5倍左右,之后缓慢下降(图 9)。
|
| 图 9 小桐子Jc5β-StR基因在不同非生物胁迫处理下的表达 |
本研究通过RT-PCR方法从小桐子中克隆了一个小桐子类固醇5β还原酶基因(Jc5β-StR),分析其ORF大小为1 173 bp,编码蛋白包含390个氨基酸。预测其相对分子量为44.23 kD,理论等电点为5.22。蛋白质亚细胞定位预测其定位在细胞质,没有跨膜结构域,也不具有信号肽。Blast结果表明Jc5β-StR属于NADB Rossmann超家族。其序列与同属于大戟科的蓖麻5β-StR序列一致性最高,为87%,进化树分析表明其与蓖麻5β-StR亲缘关系最近。该蛋白编码一个短链还原酶家族(SDRs)的黄体酮5β还原酶(5β-POR),也含有SDRs的6个保守结构域,证明Jc5β-StR是一个短链还原酶。
类固醇化合物对植物生长发育过程具有调节作用,Mandava报道了甾和皂苷对某些植物的生长过程均有调节作用,特别是甾醇和性激素对一些植物的生长具有促进作用[18]。种子作为小桐子的生殖器官,在发育过程中大量合成和累积类固醇化合物,结合本实验定量分析结果,Jc5β-StR在小桐子种子中高表达,并且在种子生长发育期表达量上升,种子成熟期(50 d)表达量达到最高值后下降,表达量变化过程与种子生长发育趋势一致,进一步验证了5β-StR在类固醇化合物生物合成途径上的重要作用。保守结构域预测还表明Jc5β-StR也属于SDRs家族一员,已报到的SDRs广泛参与植物的初级代谢和次级代谢,在植物生长发育和抗逆机制中发挥重要作用[5-11]。本研究小桐子幼苗在PEG、NaCl、机械损伤和低温这4种非生物胁迫处理下Jc5β-StR基因表达量都不同程度上调,由此推测Jc5β-StR也参与小桐子非生物胁迫应答。本研究为深入了解5β-StR基因的功能和小桐子的抗逆机制奠定了基础。
4 结论本研究报道了小桐子的一个内固醇5β还原酶基因Jc5β-StR。序列全长1 173 bp,编码390个氨基酸。该基因编码的蛋白含有SDRs的6个保守结构域。Jc5β-StR具有组织表达特异性,在种子中表达量最高,还受多种非生物胁迫诱导上调表达。
| [1] | Jornvall H, Hedlund J, Bergman T, et al. Superfamilies SDR and MDR:from early ancestry to present forms. Emergence of three lines a Zn-metalloenzyme, and distinct variabilities[J]. Biochem Biophys Res Commun, 2010, 396: 125–130. DOI:10.1016/j.bbrc.2010.03.094 |
| [2] | Moummou H, KallbergY, Tonfack LB, et al. The plant short chain dehydrogenase(SDR)superfamily:genome-wide inventory and diversification patterns[J]. BMC Plant Biol, 2012, 12: 1–17. DOI:10.1186/1471-2229-12-1 |
| [3] | Oppermann U, Filling C, Hult M, et al. Short-chain dehydrogenases/reductases(SDR):the 2002 update[J]. Chem-Biol Interact, 2003, 143: 247–253. |
| [4] | Kallberg Y, Oppermann U, Persson B. Classification of the short-chain dehydrogenase/ reductase superfamily using hidden models[J]. Febs Journal, 2010, 277: 2375–2386. DOI:10.1111/j.1742-4658.2010.07656.x |
| [5] | 杨东晓, 侯柄竹, 沈元月. 草莓果实FaSDR基因的克隆、生物信息学及表达分析[J]. 中国园艺文摘, 2015, 9: 19–21. DOI:10.3969/j.issn.1672-0873.2015.01.005 |
| [6] | Li F, Asami T, Wu X, et al. A putative hydroxysteroid dehydrogenase involved in regulating plant growth and development[J]. PlantPhysiol, 2007, 145: 87–97. |
| [7] | Baud S, Dichow NR, Kelemen Z, et al. Regulation of HSDl in seeds of Arabidopsis thaliana[J]. Plant Cell Physiol, 2009, 50: 1463–1478. DOI:10.1093/pcp/pcp092 |
| [8] | 陈全家, 刘超, 倪志勇, 等. 海岛棉GbDET2基因的克隆及表达分析[J]. 分子植物育种, 2015, 13(1): 119–124. |
| [9] | Puyaubert J, Dieryck W, Costaglioli P, et al. Temporal gene expres-sion of 3-ketoacyl-CoA reductase is different in high and in low erucic acid Brassica napes cultivars during seed development[J]. Biochim Biophys Acta, 2005, 1687: 152–163. DOI:10.1016/j.bbalip.2004.11.014 |
| [10] | Choi HW, Lee BC, Kim NH, et al. A role for a reductase in resistance against microbial pathogens in plants[J]. Plant Physiol, 2008, 148: 383–401. DOI:10.1104/pp.108.119461 |
| [11] | Herl V, Fischer G, Reva VA, et al. The VEP1 gene(At4g24220) encodes a short-chain dehydrogenase/reductase with 3-oxo-Δ4, 5 -steroid 5β -reductase activity in Arabidopsis thaliana L[J]. Bio-chimie, 2009, 91: 517–525. |
| [12] | Edyta B, Marina K, Gabriele F, et al. Recombinant Δ4, 5 -steroid 5β -reductase as biocatalysts for the reduction of activated C=C-double bonds in monocyclic and acyclic molecules[J]. Adv Synth Catal, 2009, 351(17): 2787–2790. DOI:10.1002/adsc.v351:17 |
| [13] | 余帅勇, 丁贵杰. 能源植物麻疯树研究进展[J]. 贵州林业科技, 2009, 37(1): 49–54. |
| [14] | 曾觉民. 可大力发展的生物质能源植物——膏桐[J]. 云南林业, 2006, 27(2): 21–22. |
| [15] | 吕文, 王春蜂, 王国胜, 等. 中国林业生物质能源发展潜力的研究[J]. 中国能源, 2005, 27(11): 21–26. DOI:10.3969/j.issn.1003-2355.2005.11.003 |
| [16] | 林娟, 周选围, 唐克轩, 等. 麻疯树植物资源研究概况[J]. 热带亚热带植物学报, 2004, 12(3): 285–290. |
| [17] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25: 402–408. DOI:10.1006/meth.2001.1262 |
| [18] | Mandava. Planta growth substances[J]. ACS symposium Seris, 1979, 160: 164–165. |




