2. 中国热带农业科学院热带生物技术研究所,海口 571101
2. Institute of Tropical Bioscience and Biotechnology, CATAS, Haikou 571101
由尖孢镰刀菌古巴专化型4号生理小种Fusarium oxysporum f. sp. cubense race 4(Foc4) 引起的香蕉枯萎病在世界香蕉主产区均有发生,给香蕉产业造成了巨大的经济损失,严重威胁香蕉产业的可持续发展[1]。该病防治困难,选育与推广抗病品种是控制香蕉枯萎病发生的有效措施,明确枯萎病菌与香蕉的互作机理可为香蕉抗枯萎病育种提供可靠的理论依据,对防治香蕉枯萎病具有重要意义。
研究发现,植物受到病原菌的侵染或外源物质的刺激后会启动相应防御反应系统。‘巴西蕉’受Foc4侵染后,与防御相关的编码乙烯合成酶ACC氧化酶的基因和乙烯应答转录因子(ERF)强烈表达[2]。与‘巴西蕉’相比,抗枯萎病香蕉品种‘粤优抗1号’受Foc4侵染后,几丁质诱导结合蛋白(CEBiP)、病程相关蛋白、转录因子和细胞壁木质化等防御相关基因表达量明显上调[3]。抗枯萎病香蕉品种‘农科1号’受Foc4侵染后,纤维素合成酶、几丁质诱导结合蛋白(CEBIP)、FLS2类蛋白、蛋白激酶MAPK 5、转录因子WRKY和某些ERF基因也均上调表达[4],此外,过氧化物酶基因MaPOD1、谷胱甘肽硫转移酶基因GSTF1在农科1号中蛋白水平和转录本水平上都表现为上调表达,且始终高于‘巴西蕉’[5, 6]。由此说明这些防御相关基因在植物抵御病原菌侵染过程中具有重要作用。
以上这些研究均以香蕉幼苗为试验材料,而在实际生产中,香蕉枯萎病一般在香蕉植株花芽分化后才严重发病。因此,比较研究花芽分化期抗/感枯萎病香蕉品种根部相关基因的表达,有助于更好地揭示抗病品种的抗病机制。本实验室在前期转录组分析中获得了大量差异表达基因,在此基础上,本研究选取其中10个进行qPCR,分析这些基因在香蕉花芽分化期根部的表达差异性,从而为系统揭示‘宝岛蕉’抗枯萎病分子机理奠定基础。
1 材料与方法 1.1 材料 1.1.1 植物材料‘宝岛蕉’和‘巴西蕉’种植于澄迈县福山镇红光农场香蕉枯萎病重病区,处于花芽分化期的‘巴西蕉’已表现明显枯萎病症状。分别取‘巴西蕉’和‘宝岛蕉’花芽分化期根部组织150 g,包括主根、侧根和三级根,且形态一致,立即在液氮中冷冻,带回实验室后储存在-80℃备用。
1.1.2 主要试剂总RNA提取试剂盒TRIzol® Reagent购自北京全式金生物技术有限公司; 反转录试剂盒Reverse Transcription System购自Promega公司; 实时荧光定量PCR试剂盒购自宝生物工程(大连)有限公司; 其他生化药剂均为分析纯。
1.2 方法 1.2.1 10个抗病相关基因的引物设计在前期工作中,我们对澄迈县福山镇红光农场香蕉枯萎病重病区的‘巴西蕉’和‘宝岛蕉’花芽分化期根部组织进行了比较转录组测序分析。从获得的抗病相关的差异表达基因中选出漆酶laccase-4(A)和laccase-4(B)、周质空间β-葡萄糖苷酶前体合成酶periplasmic beta-glucosidase precursor、谷胱甘肽硫转移酶glutathione-S-transferase Cla47、class Ⅲ型过氧化物酶class Ⅲ peroxidase 136 precursor、过氧化物酶peroxidase N、类似烟草叶片表面抗性蛋白similar to T-phylloplanin、抗菌肽snakin-1、类几丁质酶putative chitinase及纤维素合成酶催化亚基cellulose synthase catalytic subunit 12等10个基因进行本研究。以香蕉比较转录组测序得到的10个基因为基因组序列,我们通过NCBI比对这几类基因的mRNA序列,根据基因保守区域分别设计10个基因的实时荧光定量PCR引物,其中Actin为内参基因(表 1)。
按照北京全式金生物技术有限公司TransZol Plant RNA提取试剂盒说明书提取‘巴西蕉’和‘宝岛蕉’花芽分化期根部组织总RNA,用1%的琼脂糖凝胶电泳和紫外分光光度计检测RNA的纯度。以1.0 μg经DNaseⅠ处理的总RNA为模板,经Reverse Transcription System反转录合成cDNA第一链。
1.2.3 实时荧光定量PCR(qPCR)表达分析分别以‘巴西蕉’和‘宝岛蕉’花芽分化期根部组织cDNA为模板,以香蕉看家基因Ma-actinl(基因登录号AF285176) 为内参基因,采用SYBR®GreenII法进行qPCR分析,反应在QuantStudioTM 6 Flex (Th-ermoFisher)实时荧光定量PCR仪上进行,样本和内参分别设3次重复。20 μL反应体系含SYBR Premix Ex Taq Ⅱ(Tli RNase H Plus)(2×)10 μL,正反引物对(10 μmol/L)各0.8 μL,50×ROX Reference Dye Ⅱ 0.4 μL,cDNA模板2.0 μL,RNase-Free ddH2O 6.0 μL。qPCR反应程序如下:95℃预变性30 s,95℃变性5 s,56℃退火30 s,72℃延伸30 s,进行45个循环。采用2-ΔΔCt法计算基因相对表达量:ΔCt(目的基因)= Ct(目的基因)-Ct(同一样本Actin基因),ΔΔCt(目的基因)=待测样本ΔCt(目的基因)-对照样本ΔCt(目的基因),相对倍数=2-ΔΔCt(目的基因)。采用Excel 2007统计分析试验数据。
2 结果 2.1 总RNA质量分析本研究采用TransZol Plant RNA试剂盒法提取香蕉花芽分化期根样总RNA,每孔上样3 µL,进行1.0%的琼脂糖凝胶电泳,验证所提RNA的完整性(图 1)。提取的香蕉总RNA 28S rRNA和18S rRNA谱带清晰且明亮,完整性较好,无降解和拖尾现象。以上实验结果表明,所得总RNA完全可以满足后续的qPCR分析等实验的要求。
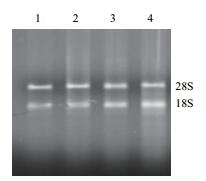
|
| 图 1 香蕉根样总RNA电泳图 1,2:宝岛蕉;3,4:巴西蕉 |
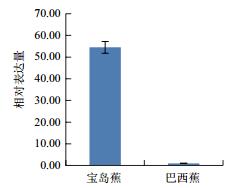
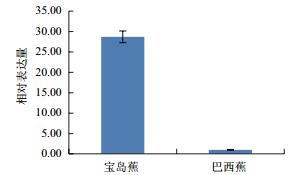
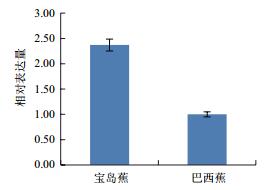
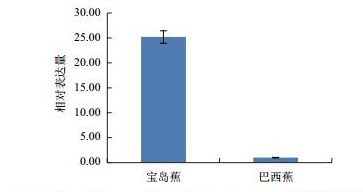
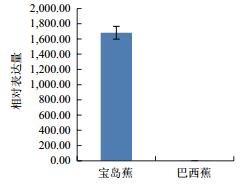
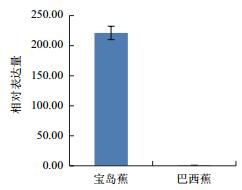
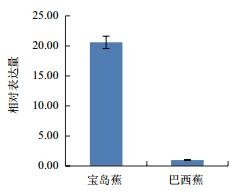
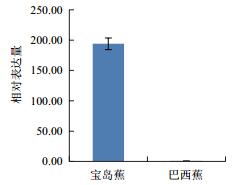
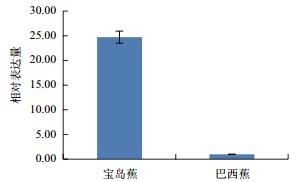
利用qPCR分析香蕉枯萎病重病区‘巴西蕉’与‘宝岛蕉’花芽分化期根部组织的10个差异表达基因的表达情况,结果如图 2-图 11所示。10个基因在香蕉的花芽分化期均有表达,但其表达模式存在差异。除laccase-4(A)基因在‘宝岛蕉’中的表达量明显下调,且相对表达量低于‘巴西蕉’外(图 2),laccase-4(B)(图 3)、periplasmic beta-glucosidase precursor(图 4)、glutathione-S-transferase Cla47(图 5)、class Ⅲ peroxidase 136 precursor(图 6)、peroxidase N(图 7)、similar to T-phylloplanin(图 8)、snakin-1(图 9)、putative chitinase(图 10) 及cellulose synthase catalytic subunit 12(图 11) 等9个基因在‘宝岛蕉’中均呈上调表达,相对表达量分别约为‘巴西蕉’的54倍、29倍、2.5倍、25倍、1682倍、220倍、20倍、194倍和25倍,其中peroxidase N的表达量差异达极显著水平。
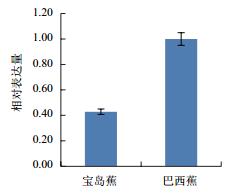
|
| 图 2 laccase-4(A)基因qPCR分析 |
|
| 图 3 Laccase-4(B)qPCR分析 |
|
| 图 4 Periplasmic beta-glucosidase precursor基因qPCR分析 |
|
| 图 5 Glutathione-S-transferase Cla47基因qPCR分析 |
|
| 图 6 class Ⅲ peroxidase 136 precursor基因PCR分析 |
|
| 图 7 Peroxidase N基因qPCR分析 |
|
| 图 8 Similar to T-phylloplanin基因qPCR分析 |
|
| 图 9 Snakin-1基因qPCR分析 |
|
| 图 10 Putative chitinase基因qPCR分析 |
|
| 图 11 Cellulose synthase catalytic subunit 12基因qPCR分析 |
寄主植物与病原菌互作过程往往诱导许多基因的表达,病原菌可通过致病基因的表达产生某些致病因子作用于植物细胞壁以侵染植物宿主,相反,宿主也会启动系列复杂防御反应机制以应答病原菌侵染,该反应涉及的宿主抗性基因激活、过敏反应发生、信号转导途径调控、其它信号转导相关酶及病程相关蛋白差异表达等过程能有效抑制病原菌的生长与扩散,具有主动防御病原菌侵染的功能。
相关研究表明,植物体内的木质素、纤维素及几丁质酶含量与植物的抗病性呈正相关[7-11],而漆酶、β-葡萄糖苷酶、谷胱甘肽硫转移酶和过氧化物酶等均参与木质素的生物合成[5-6, 12-20],纤维素合成酶催化亚基则参与纤维素的合成[4, 21]。此外,过氧化物酶、谷胱甘肽硫转移酶还参与活性氧代谢[2, 4, 22-25],通过清除活性氧和氧自由基,减缓和抵御细胞的伤害。抗菌肽是一类富含半胱氨酸在体外具有广谱抗菌活性的多肽,能够通过在细胞膜上形成离子通道造成细胞内容物大量外泄,或抑制病原物细胞壁的合成,或干扰某些细胞器的功能等机制来杀死病原物[26],在转基因番茄[27]、柑橘[28]、大麦[29]表达抗菌肽基因能分别提高其对青枯病、黄龙病及白粉病的抗性。一些植物的叶片腺毛能够分泌具有抗菌或抗虫作用的叶片表面抗性蛋白,对病原物具有趋避、拒食或毒害等作用[30-31]。
本研究采用qPCR法测定了香蕉枯萎病重病区‘巴西蕉’和‘宝岛蕉’花芽分化期根部组织中10个与特定抗病机制相关基因的表达变化。研究发现,laccase-4(A)和snakin-1 2个转录本的qPCR表达趋势与转录组数据不一致。在前期的转录组测序中,laccase-4(A)和snakin-1在‘宝岛蕉’根中的表达量分别为上调和下调,而qPCR分析显示这两个基因表达量分别为下调和上调。这与Li等[2]运用qPCR分析‘巴西蕉’响应枯萎病菌胁迫时一个假定的转录因子和一个响应拟南芥乙烯的转录因子基因表达量变化获得结果类似,这两个基因表达量变化与测序结果也不一致。推测可能因两种方法出现了假阳性或阴性,或是两种表达量计算方法不同,或是其他未知的原因导致。研究还发现,过氧化物酶、纤维素合成酶、谷胱甘肽硫转移酶和几丁质酶等基因的qPCR与转录组测序的结果趋势与前人研究结果一致。转录组测序及本研究表明,与‘巴西蕉’相比,抗枯萎病品种‘宝岛蕉’花芽分化期根系组织中的过氧化物酶、纤维素合成酶、谷胱甘肽硫转移酶和几丁质酶呈明显上调表达,这与抗枯萎病品种‘粤优抗1号’和‘农科1号’幼苗在Foc4接种胁迫下根系组织中相关酶的表达趋势一致[3-6],由此说明,这些基因在香蕉植株抵御Foc4的过程中扮演着重要角色。此外,漆酶(A与B)、β-葡萄糖苷酶、类似烟草叶片表面抗性蛋白和抗菌肽等另外5个基因在‘宝岛蕉’幼苗根系中的表达趋势是否与成株期一致,还需进一步实验验证。
4 结论香蕉枯萎病重病区‘巴西蕉’和‘宝岛蕉’花芽分化期根部组织中10个与特定抗病机制相关基因均有表达,但其相对表达量存在差异。除漆酶lacc-ase-4(A)基因为下调表达外,漆酶laccase-4(B)、周质空间β-葡萄糖苷酶前体合成酶(periplasmic beta-glucosidase precursor)、谷胱甘肽硫转移酶(glutathione-S-transferase Cla47)、class Ⅲ型过氧化物酶(class Ⅲ peroxidase 136 precursor)、过氧化物酶(peroxidase N)、类似烟草叶片表面抗性蛋白(similar to T-phylloplanin)、抗菌肽snakin-1、类几丁质酶(putative chitinase)及纤维素合成酶催化亚基(cellulose synthase catalytic subunit 12) 等9个基因在‘宝岛蕉’中的表达均较对照‘巴西蕉’明显上调。
| [1] | 林时迟, 张绍升, 周乐峰, 等. 福建省香蕉枯萎病鉴定[J]. 福建农业大学学报, 2000, 29(4): 465–469. |
| [2] | Li CQ, Shao JF, Wang YJ, et al. Analysis of banana transcriptome and global gene expression profiles in banana roots in response to infection by race 1 and tropical race 4 of Fusarium oxysporum f. sp. cubense[J]. BMC Genomics, 2013, 14(1): 851–867. DOI:10.1186/1471-2164-14-851 |
| [3] | Bai TT, Xie WB, Zhou PP, et al. Transcriptome and expression profile analysis of highly resistant and susceptible banana roots challenged with Fusarium oxysporum f. sp. cubense tropical race 4[J]. PLoS One, 2013, 8(9): 1–11. |
| [4] | Li CY, Deng GM, Yang J, et al. Transcriptome profiling of resistant and susceptible Cavendish banana roots following inoculation with Fusarium oxysporum f. sp. cubense tropical race 4[J]. BMC Genomics, 2012, 13(1): 374–385. DOI:10.1186/1471-2164-13-374 |
| [5] | Li XS, Bai TT, Li YF, et al. Proteomic analysis of Fusarium oxysporum f. sp. cubense tropical race 4 inoculated response to Fusarium wilts in the banana root cells[J]. Proteome Science, 2013, 11(1): 41–55. DOI:10.1186/1477-5956-11-41 |
| [6] | 王卓, 等. 香蕉过氧化物酶基因表达和酶活性与香蕉抗枯萎病的关系[J]. 中国农学通报, 2013, 29(34): 115–121. DOI:10.11924/j.issn.1000-6850.2013-0675 |
| [7] | Schlumbaum A, Mauch F, et al. Plant chitinases are potent inhibitors of fungal growth[J]. Nature, 1986, 324(6095): 365–367. DOI:10.1038/324365a0 |
| [8] | Kawasaki T, Koita H, Nakatsubo T, et al. Cinnamoyl-CoA reductase, a key enzyme in lignin biosynthesis, is an effector of small GTPase Rac in defence signaling in rice[J]. Proc Natl Acad Sci, USA, 2006, 103(1): 230–235. DOI:10.1073/pnas.0509875103 |
| [9] | 国会艳. 白桦BplMYB46基因调控抗旱耐盐和次生壁形成的分子机理[D]. 哈尔滨: 东北林业大学, 2014. |
| [10] | 邹丽. 水扬酸、茉莉酸对水稻木质素合成调控的研究[D]. 武汉: 华中农业大学, 2014. |
| [11] | 苏亚春. 甘蔗应答黑穗病菌侵染的转录组与蛋白组研究及抗性相关基因挖掘[D]. 福州: 福建农林大学, 2014. |
| [12] | 苏振峰. GH1 β-葡萄糖苷酶在拟南芥和水稻中的生物信息学及表达模式分析[D]. 泰安: 山东农业大学, 2014. |
| [13] | Ranocha P, Chabannes M, Chamayou S, et al. Laccase down-regulation causes alterations in phenolic metabolism and cell wall structure in poplar[J]. Plant Physiol, 2002, 129(1): 145–55. DOI:10.1104/pp.010988 |
| [14] | 王国栋, 陈晓亚. 漆酶的性质、功能、催化机理和应用[J]. 植物学通报, 2003, 20(4): 469–475. |
| [15] | 王骥, 朱木兰, 卫志明. 棉花漆酶基因在转基因新疆杨中的表达及其对木质素合成的影响[J]. 分子细胞生物学报, 2008, 41(1): 11–18. |
| [16] | 吴立柱, 王省芬, 等. 酸不可溶性木质素和漆酶在棉花抗黄萎病中的作用[J]. 作物学报, 2014, 40(7): 1157–1163. |
| [17] | 马森. 谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J]. 动物医学进展, 2008, 29(10): 53–56. DOI:10.3969/j.issn.1007-5038.2008.10.015 |
| [18] | 杨海灵, 聂力嘉, 等. 谷胱甘肽硫转移酶结构与功能研究进展[J]. 成都大学学报:自然科学版, 2006, 25(1): 19–24. |
| [19] | 王卓, 等. 香蕉3个Tau类谷胱甘肽硫转移酶基因的克隆及序列分析[J]. 热带作物学报, 2013, 34(9): 1676–1681. |
| [20] | 穆西玉, 张海艳. 不同玉米品种抗感粗缩病与过氧化物酶关系的研究[J]. 吉林农业科学, 2015, 40(3): 73–75, 102. |
| [21] | Burton RA, Gibeaut DM, et al. Virus-induced silencing of a plant cellulose synthase gene[J]. Plant Cell, 2000, 12(5): 691–705. DOI:10.1105/tpc.12.5.691 |
| [22] | 孟艳艳, 范术丽, 等. ClassⅢ过氧化物酶在植物中的作用及其研究进展[J]. 西北植物学报, 2011, 31(9): 1908–1916. |
| [23] | 曾蕊, 等. 香蕉与枯萎病菌4号小种互作过程中防御酶活性的变化[J]. 华中农业大学学报, 2014, 33(2): 61–64. |
| [24] | Lu GY, Guo SG, Zhang HY, et al. Transcriptional profiling of water-melon during its incompatible interaction with Fusarium oxysporum f. sp. niveum[J]. Eur J Plant Pathol, 2011, 131(4): 585–601. DOI:10.1007/s10658-011-9833-z |
| [25] | Wang Z, Zhang JB, Jia CH, et al. De Novo characterization of the banana root transcriptome and analysis of gene expression under Fusarium oxysporum f. sp. cubense tropical race 4 infection[J]. BMC Genomics, 2012, 13(1): 650–659. DOI:10.1186/1471-2164-13-650 |
| [26] | 王贤达, 林雄杰, 胡菡青, 等. 抗菌肽研究及其在植物病害控制中的应用[J]. 福建农业学报, 2014, 29(1): 99–104. |
| [27] | Jan PS, Huang HY, Chen HM. Expression of a synthesized gene encoding cationic peptide cecropin B in transgenic tomato plants protects against bacterial disease[J]. Appl Environ Microbiol, 2010, 76(3): 769–775. DOI:10.1128/AEM.00698-09 |
| [28] | Felipe RTA, et al. Responses of transgenic to hamlin sweet orange plants expressing the attacin A gene to Candidatus Liberibacter asiaticus infection[C]. The 2nd International Research Conference on Huanlongbing, Orlando. Florida, 2011:200. |
| [29] | Rahanmaeian M, Vilcinskas A. Defence gene expression is potentiated in transgenic barley expressing antifungal peptide metchnikowin throughout powdery mildew challenge[J]. Journal Plant Research, 2012, 125(1): 115–124. DOI:10.1007/s10265-011-0420-3 |
| [30] | Shepherd RW, Bass WT, Houtz RL, et al. Phylloplanins of tobacco are defensive proteins deployed on aerial surfaces by short glandular trichomes[J]. Plant Cell, 2005, 17(6): 1851–1861. DOI:10.1105/tpc.105.031559 |
| [31] | Amme S, Rutten T, Melzer M, et al. A proteome approach defines protective functions of tobacco leaf trichomes[J]. Proteomics, 2005, 5(10): 2508–2518. DOI:10.1002/(ISSN)1615-9861 |





