倍半萜是萜类化合物中种类最多的一类,目前已发现约5 000多种,它是一类普遍胁迫诱导的植物挥发性物质[1, 2]。α-法尼烯是一种含共轭二双键的倍半萜化合物,最早在苹果果皮中发现,并发现在植物防御中扮演着重要角色,是植物受到植食性害虫侵食或病原菌侵染挥发出的防御性物质或吸引害虫天敌的信号物质之一[3-6]。例如,苹果被蠹蛾侵染后能产生大量的α-法尼烯且能吸引新生幼虫[7];在病原菌敏感大豆中过表达α-法尼烯合酶能增强植物抗菌性[8]。α-法尼烯最初被关注是20世纪初,它的氧化产物被认为与苹果和梨果实在低温储藏后期常见的一种生理性病害虎皮病有关[9]。近年来,α-法尼烯等含有共轭二双键的挥发性萜类化合物被认为参与植物抵御非生物胁迫,如温度、光和氧化胁迫等。其作用机制为,当植物受到非生物胁迫时会积累活性氧,单萜和倍半萜挥发性萜类化合物在非生物胁迫下,释放量增加,通过它们共轭二双键的断裂清除活性氧,稳定膜结构增强植物抵御逆境胁迫(如强光,氧化胁迫);它也能耗散作用于光合膜光剩光能,溶于细胞膜提高植物的耐热性,从而缓和植物受到的伤害[10-13]。
植物萜类代谢主要存在两条途径,即发生在胞质中主要合成倍半萜和甾醇的甲羟戊酸途径(MVA)与存在质体中主要合成单萜和二萜的3-磷酸甘油醛/丙酮酸途径(MEP)[14, 15]。α-法尼烯是通过萜类代谢途径的甲羟戊酸途径产生[16, 17],α-法尼烯合酶是α-法尼烯生物合成途径的一个关键酶,它通过催化法尼基焦磷酸(Farnesyl pyrophosphate,FPP)合成α-法尼烯,是α-法尼烯合成途径的终端酶。据报道α-法尼烯合酶是一种单萜/倍半萜底物合酶,它能利用牦牛儿基焦磷酸(Geranyl diphosphate,GPP)合成单萜,利用FPP合成倍半萜,而且它还具有异戊烯基转移酶特性,能直接利用GPP和异戊烯基焦磷酸(IPP)[18]。这种利用多底物的特性能使一种萜类合酶产生多种萜类化合物,被认为对植物生长发育过程中适应环境有重要意义[19]。目前已有多篇文献对不同品种苹果的α-法尼烯合酶基因结构或蛋白特点进行了分析[20-25],例如,Pechous和李萌等[20, 21]主要对苹果α-法尼烯合酶酶活性特征进行了分析;苑克俊和Beuning等[22, 23]分析了苹果α-法尼烯合酶基因组结构特征;Green等[24, 25]则对苹果α-法尼烯合酶蛋白与底物结合特征进行了分析。但是,不同物种α-法尼烯合酶之间序列同源比对与聚类分析和苹果α-法尼烯合酶不同诱导表达模式分析并未见详细报道。本研究对前期获得的虎皮病敏感品种青香蕉苹果MdAFS蛋白进行了生物信息学分析。同时以野生型青香蕉苹果叶片为材料,对α-法尼烯合酶进行不同非生物胁迫和激素信号处理并取材,研究非生物胁迫与激素信号等对该基因表达模式的影响,初步揭示MdAFS基因对非生物胁迫和信号处理的响应。
1 材料与方法 1.1 材料苹果品种为‘青香蕉’,由泰安市郊区果园提供。以其春天新生完全展开的叶片为材料,取离体‘青香蕉’苹果叶片置于培养皿中,分别进行乙烯(ETH,50 mg/L)、脱落酸(ABA,100 μmol/L)、茉莉酸甲酯(MeJA,100 μmol/L)、水杨酸(SA,500 μmol/L)、甲基紫精(MV100 μmol/L)、强光(1 200 μmol m-2 s-1)、高温(45℃)、低温(4℃)等诱导处理,除强光、高温、低温处理外其他处理均为25℃光照培养箱中进行,并以蒸馏水处理作为对照,在0、2、4、6、8和10 h取样,取样后立即进行液氮速冻并于-80℃冰箱保存。
1.2 方法 1.2.1 青香蕉苹果AFS基因的cDNA序列的信息学分析氨基酸序列的同源性分析用NCBI BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp & PAGE_TYPE=BlastSearch & LINK_LOC=blasthome)。应用GOR4在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)对MdAFS蛋白的二级结构进行预测和分析,利用SMART在线软(http://smart.embl-heidelberg.de/)分析蛋白质的结构域,采用SWISS-MODEL(http://swissmodel.expasy.org/)进行蛋白质结构域的三维建模。然后利用MEGA 6.0软件,算法为Neighbor-Joining,自检举1 000次,构建系统发育进化树。
1.2.2 实时荧光定量PCR用北京天根公司多糖多酚总RNA提取试剂盒,提取不同处理青香蕉苹果叶片的总RNA,并用该公司的反转录试剂盒DNaseⅠ去除DNA污染,反转录为cDNA,用SYBR® Green Realtime PCR Master Mix(康为世纪,北京)进行实时荧光定量PCR,PCR程序为95℃预变性10 min,95℃变性15 s,60℃退火30 s,40个循环,溶解曲线的温度是65-95℃。所用的内参引物为Actin(F:5'-CACTGGTCGTACAACTG-GTAT-3',R:5'-AGGTAGCTCATAGCTCTTCTC-3',GenBank No:XM_008393049),定量引物pAFS(F:5'-AAAGCGACAATCTCGGCACAA-3',R:5'-GCGC-GAAATGGTGGTTCTCTAAT-3')基因的相对表达量分析用2-△△CT法。
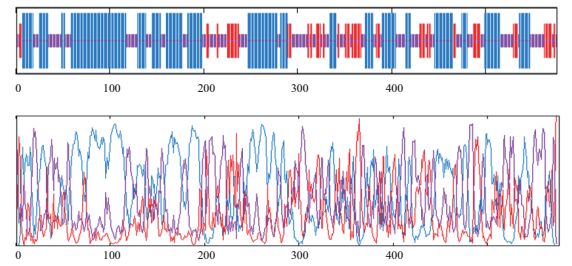
2 结果 2.1 AFS的蛋白二级结构预测与分析蛋白质二级结构通常包括α-螺旋、β-转角、β-折叠、延伸链和无规则卷曲等基序。通过应用GOR4在线软件对MdAFS蛋白质二级结构预测分析,发现MdAFS基因的二级结构元件主要由α-螺旋(47.05%)、延伸链(16.15%)和无规则卷曲(36.81%)构成(图 1)。根据H与E占总序列百分比比例,可知MdAFS蛋白属于混合型[26]。
|
| 图 1 MdAFS基因的蛋白质二级结构预测 蓝线代表α-螺旋,紫线代表无规则卷曲,红线代表延伸链 |
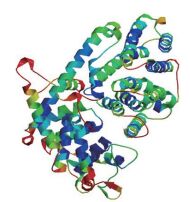
由SWISS-MODEL Workspace在线软件建立MdAFS蛋白的三维结构模型(图 2)。
|
| 图 2 MdAFS蛋白的三维结构模型 |
通过BLASTP选取与MdAFS基因编码蛋白相似性较高的9条AFS蛋白序列,砂梨ACC 94157.1;梅XP_008224883.1;草莓XP_004309672.1;桑EX-B31406.1;杨XP_010999554.1;蓖麻AEQ27768.1;可可树EQY28527.1;葡萄XP_002264134.2;桉树XP_010054439.1。该苹果的AFS与蔷薇科植物砂梨的AFS同源性较高,达到97%。但与其他物种的同源性均低于70%。利用DNAMAN对这10条氨基酸序列进行比对(相似水平≥75%),结果(图 3)表明,这些氨基酸序列虽然相似度不高,但是在萜类合酶特有保守结构域区域RXR,DDXXD和NSE/DTE高度保守。而且,它们的N端RRx8W和C端的H-α1loop也具有高度保守性。利用MEGA6软件对它们进行系统进化树分析(图 4),相同功能的酶之间基因的进化与植物进化具有一定的正相关性,蔷薇科的几个不同植物来源的AFS亲缘关系较近,但与其他物种的亲缘关系比较远,MdAFS和砂梨的亲缘关系最近,属于同一个进化支,与梅,草莓亲缘关系较近,同属于同一进化分支。

|
| 图 3 MdAFS与其他物种的AFS推导的氨基酸同源性分析 AAS68019.1:苹果;ACC 94157.1:砂梨;XP_008224883.1:梅;XP_004309672.1:草莓;EXB31406.1:桑;XP_010999554.1:杨;AEQ27768.1:蓖麻;EQY28527.1:可可树;XP_002264134.2:葡萄;XP_010054439.1:桉树 |

|
| 图 4 10个来自不同物种的AFS氨基酸序列的聚类分析 |
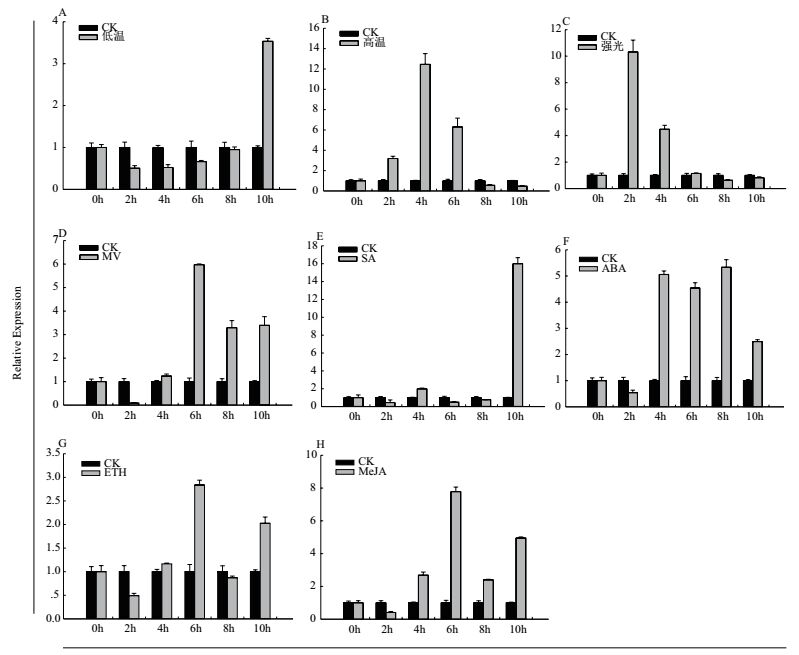
为检测MdAFS表达对非生物逆境胁迫和激素信号的响应,对青香蕉苹果叶片进行低温、高温、强光、MV、SA、ABA、ETH和MeJA处理,并在处理后不同时间点取样,以未处理对应时间点作为对照,结果如图 5所示,MdAFS转录本在低温和SA胁迫处理后的表达模式一致,在前8 h表达量相对稳定,8 h后迅速增加并达到峰值(图 5-A、E)。高温和强光胁迫处理MdAFS基因表达均表现为先升高后下降,最高表达均达10倍以上(图 5-B、C)。MV、ABA、ETH和MeJA处理,MdAFS转录均2 h后表现持续上调表达,在6 h表达达到一个相对较高水平(图 5-D、F、G、H)。ETH诱导处理MdAFS虽然表现上调但不显著,且在6 h后出现略微下调,8 h后又表现为上调表达(图 5-G)。
|
| 图 5 青香蕉苹果α-法尼烯合酶基因MdAFS的基因差异表达模式分析 A-H分别代表低温(4℃)、高温(45℃)、强光(1 200 μmol m-2 s-1),甲基紫精(MV 100 μmol/L)、水杨酸(SA,500 μmol/L)、脱落酸(ABA,100 μmol/L),乙烯(ETH,50 mg/L)和茉莉酸甲酯(MeJA,100 μmol/L),内参(GenBank No:XM_008393049)将不同时间处理的对照表达水平设定为‘1’,标准误差为3个生物重复和3个技术重复计算结果 |
MdAFS氨基酸序列NCBI blast在线分析发现,MdAFS所编码的蛋白质与除梨外其他物种的AFS蛋白序列相似度比较低,甚至同为蔷薇科的相似度也低于70%左右,AFS氨基酸序列的差异性并不影响AFS蛋白三维结构的相似性。2016年报道的大豆AFS蛋白,它的氨基酸序列和苹果的AFS氨基酸序列相似度只有53%,但是他们分析两者的蛋白三维结构及保守结构位点发现几乎完全重叠[8]。对10条不同来源的AFS蛋白氨基酸序列进行同源序列比对发现,尽管序列差异性显著,但氨基酸序列N端的RRx8W基序和C端的一价阳离子(K+)结合区域H-α1loop具有高度保守性。这与2009年Green研究苹果α-法尼烯合酶蛋白结构特征的发现相似,即α-法尼烯合酶具有单萜合酶TPS-b和部分TPS-d亚家族特有RRx8W基序[27]和一价阳离子K+结合区的氨基酸序列(RGDxxxI/V)即H-α1loop区域[24]。不同物种的α-法尼烯合酶氨基酸序列同源性不高,早先Pechous和Whitaker[20]研究也发现苹果的α-法尼烯合酶氨基酸序列与单萜合酶氨基酸序列同源性更高。这可以初步表明,α-法尼烯合酶和单萜合酶在进化上存在联系。最近的一篇综述表明,目前已经鉴定出40种萜类合酶(TPSs)具有双功能或多功能特性,而且80%属于单萜/倍半萜合酶[19]。Green等[18]对苹果α-法尼烯合酶进行体外实验发现该酶不但能利用FPP为底物合成倍半萜α-法尼烯,也能利用GPP为底物合成单萜β-罗勒烯,进一步证实苹果α-法尼烯合酶是一种单萜/倍半萜双功能合酶。已证实拟南芥[28]、葡萄[29]、黄瓜[30]和苹果[18]等物种的α-法尼烯合酶也都具有单萜/倍半萜双功能合酶特性,有意思的是,最近分离的大豆α-法尼烯合酶,虽然通过聚类分析也同样属于TPSs-b家族且同样具有RRx8W和H-α1loop结构,但体外实验发现它却没有单萜合酶特性[8]。此外,实验已经确定苹果和大豆等α-法尼烯合酶都需要K+和Mg2+辅助因子,但拟南芥α-法尼烯合酶却只需要Mg2+。早先分离的几个裸子植物的α-法尼烯合酶,发现属于TPS-d家族而非TPS-b家族[31]。综上我们可以推断α-法尼烯合酶可能由单萜合酶进化而来,并且经过多次进化,在进化过程某些特征出现了丢失。RRx8W和一价阳离子结合区域H-α1loop可能是α-法尼烯合酶所共有的特征性结构序列,可以作为该类萜类合酶的一个分类依据。但这些假设还需要分析其他更多真核双子叶植物的α-法尼烯合酶得到进一步证明。
植物萜类挥发物是植物的一类防御性代谢物质,植物受到胁迫会伴随大量的萜类挥发物的释放。邓帅等[32]对梨α-法尼烯合酶启动子序列分析发现它具有胁迫响应元件和激素响应元件。我们对青香蕉苹果叶片进行非生物胁迫处理以及激素诱导后,MdAFS基因均表现为明显的上调表达,尤其对氧化胁迫、MeJA和ABA表现更为明显,说明MdAFS启动子上也存在响应相关胁迫和激素信号的作用元件。ABA,MeJA以及SA是防御信号物质,植物受到生物与非生物胁迫的时候会引起它们的积累,启动防御代谢[1, 33]。一般认为MVA和MEP途径代谢受到前体转录和蛋白水平的调控,但是近来研究发现环境信号如温度,光等也反馈调控着萜类代谢[15, 34]。MdAFS基因差异表达分析表明非生物胁迫和激素信号调控MdAFS转录水平,MdAFS响应非生物和激素诱导信号,可能对于植物迅速有效应答逆境胁迫,缓和植物伤害具有重要意义。但是植物将外界信号通过怎样的信号转导通路,需要哪些转录因子的介导,还需要更多实验证明。
4 结论本研究对先前获得的青香蕉苹果α-法尼烯合酶生物信息学分析表明α-法尼烯合酶各种属之间的氨基酸序列相似度低于70%,但三维结构和保守结构位点极为相似。α-法尼烯合酶和单萜合酶具有明显的联系,且具有明显的多次进化痕迹。利用实时荧光定量PCR对MdAFS基因在非生物胁迫和激素处理下的表达分析表明,该基因响应非生物胁迫和激素诱导。
| [1] | Schuman MC, Palmeryoung EC, Schmidt A, et al. Ectopic TPS expression enhances sesquiterpene emission in Nicotiana attenuata without altering defense or development of transgenic plants or neighbors[J]. Plant Physiology, 2014, 166(2): 779–97. DOI:10.1104/pp.114.247130 |
| [2] | Holopainen, Jarmo K, Gershenzon, et al. Multiple stress factors and the emission of plant VOCs[J]. Trends in Plant Science, 2010, 15(3): 176–84. DOI:10.1016/j.tplants.2010.01.006 |
| [3] | Huelin FE, Murray KE. Alpha-farnesene in the natural coating of apples[J]. Nature, 1966, 210(5042): 1260–1261. DOI:10.1038/2101260a0 |
| [4] | Yang T, Stoopen G, Yalpani N, et al. Metabolic engineering of geranic acid in maize to achieve fungal resistance is compromised by novel glycosylation patterns[J]. Metabolic Engineering, 2011, 13(4): 414–425. DOI:10.1016/j.ymben.2011.01.011 |
| [5] | K?nnaste A, Vongvanich N, Borg-Karlson AK. Infestation by a Nalepella, species induces emissions of α-and β-farnesenes, (-)-linalool and aromatic compounds in Norway spruce clones of different susceptibility to the large pine weevil[J]. Arthropod-Plant Interactions, 2008, 2(1): 31–41. DOI:10.1007/s11829-008-9029-4 |
| [6] | Danner H, Boeckler GA, Irmisch S, et al. Four terpene synthases produce major compounds of the gypsy moth feeding-induced volatile blend of Populus trichocarpa[J]. Phytochemistry, 2011, 72(9): 897–908. DOI:10.1016/j.phytochem.2011.03.014 |
| [7] | Sutherland ORW, Hutchins RFN. Attraction of newly hatched codl-ing moth larvae(Laspeyresia pomonella)to synthetic stereo-isom-ers of farnesene[J]. Journal of Insect Physiology, 1973, 19(3): 723–727. DOI:10.1016/0022-1910(73)90080-2 |
| [8] | Lin J, Wang D, Chen X, et al. An(E, E)-α-farnesene synthase gene of soybean has a role in defence against nematodes and is involved in synthesizing insect-induced volatiles[J]. Plant Biotechnology Journal, 2016, 15(1): 1–10. |
| [9] | Anet EFLJ. Superficial scald, a functional disorder of stored apples. Ⅷ. Volatile products from the autoxidation of alpha-farnesene[J]. Journal of the Science of Food & Agriculture, 1972, 23: 605–608. |
| [10] | Lerdau MT. A unified mechanism of action for volatile isoprenoids in plant abiotic stress[J]. Nature Chemical Biology, 2009, 5(5): 283–291. DOI:10.1038/nchembio.158 |
| [11] | Baldwin I T. Plant volatiles[J]. Current Biology, 2010, 20(9): R392-7. |
| [12] | Loreto F, Pollastri S, Fineschi S, et al. Volatile isoprenoids and their importance for protecti on against environmental constraints in the Mediterranean area[J]. Environmental & Experimental Botany, 2014, 103(3): 99–106. |
| [13] | Kempinski C, Jiang Z, Bell S, et al. Metabolic engineering of higher plants and algae for isoprenoid production[M] //Schrader J, Bohlmann J. Biotechnology of Isoprenoids. Springer International Publishing, 2015, 148:161-199. |
| [14] | Laule O, Fürholz A, Chang HS, et al. Crosstalk between cytosolic and plastidial pathways of isoprenoid biosynthesis in Arabidopsis thaliana[J]. Proceedings of the National Academy of Sciences, 2003, 100(11): 6866–6871. DOI:10.1073/pnas.1031755100 |
| [15] | Tholl D. Biosynthesis and biological functions of terpenoids in plants[J]. Advances in Biochemical Engineering/biotechnology, 2015, 148: 63–106. DOI:10.1007/978-3-319-20107-8 |
| [16] | Rupasinghe HPV, Paliyath G, Murr DP. Biosynthesis of alpha-farnesene and its relation to superficial scald development in 'Delicious' apples[J]. American Society for Horticultural Science, 1998, 11(3): 245–248. |
| [17] | 李萌, 张元湖, 隋娜, 等. 苹果中α-法尼烯的代谢途径及其分子调控[J]. 植物生理学报, 2005, 41(1): 99–104. |
| [18] | Green S, Friel EN, Matich A, et al. Unusual features of a recombinant apple alpha-farnesene synthase[J]. Phytochemistry, 2007, 68(2): 176–188. DOI:10.1016/j.phytochem.2006.10.017 |
| [19] | Pazouki L, ülo Niinemets. Multi-Substrate terpene synthases:their occurrence and physiological significance[J]. Frontiers in Plant Science, 2016, 7(111): 1–16. |
| [20] | Pechous SW, Whitaker BD. Cloning and functional expression of an(E, E)-α-farnesene synthase cDNA from peel tissue of apple fruit[J]. Planta, 2004, 219(1): 84–94. DOI:10.1007/s00425-003-1191-4 |
| [21] | 李萌, 隋娜, 张元湖, 等. 苹果AFS基因的克隆与原核表达[J]. 园艺学报, 2006, 33(1): 122–124. |
| [22] | 苑克俊, 刘庆忠, 李勃, 等. 苹果α-法尼烯合酶基因组结构和序列的多态性分析[J]. 园艺学报, 2007, 34(4): 1003–1006. |
| [23] | Beuning L, Green S, Yauk YK. The genomic sequence of AFS-1 -an alpha-farnesene synthase from the apple cultivar 'Royal Gala'[J]. Frontiers of Agriculture in China, 2010, 4(1): 74–78. DOI:10.1007/s11703-009-0091-1 |
| [24] | Green S, Squire CJ, Nieuwenhuizen NJ, et al. Defining the potassium binding region in an apple terpene synthase[J]. Journal of Biological Chemistry, 2009, 284(284): 8661–8669. |
| [25] | Green S, Baker EN. A non-synonymous nucleotide substitution can account for one evolutionary route to sesquiterpene synthase activity in the TPS-b subgroup[J]. Febs Letters, 2011, 585(12): 1841–1846. DOI:10.1016/j.febslet.2011.04.038 |
| [26] | Sen TZ, Jernigan RL, Garnier J, et al. GOR V server for protein secondary structure prediction[J]. Bioinformatics, 2005, 21(11): 2787–8. DOI:10.1093/bioinformatics/bti408 |
| [27] | Dudareva N, Martin D, Kish CM, et al. (E)-β-Ocimene and myrcene synthase genes of floral scent biosynthesis in snapdragon:function and expression of three terpene synthase genes of a new terpene synthase subfamily[J]. Plant Cell, 2003, 15(5): 1227–1241. DOI:10.1105/tpc.011015 |
| [28] | Huang M, Abel C, Sohrabi R, et al. Variation of herbivore-induced volatile terpenes among Arabidopsis ecotypes depends on allelic differences and subcellular targeting of two terpene synthases, TPS02 and TPS03[J]. Plant Physiology, 2010, 153(3): 1293–1310. DOI:10.1104/pp.110.154864 |
| [29] | Martin DM, Aubourg S, Schouwey MB, et al. Functional annotation, genome organization and phylogeny of the grapevine(Vitis vinifera)terpene synthase gene family based on genome assembly, FLcDNA cloning, and enzyme assays[J]. BMC Plant Biology, 2010, 10(1): 226–248. DOI:10.1186/1471-2229-10-226 |
| [30] | Mercke P, Kappers IF, Verstappen FW, et al. Combined transcript and metabolite analysis reveals genes involved in spider mite induced volatile formation in cucumber plants[J]. Plant Physiology, 2004, 135(4): 2012–2024. DOI:10.1104/pp.104.048116 |
| [31] | Phillips MA, Wildung MR, Williams DC, et al. cDNA isolation, functional expression, and characterization of(+)-alpha-pinene synthase and(-)-alpha-pinene synthase from loblolly pine(Pinus taeda):stereocontrol in pinene biosynthesis[J]. Archives of Biochemistry & Biophysics, 2003, 411(2): 267–276. |
| [32] | 邓帅, 成妮妮, 丁瑞瑞, 等. 苹果和梨AFS基因启动子的克隆、序列比对及功能分析[J]. 园艺学报, 2015, 42(12): 2353–2361. |
| [33] | Wang L, Allmann S, Wu J, et al. Comparisons of LIPOXYGENA-SE3-and JASMONATE-RESISTANT4/6-silenced plants reveal that jasmonic acid and jasmonic acid-amino acid conjugates play different roles in herbivore resistance of Nicotiana attenuata[J]. Plant Physiology, 2008, 146(3): 904–915. DOI:10.1104/pp.107.109264 |
| [34] | Vranová E, Coman D, Gruissem W. Network analysis of the MVA and MEP pathways for isoprenoid synthesis[J]. Annual Review of Plant Biology, 2013, 64(1): 665–700. DOI:10.1146/annurev-arplant-050312-120116 |
| [35] | Tholl D, Lee S. Terpene Specialized Metabolism in Arabidopsis thaliana[J]. Arabidopsis Book, 2011, 9: e0143. DOI:10.1199/tab.0143 |




