细胞自噬(Autophagy,后文称为自噬)是一种重要的真核生物细胞内膜泡运输过程,负责细胞质物质的靶向液泡(动物是溶酶体)运输和分解。在自噬过程中,待分解物质被双层结构的膜泡包裹形成自噬小体;随后自噬小体外膜与液泡膜融合,藉此将内膜及包裹的物质(自噬小泡)送入液泡[1, 2]。自噬小体的组装及与液泡的融合等过程是在包括ATG5在内的一系列自噬相关因子(Autopha-gy-related,ATG)参与下实现的。在有关ATG5参与自噬的角色中,研究得最清楚的是其以共价连接的ATG12-ATG5形式与ATG16形成复合物(ATG12-ATG5·ATG16)4,该复合物催化ATG8与脂类分子磷脂酰乙醇胺(PE)的连接,藉此将ATG8定位于自噬膜表面[3, 4],ATG8在自噬膜的起始、延伸、合拢及与液泡的融合等过程中发挥重要作用[5, 6]。此外,植物ATG5还表现出在早期吞噬泡开口处的环形定位特征,可能参与自噬膜从内质网表面的起始、扩展及闭合等过程[7]。需要注意的是,对动物的研究发现还存在另一类不依赖于ATG5的自噬途径[8, 9]。除参与自噬核心过程外,ATG5还具有非自噬或在自噬与其他细胞过程之间建立联系的功能,如动物ATG5参与了抗病毒免疫信号的抑制[10]和细胞凋亡的促进[11],在DNA损伤剂作用下表现转位到核内促进有丝分裂异常现象的作用[12]。自噬的分子机制研究始于酵母,后来发现其在包括动植物在内的真核生物中非常保守,动植物含有包括ATG5在内的大部分酵母ATG的同源基因[13-15]。鉴于ATG5在自噬中的重要作用及其有别于其他ATG因子的功能多样性,以ATG5为靶标深入探索其参与的自噬及其他细胞过程的机制和生理功能具有重要意义。
自噬参与了植物的正常生长、发育和衰老等过程,也与植物适应环境的生理过程密切相关[16-18]。此前本实验室先后报道了重要农作物小麦ATG4、ATG6、ATG8、ATG10和ATG18的鉴定,发现小麦对生物、非生物胁迫的响应过程涉及对自噬水平的调控[19, 20]。本实验室目前也已经克隆了两个小麦ATG5基因TaATG5a(KF294799)和TaATG5b(KF294800),表达分析和基因沉默研究结果初步表明其参与了小麦的自噬和逆境胁迫响应等过程(未发表数据)。鉴于后续的基因功能研究工作涉及免疫学方法和对特异性抗体的需求,本研究利用原核表达和蛋白纯化方法获得了小麦TaATG5a的重组蛋白,制备了重组蛋白的抗血清。利用ELISA和Western杂交方法分析了抗血清对抗原识别的特异性和效价,鉴定了小麦内源ATG5的存在形式。
1 材料与方法 1.1 材料原核表达载体pET30a质粒、克隆有小麦TaATG5a基因的pLB-ATG5a载体质粒、大肠杆菌菌株DH5α和BL21(DE3)由本实验室保存。限制性核酸内切酶NotⅠ购自宝生物工程(大连)有限公司;Ni-Agarose His标签蛋白纯化试剂盒(CW0894S)、ECL化学发光检测试剂盒(CW0049S)和辣根过氧化物酶底物TMB溶液(CW0050S)购自康为世纪生物科技有限公司;弗氏完全佐剂和弗式不完全佐剂购自美国Sigma-aldrich公司;辣根过氧化物酶标记的羊抗兔IgG由北京华大蛋白质研发中心有限公司提供。其他生化试剂均为进口或国产分析纯试剂。构建载体的DNA测序由华大基因科技股份有限公司完成。
1.2 方法 1.2.1 原核表达载体的构建设计合成两端添加NotⅠ识别位点的PCR引物对5aNOTI-F(ATAAGA-ATGCGGCCGCACGGCGCGAGCAATG)/5aNOTI-R(ATAAGAATGCGGCCGCTCATGCCCCAACGTA),使用高保真pfu DNA聚合酶从pLB-ATG5a上扩增TaATG5a的全长ORF。扩增片段经电泳、回收和NotⅠ酶切后连接于原核表达载体pET30a的相应切点处,经测序鉴定插入方向正确的重组表达载体pET-ATG5a。提取载体质粒并将其导入到大肠杆菌表达菌种BL21(DE3)中。
1.2.2 原核表达将含有pET-ATG5a的菌种BL21(DE3)划线接种于固体LBK培养基(含50 mg/L卡那霉素的LB)表面,过夜培养至长出单克隆。挑取单克隆接种于LBK液体培养基中,37℃振荡培养过夜。将培养物按1%的比例扩大到5 mL相同培养基中,37℃继续振荡培养至对数生长期(OD600约为0.6-0.8)。加入终浓度为500 μmol/L的IPTG,于28℃条件下震荡培养诱导目标基因的表达。分别于诱导后0、2、4、6和8 h取1 mL菌液用于总蛋白的SDS-PAGE分析。
1.2.3 重组蛋白的纯化重组蛋白为N端含组氨酸标签的His(6)-TaATG5a,因此使用Ni-Agarose His标签蛋白纯化试剂盒在非变性条件下纯化重组蛋白。菌体超声破碎、层析柱平衡、蛋白上样及杂蛋白清洗等过程参照试剂盒手册进行。使用从低到高的咪唑浓度梯度洗脱液分段洗脱目标蛋白。对收集的各管洗脱液取20 μL进行SDS-PAGE分析。根据电泳结果混合目标蛋白较纯、含量较高的洗脱液。
1.2.4 抗血清制备和效价检测将纯化的重组蛋白(抗原)溶液与等体积的弗氏佐剂(初次免疫)或弗氏不完全佐剂(加强免疫)完全混合形成油包水的免疫原。对新西兰大白兔进行背部皮下注射免疫,打8-10个点。初次免疫1次,400 μg抗原;此后每10-15 d加强免疫1次,共3次,每次200 μg抗原。取免疫兔子的颈动脉血,室温静置2 h,5 000 r/min离心10 min后收集多抗血清,-20℃保存。以免疫前收集的耳静脉血清作为阴性血清对照。
采用ELISA法对抗血清(一抗)进行抗原结合特异性鉴定和效价测定。对一抗从200倍开始使用PBS进行2倍梯度稀释,空白对照为PBS,阴性对照为阴性血清200倍稀释液。以纯化的His(6)-TaATG5a重组蛋白为抗原包被酶标板,包被好的酶标板经脱脂奶粉封闭、一抗结合、洗涤、二抗(辣根过氧化物酶标记的羊抗兔IgG,1:10 000稀释度)结合和洗涤等步骤后,加入含H2O2的底物TMB溶液显色10 min,再加入2 mol/L的H2SO4终止反应,于450 nm波长处测定并记录吸光值。
1.2.5 Western杂交大肠杆菌或小麦叶片总蛋白经SDS-PAGE分离和半干转印过程转印至PVDF膜上。转印膜经脱脂奶粉封闭、一抗(1:2 000稀释度)结合、洗涤、二抗(辣根过氧化物酶标记的羊抗兔IgG,1:10 000稀释度)结合和洗涤等步骤后,使用ECL化学发光检测试剂盒试剂在化学发光成像系统(ChemiDocXRS+,BioRad)中进行杂交信号的检测和拍照。
2 结果 2.1 小麦TaATG5a的原核表达构建了小麦TaATG5a的原核表达载体pET-ATG5a。28℃震荡培养条件下,在含有该表达载体的大肠杆菌BL21(DE3)培养物中加入IPTG诱导目标基因表达。如图 1所示,经IPTG诱导后的大肠杆菌总蛋白中出现重组蛋白His(6)-TaATG5a条带,表达量在诱导0-8 h范围内随时间的延长逐渐增加,在诱导8 h后达到最高。带有His(6)标签的重组蛋白表观分子量与理论值(47.6 kD)基本一致。
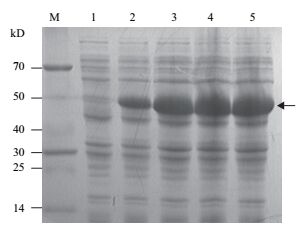
|
| 图 1 小麦TaATG5a基因的原核表达 M:分子量标准;1-5:分别经IPTG诱导0、2、4、6、8 h的大肠杆菌总蛋白。箭头示His(6)-TaATG5a重组蛋白条带位置 |
采用Ni柱亲和层析方法从经IPTG诱导8 h的大肠杆菌总蛋白中纯化重组蛋白His(6)-TaATG5a。重组蛋白挂柱后,使用咪唑浓度逐渐升高的洗脱液进行洗脱。如图 2所示,随着洗脱液中咪唑浓度的升高,杂蛋白含量逐渐减少,目标重组蛋白含量逐渐增加。300 mmol/L咪唑洗脱液中重组蛋白的纯度较高,满足抗体的制备要求。
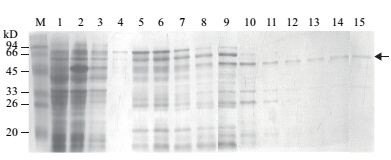
|
| 图 2 原核表达小麦TaATG5a重组蛋白的纯化 M:分子量标准;1:未诱导的大肠杆菌总蛋白;2:经IPTG诱导8 h的大肠杆菌总蛋白;3-18:目标蛋白Ni柱亲和层析过程的洗脱收集液,其中3为流穿液,4-6分别为50 mmol/L咪唑洗脱的第1、2和3管收集液,7-9分别为100 mmol/L咪唑洗脱的第1、2和3管收集液,10-12分别为200 mmol/L咪唑洗脱的第1、2和3管收集液,13-15分别为300 mmol/L咪唑洗脱的第1、2和3管收集液。箭头示重组蛋白条带位置 |
以纯化的重组蛋白His(6)-TaATG5a作为免疫原,经兔免疫方法获得了TaATG5a的抗血清。Western杂交和ELISA实验结果表明,抗血清能特异性识别原核表达的TaATG5a,证实抗血清中特异性抗体的存在(图 3-A和3-B)。Western杂交结果还表明,导入大肠杆菌中的TaATG5a在加入诱导物IPTG之前既有低水平的表达(图 3-A的泳道3),而这种低水平的表达不能被考马斯亮蓝染色检测到(图 3-A的泳道1)。ELISA实验结果中,如以OD值为阴性孔2.1倍的最大稀释度作为抗血清效价,制备的抗血清效价达到1:25 600(图 3-B),满足Western杂交、免疫沉淀等实验对抗体特异性和效价的要求。
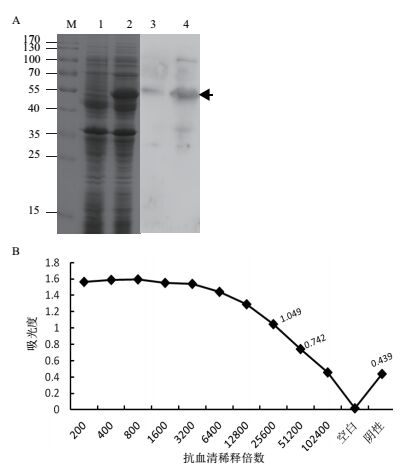
|
| 图 3 抗血清对原核表达TaATG5a重组蛋白的识别 A:Western杂交结果。M:分子量标准(kD);1,3:未诱导的大肠杆菌总蛋白;2,4:经IPTG诱导8 h的大肠杆菌总蛋白。1和2为考马斯亮蓝染色结果;3和4为使用制备的TaATG5a抗血清进行Western杂交后的显色结果。黑色箭头示重组蛋白His(6)-TaATG5a条带位置。B:ELISA法测定抗血清效价 |
使用制备的抗血清对小麦叶片总蛋白进行Western杂交,结果出现两条清晰的杂交带(图 4)。分子量相对较小的带的表观分子量与TaATG5a理论值(40.8 kD)接近,分子量相对较大的带的表观分子量与共价连接的ATG12-ATG5理论值(51.2 kD)接近。因此,初步判断较小的带来自游离形式的TaATG5a及其他六倍体小麦中含有的与TaATG5a大小相近且高度相似的同源蛋白,较大的带来自共价连接的ATG12-ATG5复合物。从杂交信号强度来看,小麦叶片中的ATG5主要以共价连接的ATG12-ATG5形式存在。
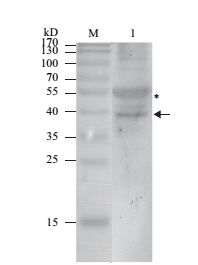
|
| 图 4 利用Western杂交方法鉴定抗血清对小麦内源TaATG5a的识别 M:分子量标准;1:小麦叶片总蛋白;*:共价连接ATG12-ATG5复合物条带位置;箭头:TaATG5a条带位置 |
酵母的自噬分子机制研究于2016年获得诺贝尔生理医学奖,近年来有关高等动植物的自噬机制和生理功能研究方兴未艾。细胞通过自噬过程清除衰老、变性的细胞器、大分子及入侵的病原,藉此维持细胞稳态、协调能量供给、调节信号通路、调控细胞死亡以及响应环境中的生物和非生物胁迫。植物上,已发现自噬与植株正常生长、发育、代谢、衰老以及响应营养缺乏、高盐、干旱、氧化、淹水和病原菌侵染等逆境胁迫过程密切相关。ATG5是参与自噬小体组装的重要因子之一,因而也是植物上开展自噬分子机制和生理功能研究的主要目标基因之一[16-18]。此前本实验室对两个小麦ATG5基因TaATG5a和TaATG5b开展了表达分析和基因沉默等DNA和RNA水平的研究,结果初步表明其参与了小麦的自噬和逆境胁迫响应等过程。后续的基因功能解析工作将涉及蛋白水平的Western杂交和免疫共沉淀等免疫学方法,目标蛋白特异性抗体的获得是开展此类方法研究的必备条件之一。
普通小麦是六倍体物种,含有A、B和D三个同源染色体组,对应二倍体物种的每个基因在普通小麦内通常都以3个多倍体同源基因(Homeolog)的家族形式存在。家族成员蛋白往往大小相近且序列高度相似,以其中一种蛋白全长肽链为抗原制备的多抗往往会与其他蛋白产生交叉反应,难以将它们区分开。小麦TaATG5a和TaATG5b的序列长度相同且相似性达到96%,基因的染色体定位结果也表明了他们的多倍体同源关系(未发表数据),选择TaATG5a或TaATG5b制备的多抗血清在Western杂交中应该能够同时识别小麦总蛋白中每个ATG5家族成员。鉴于此,本研究选择小麦TaATG5a为抗原,通过原核表达载体构建、IPTG诱导表达和亲和层析过程获得了TaATG5a的重组蛋白,使用重组蛋白作为免疫原制备了兔源的TaATG5a抗血清。ELISA和Western杂交实验结果表明,制备抗血清中的多抗能特异性识别原核表达和小麦内源的TaATG5a、效价较高,为今后在小麦上通过免疫学方法深入研究ATG5和自噬的功能、筛选鉴定ATG5互作蛋白等工作奠定了基础。此外,使用制备的抗血清通过Western杂交还能够鉴定共价连接的小麦ATG12-ATG5复合物,而且结果显示此复合物是小麦ATG5的主要存在形式,与拟南芥和动物ATG5存在形式的报道一致[23, 24]。
4 结论利用原核表达和蛋白纯化方法获得了小麦TaA-TG5a的重组蛋白,制备了重组蛋白的抗血清。抗血清能特异性识别TaATG5a,效价达到1:25 600。制备的抗血清还能够识别共价连接的小麦ATG12-ATG5复合物,该复合物是小麦叶片中ATG5的主要存在形式。
| [1] | Liu Y, Bassham DC. Autophagy:pathways for self-eating in plant cells[J]. Annu Rev Plant Biol, 2012, 63: 215–237. DOI:10.1146/annurev-arplant-042811-105441 |
| [2] | Li F, Vierstra RD. Autophagy:a multifaceted intracellular system for bulk and selective recycling[J]. Trends Plant Sci, 2012, 17: 526–537. DOI:10.1016/j.tplants.2012.05.006 |
| [3] | Hanada T, Noda NN, Satomi Y, et al. The Atg12-Atg5 conjugate has a novel E3-like activity for protein lipidation in autophagy[J]. J Biol Chem, 2007, 282: 37298–37302. DOI:10.1074/jbc.C700195200 |
| [4] | Romanov J, Walczak M, Ibiricu I, et al. Mechanism and functions of membrane binding by the Atg5-Atg12/Atg16 complex during autophagosome formation[J]. EMBO J, 2012, 31: 4304–4317. DOI:10.1038/emboj.2012.278 |
| [5] | Nakatogawa H, Ichimura Y, Ohsumi Y. Atg8, a ubiquitin-like protein required for autophagosome formation, mediates membrane tethering and hemifusion[J]. Cell, 2007, 130: 165–178. DOI:10.1016/j.cell.2007.05.021 |
| [6] | Xie Z, Nair U, Klionsky DJ. Atg8 controls phagophore expansion during autophagosome formation[J]. Mol Biol Cell, 2008, 19: 3290–3298. DOI:10.1091/mbc.E07-12-1292 |
| [7] | Le Bars R, Marion J, Le Borgne R, et al. ATG5 defines a phagophore domain connected to the endoplasmic reticulum during autophagosome formation in plants[J]. Nat Commun, 2014, 20, 5: 4121. |
| [8] | Nishida Y, Arakawa S, Fujitani K, et al. Discovery of Atg5/Atg7-independent alternative macroautophagy[J]. Nature, 2009, 461(7264): 654–658. DOI:10.1038/nature08455 |
| [9] | Murrow L, Malhotra R, Debnath J. ATG12-ATG3 Interacts with Alix to promote basal autophagic flux and late endosome function[J]. Nat Cell Biol, 2015, 17(3): 300–310. DOI:10.1038/ncb3112 |
| [10] | Jounai N, Takeshita F, Kobiyama K, et al. The Atg5-Atg12 conjugate associates with innate antiviral immune responses[J]. Proc Natl Acad Sci USA, 2007, 28, 104(35): 14050–14055. |
| [11] | Yousefi S, Perozzo R, Schmid I, et al. Calpain-mediated cleavage of Atg5 switches autophagy to apoptosis[J]. Nat Cell Biol, 2006, 8(10): 1124–1132. DOI:10.1038/ncb1482 |
| [12] | Maskey D, Yousefi S, Schmid I, et al. ATG5 is induced by DNA-damaging agents and promotes mitotic catastrophe independent of autophagy[J]. Nat Commun, 2013, 4: 2130. |
| [13] | Chung T, Suttangkakul A, Vierstra RD. The ATG autophagic conjugation system in maize:ATG transcripts and abundance of the ATG8-lipid adduct are regulated by development and nutrient availability[J]. Plant Physiol, 2009, 149: 220–234. DOI:10.1104/pp.108.126714 |
| [14] | 王燕, 刘玉乐. 植物细胞自噬研究进展[J]. 中国细胞生物学学报, 2010, 32(5): 677–689. |
| [15] | Xia K, Liu T, Ouyang J, et al. Genome-wide identification, classification, and expression analysis of autophagy-associated gene homologues in rice(Oryza sativa L.)[J]. DNA Res, 2011, 18: 363–377. DOI:10.1093/dnares/dsr024 |
| [16] | Han S, Yu B, Wang Y, et al. Role of plant autophagy in stress response[J]. Protein Cell, 2011, 2(10): 784–791. DOI:10.1007/s13238-011-1104-4 |
| [17] | Zhou J, Yu JQ, Chen Z. The perplexing role of autophagy in plant innate immune responses[J]. Mol Plant Pathol, 2014, 15(6): 637–645. DOI:10.1111/mpp.2014.15.issue-6 |
| [18] | Yang X, Bassham DC. New insight into the mechanism and function of autophagy in plant cells[J]. Int Rev Cell Mol Biol, 2015, 320: 1–40. DOI:10.1016/bs.ircmb.2015.07.005 |
| [19] | 孙鸿, 张微, 卫晓静, 等. 小麦重要自噬相关基因ATG18的鉴定和表达分析[J]. 中国农业科学, 2014, 47(9): 1657–1669. |
| [20] | 张微, 孙鸿, 邢莉萍, 等. 小麦自噬相关基因ATG10的克隆及白粉菌侵染诱导的ATG10的表达[J]. 作物学报, 2014, 40(8): 1392–1402. |
| [21] | Pei D, Zhang W, Sun H, et al. Identification of autophagy-related genes ATG4 and ATG8 from wheat(Triticum aestivum L.)and profiling of their expression patterns responding to biotic and abiotic stresses[J]. Plant Cell Rep, 2014, 33: 1697–1710. DOI:10.1007/s00299-014-1648-x |
| [22] | Yue JY, Sun H, Zhang W, et al. Wheat homologs of yeast ATG6 function in autophagy and are implicated in powdery mildew immunity[J]. BMC Plant Biol, 2015, 15: 95. DOI:10.1186/s12870-015-0472-y |
| [23] | Phillips AR, Suttangkakul A, Vierstra RD. The ATG12-conjugating enzyme ATG10 is essential for autophagic vesicle formation in Arabidopsis thaliana[J]. Genetics, 2008, 178(3): 1339–1353. DOI:10.1534/genetics.107.086199 |
| [24] | Codogno P, Meijer AJ. Atg5:more than an autophagy factor[J]. Nat Cell Biol, 2006, 8(10): 1045–1047. DOI:10.1038/ncb1006-1045 |




