2. 昆明医科大学第三附属医院,昆明 650101
2. Third Affiliated Hospital of Kunming Medical University, Kunming 650101
胃癌(Gastric cancer)是比较常见的一种恶性肿瘤,其发病率和死亡率较高,在我国每年死于胃癌的人数高达十几万[1],目前热疗在肿瘤治疗上应用较广,但它在临床应用中存在一些缺点,如体温明显升高会使心脏的负荷增加,引起神经上、生理上的不良反应,而温和的全身热疗由于温度上升范围小而延长治疗时间,且在温和热疗的治疗条件下,肿瘤细胞的活性可能仍维持较高水平。所以,温度过高或治疗时间过长,都会增加治疗的危险性,甚至引起一系列副作用[2, 3]。因此,寻找有效的治疗手段是医学界急待解决的问题。目前已有相关文献报道,生理性深层海水(PDSW)是“平衡微量元素”不可替代的最佳资源[4],它具有低温、水质洁净稳定、富含营养成分和矿物成分、细菌和病原菌较少等特点,将热疗与PDSW相结合,能提高全身热疗的疗效,减轻副作用。
胃癌的发生通常是因为癌基因的激活和抑癌基因的抑制或失活而引起的。环氧合酶-2(COX-2)是合成前列腺素E2(PGE2)的一个关键酶[5, 6]。大量研究表明COX-2表达高低与胃癌的发生密切相关[7]。COX-2在正常组织中表现出低表达或不表达,但在肿瘤细胞中的表达量较高,因而使肿瘤细胞中的PGE2大量合成,PGE2除了能够使肿瘤细胞快速生长增殖,还会激活Bcl-2的表达,Bcl-2为凋亡抑制基因,Bcl-2的表达则会抑制癌细胞的凋亡[8]。
近年来,已有很多基于COX-2和Bcl-2基因在癌组织中的表达及其临床意义的研究[9],但关于PDSW联合热疗对胃癌细胞COX-2和Bcl-2基因表达的影响还未见报道,因此,本实验通过PDSW联合热疗,对人胃癌SGC-7901细胞进行体外培养,并将SGC-7901细胞注入裸鼠皮下,应用实时荧光定量PCR和Western blot来检测胃癌细胞及裸鼠组织中COX-2、Bcl-2 mRNA和蛋白的表达情况,旨在探讨PDSW联合热疗对COX-2和Bcl-2 mRNA及蛋白表达的影响,为PDSW联合热疗治疗胃癌提供分子依据,以期为胃癌的辅助治疗提供新的思路。
1 材料与方法 1.1 材料人胃癌SGC-7901细胞,由昆明医科大学第三附属医院肿瘤研究所提供。PDSW来源:取我国南海海域的“深层海水”(海平面200 m以下),闭光运送至昆明,室温闭光储存,在超微过滤后,用铜锌合金去除海水中的重金属,用反复冻融的方法浓缩海水,并去除多余的盐份,制备成PDSW,其主要元素含量测定由农业部产品质量监督检验测试中心(昆明)检测,具体方法见本实验室前期的研究[10]。4-5周龄BALB/c-nu/nu雄性裸鼠。
1.2 方法 1.2.1 细胞培养与处理用含有10% FBS的RPMI-1640培养液培养SGC-7901细胞,置于5% CO2、37℃的恒温培养箱中,隔天换液1次。当细胞汇合并铺满培养瓶底约80%-90%时进行传代。待稳定增长后,取对数生长期、细胞活力达到95%的细胞,制成单细胞悬液,接种于6孔板中,培养24 h后,进行分组处理。对照组(NC):培养基+ SGC-7901+生理盐水;实验组(PDSW):培养基+ SGC-7901+PDSW(1:38稀释,50 mL培养液加1.3 mL PDSW);空白组(CON):培养基+ SGC-7901。分别置于37℃(常规细胞培养)、40℃(持续培养6 h)、43℃(持续培养1 h)热疗温度下培养,复温37℃后继续培养48 h,收集样品。
1.2.2 SGC-7901人胃癌裸鼠皮下移植瘤模型建立购买4-5周龄BALB/c-nu/nu雄性裸鼠,明暗交替适应性饲养1周后开始实验。在左腋背部皮下注射SGC-7901细胞,至肿瘤长至直径为3 mm大小时,按温度、给药不同随机分为5组,入组饲养至肿瘤长至直径1 cm大小时开始热疗,隔日热疗一次,至第45 d处死全部小鼠。具体分组处理如下:荷瘤鼠+H2O+RT;荷瘤鼠+H2O+40℃;荷瘤鼠+H2O+43℃(H2O为生理盐水);荷瘤鼠+PDSW+40℃;荷瘤鼠+PDSW+43℃。
1.2.3 基因表达分析采用TaKaRa公司的Trizol Reagent提取SGC-7901细胞和裸鼠皮下移植瘤组织中的总RNA,提取得到的RNA用由超微量分光光度计(Biomate3)和琼脂糖凝胶电泳检测其质量。检测合格的RNA用ABI High capacity cDNA reverse transcription试剂盒进行反转录。将反转录后得到的cDNA作为模板,按照ABI公司的荧光定量分析试剂盒(SYBR Select Master Mix)进行RT-PCR,荧光定量反应体系为:SYBR Premix Ex Taq TM Ⅱ(2×)10 μL,上下游引物各1 μL,cDNA模板2 μL,RNase-free water 6 μL,总体积20 μL。根据引物设计原则,从NCBI上获得的目的基因mRNA全长序列,并使用软件设计人的内参基因GAPDH和目的基因COX-2、Bcl-2,引物见表 1。反应在ABI-7500荧光定量PCR仪器中进行,以GAPDH为内参,运用2-△△t法进行分析,△△CT=(CT目的基因-CT管家基因)实验组-(CT目的基因-CT管家基因)。每个实验数据3次重复。
使用RIPA裂解液(购自北京索莱宝生物科技有限公司)提取细胞和组织中的总蛋白,用BCA蛋白浓度测定试剂盒(购自碧云天生物科技有限公司)检测所得蛋白的浓度,采用Western blot检测蛋白条带,最后用图像分析软件ImageJ对目的蛋白及内参蛋白(GAPDH)条带进行灰度值测试,以目的/内参灰度值比值表示蛋白表达情况。
1.2.5 数据处理数据用统计软件SPSS11.5分析和Duncan多重比较,统计结果用软件Sigmaplot10.0作图。
2 结果 2.1 SGC-7901细胞中COX-2和Bcl-2基因表达情况分别提取SGC-7901细胞CON、NC和PDSW组在3个温度条件处理下的总RNA,琼脂糖凝胶电泳检测RNA结果(图 1)显示,电泳后均出现了3条清晰的rRNA条带,表明提取的RNA质量较好。
|
| 图 1 RNA琼脂糖凝胶电泳检测 1-3:37℃;4-6:40℃;7,8:43℃ |
总RNA经逆转录合成cDNA后,进行qRT-PCR检测。对获得的CT值进行相对定量分析,结果表明,热疗后3个处理下的COX-2基因表达量均随温度的升高而不断下降,PDSW+43℃联合热疗组COX-2基因mRNA水平有较大幅度的下调,比37℃处理下的表达量低24.3%,表现出显著差异(P=0.015),但相同温度条件下空白组和生理盐水组下降差异不显著,分别比37℃处理下的表达量低16.1%和19.5%(图 2-A);热疗后3个处理下的Bcl-2基因表达量均下调,PDSW+43℃联合热疗组Bcl-2 mRNA水平下调量较大,比37℃处理下的表达量低23.0%(图 2-B),表现出显著差异(P=0.018)。说明热疗能有效抑制COX-2和Bcl-2基因的表达,PDSW联合热疗组COX-2和Bcl-2表达量更低。
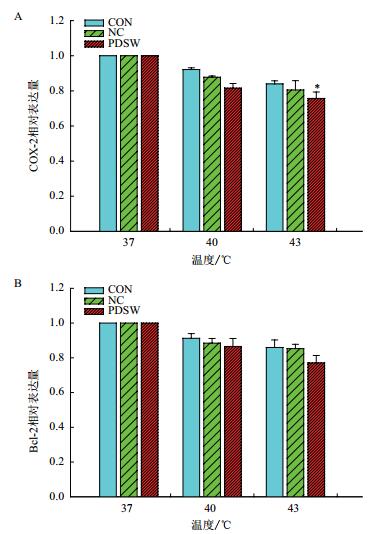
|
| 图 2 SGC-7901细胞中COX-2(A)和Bcl-2(B)荧光定量检测结果 *表示P < 0.05水平显著差异,**表示P < 0.01水平显著极差异,下同 |
分别提取不同温度处理下裸鼠肿瘤组织中的总RNA,用紫外分光光度仪测定RNA的纯度和浓度,OD260/280比值均在1.8-2.0之间,表明提取的RNA纯度较高,1%琼脂糖凝胶电泳检测RNA结果(图 3)表明,电泳后均出现了28S、18S和5S三条清晰的rRNA条带,表明提取RNA较好。
|
| 图 3 RNA琼脂糖凝胶电泳图谱 |
总RNA经逆转录合成cDNA后,进行qRT-PCR检测,对获得的CT值进行相对定量分析,结果(图 4)表明,与常温处理条件相比,在H2O+40℃、H2O+43℃、PDSW+40℃和PDSW+43℃的处理条件下,COX-2和Bcl-2的表达水平均下降,且在相同温度下,PDSW组的表达量低于H2O组的表达量。对于COX-2,PDSW+40℃处理下表达量比正常组低22.4%,表现出显著差异(P=0.015),同时比H2O+40℃处理下的表达量低14.7%,PDSW+43℃处理下表达量比正常组低57.1%,表现出极显著差异(P=0.00),同时比H2O+43℃处理下的表达量低31.9%;对于Bcl-2,PDSW+40℃处理下表达量比正常组低15.3%,差异不显著(P=0.061),同时比H2O+40℃处理下的表达量低9.0%,PDSW+43℃处理下表达量比正常组低35.0%,表现出极显著差异(P=0.002),同时比H2O+43℃处理下的表达量低20.4%。表明PDSW联合热疗后胃癌组织中COX-2和Bcl-2基因的表达水平下降,并且随着温度的升高,表达下降差异更明显。
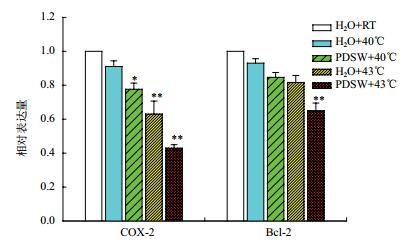
|
| 图 4 qRT-PCR检测COX-2和Bcl-2基因在mRNA水平的表达 |
分别提取不同处理细胞的总蛋白,经BCA法定量后,每个胶孔中加入等量的蛋白,以GAPDH为内参,运用Western blotting检测细胞中COX-2和Bcl-2蛋白表达,结果(图 5)表明,在相对分子量74 kD(COX-2)和26 kD(Bcl-2)的位置出现了清晰的目的条带。
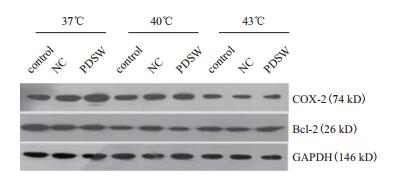
|
| 图 5 Western Blot检测细胞中COX-2和Bcl-2的蛋白条带 |
用Image J图像分析软件分别对目的蛋白COX-2、Bcl-2和内参GAPDH蛋白条带分别进行分析,计算其表达量。运用t检验进行显著性差异分析,结果显示如图 6。在PDSW联合热疗下,COX-2/GAPDH灰度比值明显下调,且差异性显著,在43℃下CON、NC和PDSW组分别比在37℃下低30.5%(P=0.004)、44.5%(P=0.00)和54.7%(P=0.00)。Bcl-2/GAPDH在PDSW联合热疗下的灰度比值也下降,在43℃下CON、NC和PDSW组分别比在37℃下低28.3%(P=0.001)、9.6%(P=0.16)和10.1%(P=0.00)。表明不同温度不同条件处理后,COX-2和Bcl-2蛋白表达量均降低,在PDSW联合热疗处理下蛋白表达较低,与基因表达情况一致。
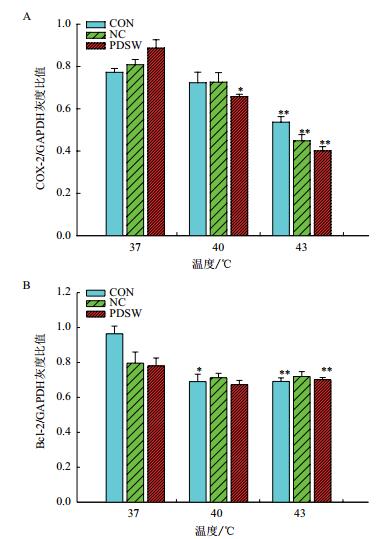
|
| 图 6 不同处理下细胞中COX-2(A)和Bcl-2(B)蛋白表达情况 |
分别提取不同处理裸鼠组织中的总蛋白,以GAPDH为内参,运用Western blotting检测细胞中COX-2和Bcl-2蛋白表达,得到的目的蛋白条带如图 7。

|
| 图 7 Western Blot检测组织中COX-2和Bcl-2的蛋白条带 |
用ImageJ图像分析软件分别对目的蛋白COX-2、Bcl-2和内参GAPDH蛋白条带分别进行半定量分析,计算其表达量。运用t检验进行显著性差异分析,结果(图 8)显示,在H2O+RT、H2O+40℃、PDSW+40℃和H2O+43℃处理组中,胃癌组织中COX-2和Bcl-2蛋白表达变化不明显,在PDSW+43℃处理下表达急剧下降,与正常组相比,COX-2和Bcl-2蛋白表达量分别比正常组低43.5%(P=0.004)和16.9%(P=0.016)。说明PDSW联合热疗能有效降低COX-2和Bcl-2蛋白的表达量。
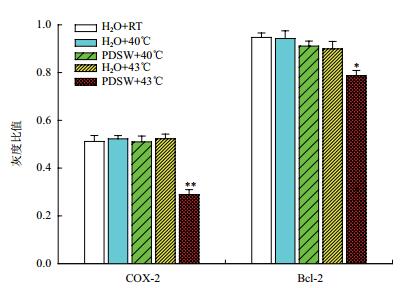
|
| 图 8 不同处理下组织中COX-2和Bcl-2蛋白表达情况 |
在肿瘤治疗中,热疗既能诱导细胞凋亡,又能使细胞直接死亡,很多体外研究发现,热疗一般存在一个阈温度,主要机制为在阈值以下温度诱导细胞的凋亡,而阈值以上温度则会引起细胞坏死。Tang等[11]研究表明,对于多数胃癌细胞而言,43℃只有短暂的抑制细胞增殖的作用,并不存在细胞凋亡。PDSW能为细胞生长提供平衡的微量元素,本实验室前期的研究表明,由于肿瘤细胞在功能和结构上存在缺陷,因此在PDSW条件下,正常细胞表达增强,提高了热的阈温度值,增强了耐热能力;而肿瘤细胞代谢能力旺盛,在PDSW条件下,细胞内富集了某些元素,可导致这些元素在瘤细胞中不断积累并超载,从而使肿瘤细胞的阈温度降低,耐热力降低[12]。本研究通过PDSW联合热疗对胃癌SGC-7901细胞进行体外和体内处理,检测COX-2和Bcl-2基因及蛋白的表达,试图从分子及蛋白层面上来解释PDSW联合热疗对胃癌细胞的抑制作用机制。
COX-2蛋白是一种可诱导型限速酶,一般在正常的组织中含量很低,当发生炎症反应时能被迅速诱导,从而导致发热、红肿或疼痛等症状的发生。有关研究表明,COX-2蛋白在结肠癌[13]、乳腺癌[14]等癌组织中表达量较高,COX-2可能有以下几方面的作用机制[15-17]:(1)加快合成前列腺素,抑制机体免疫反应;(2)促进肿瘤血管形成并抑制肿瘤细胞的凋亡;(3)使肿瘤细胞基质中金属蛋白表达上调;(4)诱导活化致癌前体物质。由于COX-2高表达发生在癌前病变,且显著高于正常组织,所以一般认为COX-2的高表达出现在肿瘤发生早期,因此很多研究把COX-2作为治疗胃癌的靶点。李士坤等[7]检测了不同类型的胃息肉组织,发现其中都有COX-2蛋白的表达,且不同类型间的表达率存在显著差异,尤其是瘤样组织中的COX-2蛋白表达极为显著。有研究发现[18],COX-2蛋白在胃癌组织、不典型增生组织、萎缩化生性病变组织、浅表性胃炎组织和正常胃黏膜组织中的表达情况完全不同,在胃癌组织中表达率最高,正常胃黏膜组织中表达最低,其中,不典型增生组织中COX-2蛋白的表达率随着病变程度的加重而增高,认为COX-2与胃癌发生前期有密切联系。由于COX-2的高表达会使肿瘤细胞中的PGE2大量合成,PGE2除了能够使肿瘤细胞快速生长增殖,还会激活凋亡抑制基因Bcl-2的表达,最终会抑制癌细胞的凋亡,加快癌变的发展。本研究通过PDSW联合热疗对胃癌细胞及组织进行处理,结果表明,无论在SGC-7901细胞中还是裸鼠皮下移植瘤的组织中,热疗均能降低COX-2基因及蛋白的表达,通过抑制COX-2的表达来抑制癌细胞的增长,同时,与生理盐水组相比,PDSW联合热疗处理下,细胞和组织中COX-2表达量显著下降,这说明PDSW与热疗相联合,能有效抑制COX-2的表达,从而抑制胃癌肿瘤细胞的增长。
癌基因Bcl-2是一个凋亡抑制基因,近年来已发现Bcl-2基因在结肠癌、淋巴瘤和乳腺癌等很多肿瘤组织中均过表达[9]。Bcl-2的表达与胃癌关系密切,Forones等[20]研究了胃癌中Bcl-2蛋白的表达情况,发现在胃癌组织中,Bcl-2蛋白的表达率为68%,显著高于其在肠化组织中的表达率,而且早期胃癌组织中的表达率要比进展期胃癌组织的表达率高。因此,Bcl-2同样在正常的胃黏膜组织中表达量较低。Bcl-2蛋白的表达量在胃癌从良性向恶性过渡的过程中逐渐升高,在胃癌组织和正常组织中表达存在显著性差异。田明等[21]研究发现,胃癌组织和正常胃组织中的Bcl-2蛋白表达率分别为62.5%和14.3%,表明Bcl-2基因在胃癌发生过程中起重要作用,其高表达同样是胃癌发生的早期事件。彭鹏等[22]研究推测,Bcl-2与肿瘤的进展无显著相关,而与癌变前期的过程有关。因此可将Bcl-2的表达情况作为监测胃黏膜早期癌变与否的指标。本研究结果表明,没经过处理的SGC-7901细胞和裸鼠皮下移植瘤的组织中,Bcl-2基因和蛋白的表达较高,可反映出胃癌细胞较高的增殖活性,经热疗处理后,Bcl-2表达量降低,且PDSW联合热疗处理后Bcl-2表达量更是显著降低,间接反映出PDSW联合热疗能有效抑制胃癌细胞的增殖,从而起到治疗肿瘤的效果。
本实验前期应用PDSW联合热疗对肝癌细胞进行了研究发现,单用PDSW处理肝癌细胞时,没有促进肝癌细胞的生长,但PDSW联合热疗后,能使带肝癌肿瘤的实验动物生存时间延长,且能增强热疗的抗癌作用[12]。本研究结果也表明,PDSW联合热疗可以通过控制癌基因和抑癌基因的表达,进而抑制人胃癌SGC-7901细胞的增殖和移植瘤实验动物癌组织的增长,提高抗癌作用。综上所述,PDSW联合热疗能有效抑制SGC-7901细胞和裸鼠皮下移植瘤组织中COX-2、Bcl-2基因和蛋白的表达,从而抑制胃癌细胞的增殖。其中更多的作用机制和抑制途径,还需进行深入的研究,关于PDSW联合热疗能抑制SGC-7901细胞的增殖,其在临床上的应用,以及可能产生的不良反应、并发症等还需大量的研究。
4 结论PDSW联合热疗能有效抑制SGC-7901细胞和裸鼠皮下移植瘤组织中COX-2、Bcl-2基因和蛋白的表达,从而抑制胃癌细胞的增殖,最终达到治疗肿瘤的疗效。
| [1] | 季蒙蒙, 杨金伟, 杜斌, 等. 天麻素对胃癌细胞活力和凋亡的影响[J]. 现代生物医学进展, 2015(13): 2421–2424. |
| [2] | 张佳慧, 秦丽娟. 肿瘤热疗的研究进展[J]. 前沿进展, 2012, 9: 1424–1426. |
| [3] | 闫向勇, 刘文超. 热疗在肿瘤治疗中的研究进展[J]. 世界中西医结合杂志, 2014, 9(2): 213–216. |
| [4] | 崔进. "深层海水"在医学领域中的研究[J]. 昆明医学院学报, 2011, 32(8): l–2. |
| [5] | Kozak KR, Rowlinson SW, Marnett LJ. Oxygenation of the endocannabinoid, 2-arachidonylglycerol, to glyceryl prostaglandins by cyclooxygenase-2[J]. J Biol Chem, 2000, 275: 33744–33749. DOI:10.1074/jbc.M007088200 |
| [6] | Radmark O, Shimizu T, Jornvall H, et al. Leukotriene A4 hydrolase in human leukocytes. Purification and properties[J]. J Biol Chem, 1984, 259: 12339–12345. |
| [7] | 李士坤, 任庆梅, 陈克河. 不同类型胃息肉组织中COX-2基因蛋白的表达及其意义[J]. 中国实用医药, 2012, 7(29): 51–52. DOI:10.3969/j.issn.1673-7555.2012.29.029 |
| [8] | 田慧军, 邓涛, 沈志祥, 等. 大肠癌和大肠腺瘤COX-2和Bcl-2的基因表达及其意义[J]. 胃肠病学和肝病学杂志, 2003, 12(6): 544–546. |
| [9] | 肖炜明, 施瑞华, 丁岩冰, 等. 胃癌组EGFR和COX-2表达的意义及其相关性[J]. 世界华人消化杂志, 2007, 15(2): 123. |
| [10] | 李为明, 崔进, 徐鹏远. 代佑果, 深层海水对小鼠创面愈合的促进作用[J]. 重庆医学, 2014, 2(43): 462–464. |
| [11] | Tang R, Zhu ZG, Qu Y, et al. The impact of hyperthermic chemotherapy on human gastric cancer cell lines:preliminary results[J]. Oncol Rep, 2006, 16(3): 549–559. |
| [12] | 代佑果. "深层海水"与热疗联合治疗肝细胞癌的实验性研究[M]. 昆明医科大学, 2014. |
| [13] | Miladi-Abdennadher I, Abdelmaksoud-Dammak R, Ayed-Guerfali DB, et al. Expression of COX-2 and E-cadherin in Tunisian patients with colorectal adenocarcinoma[J]. Acta Histochemica, 2012, 114(6): 577–581. DOI:10.1016/j.acthis.2011.11.002 |
| [14] | Serra KP, Sarian LO, Rodrigues-Peres RM, et al. Expression of cyclooxygenase-2(COX-2) and p53 in neighboring invasive and in situ components of breast tumors[J]. Acta Histochemica, 2012, 114(3): 226–231. DOI:10.1016/j.acthis.2011.05.001 |
| [15] | Leung WK, To RF, Ng YP, et al. Association between cyclooxygenase-2 overexpression and missense P53 mutations, in gastric cancer[J]. Br J Cancer, 2001, 84(3): 335–339. DOI:10.1054/bjoc.2000.1607 |
| [16] | 李百文, 沈强. 胃癌不同临床病理分期中环氧合酶与E基质金属蛋白酶的表达及其相关性[J]. 复旦学报:医学版, 2007, 34(1): 223. |
| [17] | 李杰, 杨红, 郝洪岭, 等. 环氧合酶2与肿瘤研究进展[J]. 临床误诊误治, 2012, 25(4): 73–75. |
| [18] | 陈美霓, 郭浩, 郭巍, 等. COX-2蛋白和VEGF-C蛋白在胃癌和非胃癌黏膜病变组织中的表达及临床意义[J]. 海南医学, 2015, 26(18): 2671–2674. DOI:10.3969/j.issn.1003-6350.2015.18.0972 |
| [19] | Forones NM, Carvalho AP, Giannotti-Filho O, et al. Cell proliferation and apoptosis in gastric cancer and intestinal metaplasia[J]. ArqGastroenterol, 2005, 42(1): 30–34. |
| [20] | Anagnostopoulos GK, Stefanou D, Arkoumani E, et al. Bax and Bcl-2 protein expression in gastric precancerous lesions:immunohisto chemical study[J]. J Gastroenterol Hepatol, 2005, 20(11): 1674–1678. DOI:10.1111/jgh.2005.20.issue-11 |
| [21] | 田明, 张云锋, 杜宁, 等. PTEN和bcl-2在胃癌组织中的表达及临床意义[J]. 陕西医学杂志, 2011, 40(2): 148–151. |
| [22] | 彭鹏, 邹文蓉. p53, VEGF, Bcl-2在进展期胃癌组织中的表达[J]. 现代医药卫生, 2011, 27(2): 184–186. |





