2. 上海申漕特种水产开发公司,上海 201516
2. Shanghai Shencao Special Fisheries Development Corps, Shanghai 201516
罗氏沼虾(Macrobrachium rosenbergii)原产于东南亚一带,是我国目前主要的淡水经济养殖品种,在水产养殖经济增长和农业发展中占有重要地位。但近几年来由于环境、养殖模式等多方面因素的影响,罗氏沼虾出现严重的种质衰退现象;另一方面,罗氏沼虾病害日益严重,给我国水产养殖业带来严重的灾难[1]。要解决这个问题必须研究罗氏沼虾抗病机制以及培育抗病新品种。
热休克蛋白70(Heat stress proteins 70,HSP-70),是机体在受到应激时细胞内迅速合成的一种蛋白质,它具有高度保守性,能增加机体的自身保护反应,可以增强细胞对损害的耐受程度,维持细胞的正常代谢,提高细胞的生存率[2, 3],因此热休克蛋白70是衡量罗氏沼虾抗病力的一个重要因素。甲壳动物的免疫系统与脊椎动物有很大不同,无特异性免疫,主要是非特异性免疫,这种免疫重要是依靠一些酶来完成的,所以研究免疫过程中的免疫相关酶以提高罗氏沼虾自身的免疫能力是很有必要的[4]。有研究指出谷胱甘肽过氧化物酶在生物体的抗氧化方面,以及体内遭受到病原体感以后产生的免疫活动中发挥着重要的作用,从而保护生物机体免受体内产生的过量活性氧分子的损害[5, 6]。根据谷胱甘肽过氧化物酶的活性中心是否含硒可以分为含硒的谷胱甘肽过氧化物酶(Se-GPx)和不含硒的谷胱甘肽过氧化物酶(non-Se-GPx)两种类型[7, 8],目前甲壳动物中发现的GPx均为Se-GPx[9, 10]。过氧化氢酶(CAT)可以清除生物体产生的H2O2,在生物体内发挥着抗氧化的作用[11, 12]。超氧岐化酶(SOD)也是生物体内存在的一种抗氧化酶,它对生物体内自由基的清除起着重要作用,有清除O2的作用[13]。同时超氧岐化酶也是甲壳类动物体液免疫的一部分,是衡量甲壳类动物非特异性免疫性状的重要指标。溶藻弧菌(Vibrio alginolyticus)是引起壶菌病发生的一种重要的致病菌,目前有关溶藻弧菌致病性的研究报道有很多,本实验室在罗氏沼虾育苗池中水体中分离得到溶藻弧菌。
基于以上理论支撑,本实验选育四代的4个抗病选择系(A、B、C、D)的罗氏沼虾,在人工感染溶藻弧菌后,通过RT-PCR方法检测4个选择系肝胰腺中4个抗病力基因(HSP70、Se-GPx、CAT、SOD)表达量的差异,并结合4个选择系死亡率比较其抗病力,初步探讨溶藻弧菌对罗氏沼虾肝胰腺中4个抗病力基因表达量的影响,以及以上几个基因和罗氏沼虾抗病力之间的关系,对本实验室4个罗氏沼虾选择系的抗病力进行比较分析,选择出抗病力较强的选择系,为本实验室下一代的抗病选育工作提供理论支持,同时希望能为罗氏沼虾病害防治工作和免疫机理的深入研究提供理论依据。
1 材料与方法 1.1 材料 1.1.1 实验动物实验用罗氏沼虾为本实验室人工选择配对和育苗,自然交尾建立的4个罗氏沼虾抗病专门化选择系子四代选择系(A、B、C、D),选择体长(7.25±0.74)cm,体重(13.46±4.31)cm的虾作为实验用虾。每个选择系实验动物均放在水泥池中暂养一周,水温25-28℃,每天投喂两次,每隔一天换一次水(换水量约为1/3),持续充气。
1.1.2 主要仪器及试剂荧光定量PCR仪、凝胶成像仪(德国Biostep)、梯度PCR(Eppendorf)、台式冷冻离心机(Eppendorf)、RNAiso plus(TaKaRa)、反转录试剂(TaKaRa)、DNAmarker(天根生物)、氯仿、无水乙醇、PCR引物由生工生物上海部合成。
1.2 方法 1.2.1 感染实验溶藻弧菌的培养:实验菌种来自上海海洋大学病原库,保种的菌种先经过异养菌培养基(PGY)培养12 h后,接种到弧菌选择培养基(TCBS)进行特异性培养,最终制备成1×106 CFU/mL(用平板计数法计数)的溶藻弧菌菌悬液于4℃保存。
感染:4个选择系中每个选择系随机挑选180只罗氏沼虾,设置3个平行,在罗氏沼虾第二腹节基部注射0.2 mL浓度为1×106 CFU/mL的溶藻弧菌菌悬液。
1.2.2 总RNA的抽提4个选择系分别在感染溶藻弧菌0、6、12、24、48和96 h后取肝胰腺,然后在液氮中充分研磨加入1 mL RNAiso plus,静止5 min后加入0.2 mL氯仿在4℃离心机中12 000 r/min离心15 min,小心吸取上清液0.4 mL至新的离心管中,再加入0.5 mL异丙醇静止10 mim后于4℃离心机中12 000 r/min离心10 min,倒掉上清液加1 mL 75%乙醇在4℃离心机中7 500 r/min离心5 min,倒掉液体得到总RNA,最后用1%琼脂糖电泳检测RNA的完整性。
1.2.3 cDNA的合成将完整无降解并且测得OD260nm/OD280nm值1.8-2.0的RNA用TaKaRa公司反转录试剂盒说明书上的方法反转录成cDNA,将反转录好的cDNA放-20℃冰箱保存。
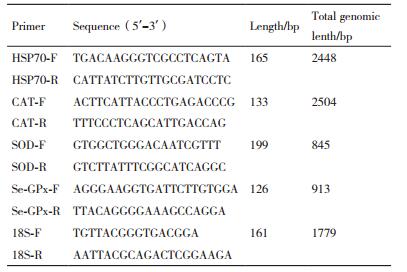
1.2.4 荧光定量PCR反应分析基因的表达刘波等[2]根据GenBank发布的罗氏沼虾HSP70序列(AY466445.1),设计HSP70的引物。在GenBank中查得罗氏沼虾过氧化氢酶(HQ668089.1)、超氧歧化酶(DQ121374.1)、含硒谷胱甘肽过氧化物酶(FJ670566.1)及18S(GQ131934.1)序列,设计引物序列见表 1,引物均由上海生工生物工程(上海)股份有限公司合成。
荧光定量PCR反应体系(20 μL体系):7.5 μL SYBR Premix Ex Taq,0.3 μL引物F,0.3 μL引物R,0.6 μL cDNA模板,6.3 μL ddH2O。荧光定量PCR反应程序:95℃预变性30 s;95℃变性5 s,60℃退火30 s,55℃延伸15 s,40个循环。
1.3 数据分析罗氏沼虾各基因mRNA的相对表达量用Livak和Schmittgen建立的2-ΔΔCt计算法计算。然后用目的基因与内参基因18S得比值来表示目的基因的相对表达量。数据用SPSS17.0统计软件进行分析,P < 0.05认为差异显著。
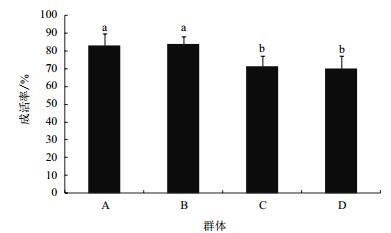
2 结果 2.1 四个选择系成活率比较 2.1.1 养殖比较分析经历了100 d的养殖,4个罗氏沼虾选择系的养殖成活率表现出一定的差异,4组罗氏沼虾选择系养殖成活率比较如图 1所示,A、B两个选择系成活率显著高于C、D两个选择系P < 0.05,选择系B成活率最高,达到83.39%。其余3个选择系A、C、D成活率分别为82.78%、71.11%和70%。
|
| 图 1 四组罗氏沼虾选择系养殖成活率比较 |
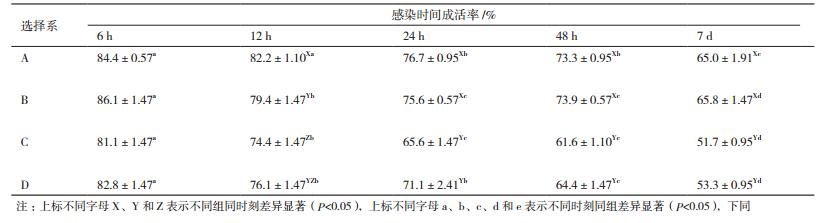
人工注射感染溶藻弧菌后,4个选育选择系A、B、C、D之间的抗病感染能力表现出一定的差异(表 2)。注射感染12 h时,A选择系成活率极显著高于B选择系(P < 0.01),且显著高于D选择系(P < 0.05),B选择系成活率显著高于C选择系(P < 0.05)。注射感染24 h时,A、B选择系成活率极显著高于C选择系(P < 0.01),并且A、B抗病选择系成活率显著高于D选择系(P < 0.05),B、D选择系成活率显著高于C选择系(P < 0.05)。注射感染48 h以及2周后,A、B选择系成活率极显著高于C、D两个选择系(P < 0.01)。综上所述,4个抗病选择系在感染溶藻弧菌后成活率存在一定差异,A、B选择系抗病力明显强于C、D选择系,这对以后育种工作具有重要的指导意义。
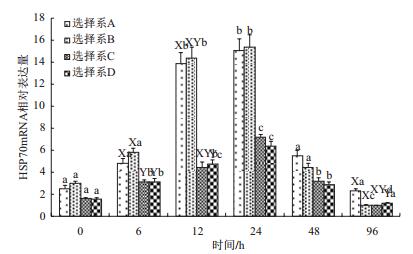
4个抗病选择系感染溶藻弧菌后肝胰腺HSP70 mRNA的相对含量如图 2所示,总体变化趋势是:0-24 h HSP70基因表达量剧烈增加,之后相对表达量降低,48 h与96 h之间表达量无差异。12、24 h时HSP70 mRNA的相对表达量明显高于其他时间段(P < 0.01)。4个抗病选择系之间肝胰腺HSP70 mRNA的相对含量为:感染6 h时B选择系相对表达量高于C、D选择系相对表达量(P < 0.05),12、24 h时A、B两个抗病选择系的肝胰腺HSP70 mRNA的相对表达量明显高于C、D两个抗病选择系(P < 0.05),48 h时A选择系的肝胰腺HSP70 mRNA的相对表达量明显高于C、D两个抗病选择系(P < 0.05),其他时间段各个选择系之间肝胰腺HSP70 mRNA相对表达量差异不显著。
|
| 图 2 四个罗氏沼虾选择系感染溶藻弧菌后肝胰腺中HSP70 mRNA相对表达量 |
4个抗病选择系在感染溶藻弧菌后肝胰腺中Se-GPx mRNA各个时间段的相对表达量如图 3所示,总体变化趋势是:感染到0-24 h,4个选择系Se-GPx mRNA表达量逐渐升高,到24 h达到峰值。24-96 h,4个选择系Se-GPx mRNA表达量逐渐降低。4个选择系之间肝胰腺中Se-GPx mRNA各个时间段相对表达量:0 h时,B抗病选择系的肝胰腺Se-GPx mRNA的相对表达量明显高于A、C、D三个抗病选择系(P < 0.05),A抗病选择系的肝胰腺Se-GPx mRNA的相对表达量明显高于D抗病选择系(P < 0.05);6 h时,B抗病选择系的肝胰腺SeGPx mRNA的相对表达量极显著高于C、D两个抗病选择系(P < 0.01),A抗病选择系的肝胰腺Se-GPx mRNA的相对表达量显著高于C、D三个抗病选择系(P < 0.05);24 h和48 h时,A、B两个抗病选择系的肝胰腺Se-GPx mRNA的相对表达量显著高于C、D两个抗病选择系(P < 0.05)。

|
| 图 3 四个罗氏沼虾选择系感染溶藻弧菌后肝胰腺中SeGPx mRNA相对表达量 |
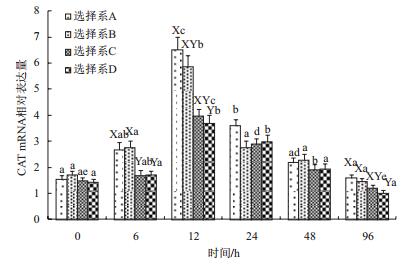
4个抗病选择系在感染溶藻弧菌后肝胰腺中CAT mRNA各个时间段的相对表达量如图 4所示,总体变化趋势是:感染到0-12 h,4个选择系CAT mRNA表达量逐渐升高,到12 h达到峰值。12-96 h,4个选择系CAT mRNA表达量逐渐降低。4个选择系之间肝胰腺中CAT mRNA各个时间段相对表达量:6 h时,A、B两个抗病选择系的肝胰腺CAT mRNA的相对表达量显著高于C、D抗病选择系(P < 0.05);12 h时,A抗病选择系的肝胰腺CAT mRNA的相对表达量显著高于D抗病选择系(P < 0.05);96 h时,A、B抗病选择系的肝胰腺CAT mRNA的相对表达量显著高于D抗病选择系(P < 0.05)其他时间段4个抗病选择系间CAT mRNA相对表达量差异。
|
| 图 4 四个罗氏沼虾选择系感染溶藻弧菌后肝胰腺中CAT mRNA相对表达量 |
4个抗病选择系在感染溶藻弧菌后肝胰腺中SOD mRNA各个时间段的相对表达量如图 5所示,总体变化趋势是:感染至0-24 h,4个选择系SOD mRNA表达量逐渐升高,到24 h达到峰值。24-96 h,4个选择系SOD mRNA表达量逐渐降低。4个选择系之间肝胰腺中SOD mRNA各个时间段相对表达量:0 h时,B抗病选择系的肝胰腺SOD mRNA的相对表达量显著高于A、D抗病选择系(P < 0.05)且极显著高于A抗病选择系(P < 0.01);24、48 h时,B抗病选择系肝胰腺SOD mRNA的相对表达量显著高于C、D抗病选择系(P < 0.05),其他时间段内4个抗病选择系间SOD相对表达量差异不显著。

|
| 图 5 四个罗氏沼虾选择系感染溶藻弧菌后肝胰腺中SOD mRNA相对表达量 |
水生动物一般终生生活在水环境中,所以它们与环境之间的关系是最为紧密的,两者之间的关系大部分是通过HSP70实现的。生物体在热和其他因素刺激(重金属离子、缺氧、病毒及细菌感染等)时,会发生热休克反应用来抑制蛋白的合成,而热休克蛋白能通过修复、重新折叠变性蛋白及解离聚集的蛋白,达到对肌体和细胞的保护作用。其中HSP70是最为重要的一类[14-16]。有研究报道HSP70的较高表达能保护人单核细胞免受过氧化氢引起的毒害、人的A-431细胞免受氰化钠的伤害[17]。水产动物也有相关报道指出HSP70表达水平的高低对水产动物的抗逆性和环境的适应能力都具有直接关系。NAKANO等对两种潮间杜父鱼(Oligocottusmaculosus和O. suyderi)的研究表明,当鱼体内的HSP70储存较多时,机体会具有更大的耐受能力,机体能够适应更大的温差变化[18]。Cruz-Rodriguez等用多环芳香烃等化学药品和污染水体的沉积物来刺激美洲牡蛎发现,牡蛎体内HSP70表达量明显增加,表明HSP70参与了机体对不良环境的抵御作用,从而参与了维持细胞内环境的稳定。本实验也发现罗氏沼虾在感染溶藻弧菌后,肝胰腺中HSP70 mRNA表达量在0、6、12和24 h内呈上升趋势,48-96 h表达量降低,这也表明罗氏沼虾在感染溶藻弧菌后,自身的保护反应触发,体内迅速促使合成HSP70。结合4个罗氏沼虾感染存活率比较可以得出结论:HSP70 mRNA表达量较高的选择系具有较高的成活率,因此HSP70 mRNA的高表达量与生物体的抗逆性能力呈正相关。
3.2 溶藻弧菌感染96 h内4个选择系罗氏沼虾肝胰腺中非特异性免疫免疫Se-GPx、CAT、SOD基因相对含量的差异当生物体受到细菌、病毒等侵染时,甲壳动物会发生呼吸爆发的现象,这种呼吸爆发以及其他免疫活动中产生的活性氧分子会在细胞内产生积累,对机体细胞产生严重的损害[19-21]。鉴于这种损害,甲壳动物的体内会产生了很多的具有抗氧化作用的酶,一旦有过氧化物在体内生成,便会立刻发挥作用,利用本身的氧化还原作用将过氧化物转化为无害或毒害较低的物质[22]。有研究指出对凡纳滨对虾注射溶藻弧菌(Vibrio alginolyticus),用RT-PCR对Se-GPx基因mRNA在血淋巴细胞中的表达量分析后,发现随着呼吸爆发现象的发生,Se-GPx基因的相对表达量在0-6 h时显著升高,这也说明Se-GPx与凡纳滨对虾免疫过程有着紧密相关,因此在甲壳动物中Se-GPx基因的表达水平可以作为其适应外界变化和抵御外界病原体入侵的重要指标[23, 24]。CAT是抗氧化酶的其中一个,它在清除过氧化物和超氧自由基、减少或阻止羟基自由基的形成等方面发挥着重要作用。SOD也是体内清除氧自由基主要的酶,它能有效地清除并终止O2引发的一系列反应,对生物体的抗氧化和氧化平衡起关键作用[25-28]。有很多研究者也发现,给南美白对虾投喂免疫增强剂之后,虾体内SOD的抗氧化活性会有上升,虾的抗病能力也会增强、在感染细菌和病毒后的存活率有升高。Cheng等[29]克隆了罗氏沼虾cMnSOD的基因,并且对对虾进行注射细菌(Lactococcus garvieae),研究了该基因在血细胞和肝胰腺中的表达情况。孙燕等[30]研究在饲料中添加益生菌,凡纳滨对虾的成活率和肝胰腺中SOD基因的相对表达量都有所上升。张庆利[31]对对虾感染WSSV后发现血细胞中的CAT基因的转录趋势与CAT活性的变化趋势基本一致,说明虾感染WSSV后,通过大幅度提高CAT基因的转录,合成大量的CAT,调控细胞内氧化还原反应的动态平衡,在杀灭抵御感染的免疫反应过程中起作用。在感染细菌或病毒后,通过荧光定量检测,基因较高的表达量和生物的高成活率存在正相关的关系,因此本实验通过对4个罗氏沼虾抗病选择系感染溶藻弧菌,通过荧光定量技术对4个选择系罗氏沼虾的非特异性基因表达量进行检测分析,4个抗病选择系在感染溶藻弧菌后肝胰腺中的Se-GPx、CAT、SOD表达量都有所增加,这也说明这3种酶参与了罗氏沼虾的体液免疫。这表明Se-GPx、CAT、SOD对溶藻弧菌的侵入反应比较敏感,在免疫过程中发挥着积极作用,可能为罗氏沼虾的抗病能力以及病害防治工作提供理论依据。比较4个罗氏沼虾选择系在感染96 h内Se-GPx、CAT、SOD相对表达量水平,可得出结论:在4个选择系不同时间Se-GPx、CAT、SOD表达量也不相同,但是总体变化趋势是A、B选择系高于C、D选择系。
4 结论通过分析罗氏沼虾4个抗病选择系感染溶藻弧菌后肝胰腺中4个抗病力基因相对表达量的不同,再结合4个选择系感染溶藻弧菌后成活率B>A>D>C,可以得出结论:甲壳动物体内HSP70、Se-GPx、CAT、SOD均参与了清除弧菌、保护生物体的免疫反应,且几个基因表达量水平和机体的抗病力有直接的关系,表达量相对较高的生物体具有较强的抗病能力。本实验室选育的4个抗病选择系的抗病力强弱也有不同,B选择系高于其他3个选择系,A选择系抗病力高于C、D选择系,C和D选择系抗病力差异不大。
| [1] | Goyard E, Patrois J, Peignon JM, et al. Selection for better growth of Penaeus styliostrisin Tahiti and New Caledonia[J]. Aquaculture, 2002, 204(3-4): 461–468. DOI:10.1016/S0044-8486(01)00831-6 |
| [2] | 刘波, 明俊超, 谢骏. 人黄葱醒提取物对罗氏沼虾高温下抗氧化能力与热应激蛋自70基因表达的影响[J]. 水产学报, 2010, 34(6): 973–980. |
| [3] | Yahav S, Shamay A, Horev G, et al. Effect of acquisition of improved thermotolerance on the induction of heat shock proteins in broiler chickens[J]. Poult Sci, 1997, 76: 1428–1434. DOI:10.1093/ps/76.10.1428 |
| [4] | 管晓娟. 甲壳动物体液免疫相关酶及免疫因子的研究概况[J]. 生命科学仪器, 2009(6): 3–6. |
| [5] | Li FH, Xiang JH. Signaling pathways regulating innate immune responses in shrimp[J]. Fish Shellfish Immunol, 2013, 34(4): 973–980. DOI:10.1016/j.fsi.2012.08.023 |
| [6] | 姜晶晶, 张殿昌, 麻建军. 合浦珠母贝含硒谷胱甘肽过氧化物酶基因特征与表达分析[J]. 福建农林大学学报:自然科学版, 2010, 39(6): 614–621. |
| [7] | 李义. 甲壳动物免疫学的研究进展[J]. 水利渔业, 2003, 23(1): 4–6. |
| [8] | Liu J, Zhang K, Ren X, et al. Bioimprinted protein exhibits glutathione peroxidase activity[J]. Anal Chim Acta, 2004, 504: 185–189. DOI:10.1016/S0003-2670(03)00763-3 |
| [9] | Wang XW, Wang JX. Pattern recognition receptors acting in innate immune system of shrimp against pathogeninfections[J]. Fish Shellfish Immunol, 2013, 34(4): 981–989. DOI:10.1016/j.fsi.2012.08.008 |
| [10] | Wu CL, Mai KS, Zhang WB, et al. Molecular cloning characteriza-tion and mRNA expression of selenium-dependent glutathione peroxidase from abalone Haliotis discus hauuai lnoin response to dietary selenium zinc and iron[J]. Comparative Biochemistry and Physiology C, 2010, 152: 121–132. |
| [11] | Campacordova AI, Hermandezsaavedra NY, Dephilippis R, et al. Generation of superoxide anion and SOD activity in haemocytes and muscle of American white shrimp(Litopenaeus uannamei)as a response to beta-glucan and sulphated polysaccharide[J]. Fish Shellfish Immunology, 2002, 12: 353–366. DOI:10.1006/fsim.2001.0377 |
| [12] | Flegel TW, Sritunyalucksana K. Shrimp molecular responses to viral pathogens[J]. Marine Biotechnology, 2011, 13: 587–607. DOI:10.1007/s10126-010-9287-x |
| [13] | 黄旭雄, 周洪琪, 宋理平. 急性感染对中国明对虾非特异免疫水平的影响[J]. 水生生物学报, 2007, 31(3): 325–331. |
| [14] | Dong YW, Dong SL, Ji TT. Effect of different thermal regimes on growth and physiological perfdrmance of the sea cucumber Apostichopus japonicus Selenka[J]. Aquaculture, 2008, 275: 329–334. DOI:10.1016/j.aquaculture.2007.12.006 |
| [15] | 林亚秋, 郑玉才, 吉红. 草鱼HSP70基因cDNA部分序列克隆及其组织表达差异[J]. 淡水渔业, 2009, 39(4): 67–71. |
| [16] | Cara JB, Alura N, Moyano FJ., et al. Fooddeprivatton induces Hsp-70 and Hsp90 protein expression in fry gilthead sea bream and rai-nbow trout[J]. Comp Biochem Physiol B, 2005, 142: 426–431. DOI:10.1016/j.cbpb.2005.09.005 |
| [17] | Polla BS, Kantengwa S, Franccis D, et al. Mitochondria are effects of heat shock against oxidative injury[J]. Proc Natl Acad Sci, 1996, 93(13): 6458–6463. DOI:10.1073/pnas.93.13.6458 |
| [18] | 苏永腾, 刘波, 周群兰, 等. 大黄蒽醌提取物对罗氏沼虾抗鳗弧菌感染的研究[J]. 水产学报, 2008, 32(3): 455–463. |
| [19] | Nakano K, Iwama G. The 70-kDa heat shock protein response in two intertidal sculpins, Oligocottus maculosus and O. snyderi:relationship of hsp70 and thermal tolerance[J]. Comparative Biochemistry and Physiology, Part A:Molecular & Integrative Physiology, 2002, 133(1): 79–94. |
| [20] | Wang WN, Zhou J, Wang P, et al. Oxidative stress DNA damage and antioxidant enzyme gene expression in the Pacific white shrimp Litopeaaeus vannamei when exposed to acute pH stress[J]. Comparative Biochemistry and Physiology C, 2009, 150: 428–435. |
| [21] | Tassanakajon A, Somboonwiwat K, Supungul P, et al. Discovery of immune molecules and their crucial functions in shrimp immunity[J]. Fish Shellfish Immunol, 2013, 34(4): 954–967. DOI:10.1016/j.fsi.2012.09.021 |
| [22] | Choi CY. Molecular characterization and mRNA expression of glutathione peroxidase and glutathione S-transferase during osmotic stress in olive flounder(Paralichthy solivaceus)[J]. Comparative Biochemistry andPhsiology, 2008, 149: 330–337. DOI:10.1016/j.cbpa.2008.01.013 |
| [23] | Hoffmann JA. The immune response of Drosophila[J]. Science, 2003, 426(6): 33–38. |
| [24] | Cheng W, Liu CH, Kuo CM, et al. Dietary administration of sodium alginate enhances the immune ability of white shrimp Litopeaaeus vannamei and its resistance against Vibrioal giaolyticus[J]. Fish Shellfish Immunol, 2005, 18: 1–12. DOI:10.1016/j.fsi.2004.03.002 |
| [25] | 王雪参. 日本沼虾含硒谷胱甘肽过氧化物酶全长克隆及表达分析[D]. 新乡: 河南师范大学, 2012. |
| [26] | 曹剑香, 简纪常, 吴灶和. 溶藻弧菌疫苗对凡纳滨对虾免疫功能的影响[J]. 湛江海洋大学学报, 2004, 24(6): 12–17. |
| [27] | 刘洋, 凌去非, 于连洋, 等. 氨氮胁追对泥鳅不同组织T-SOD和GSH-PX活性的影响[J]. 安徽农业科学, 2011, 39(2): 1069–1072. |
| [28] | 王启军, 张宏福, 王永军. 热激蛋白在动物应激反应中的作用机制[J]. 饲料工业, 2006, 27(11): 14–17. DOI:10.3969/j.issn.1001-991X.2006.11.006 |
| [29] | Cheng W, TungYS, Liu CH, Chen JC. Molecularcloning and characterization of cvtosolic manganese superoxide dismutase(cytMn-SOD)from the giant freshwater prawn Macrobrachium rosenbergii[J]. Fish Shellfish Immunol, 2006, 20(4): 438–449. DOI:10.1016/j.fsi.2005.05.016 |
| [30] | 孙艳, 刘飞, 麦康森, 等. 饲料中添加益生元对凡纳滨对虾非特异性免疫基因表达量和抗病力的影响[J]. 海洋与湖沼, 2013, 43(4): 845–851. |
| [31] | 张庆利. 中国明对虾免疫系统中抗氧化相关基因的克隆与表达分析[D]. 青岛: 中国科学院海洋研究所, 2007. |