鲍曼不动杆菌是一种非发酵的革兰氏阴性的机会致病菌,可以引起呼吸机相关肺炎、败血症、泌尿系感染、脑膜炎等疾病,它可以造成严重的免疫系统损害,是医院获得性感染的重要致病菌[1]。近年来由于抗生素的滥用,鲍曼不动杆菌的抗生素耐药问题已经日渐突出,临床出现大量多耐药菌株,甚至出现了多粘菌素和替加环素耐药菌株,给治疗带来了极大困难,增加患者的死亡率,急需找到一种治疗感染的新方法[2-4]。鲍曼不动杆菌已被美国传染病协会列为6种最危险微生物之一[5]。但到目前为止,鲍曼不动杆菌的致病机制及其导致抗生素耐药的机制尚不明确。
研究表明鲍曼不动杆菌的外膜蛋白(Outer membrane protein,OMP)是其毒力的主要部分,在鲍曼不动杆菌的致病性方面发挥了关键作用。外膜蛋白是镶嵌在革兰氏阴性菌脂质双层中的特殊蛋白,它是由反向平行的β-折叠通过相邻氢键连接而成的β-桶状结构,维护菌体外膜的稳定性,抵御外界不利环境,承担着细菌与外界物质的运输交换等生物学功能[6]。外膜蛋白存在于菌体分泌的外膜囊泡中(Outer membrane vesicles,OMVs),外膜囊泡可以和宿主细胞膜表面的脂阀(lipid rafts)相互作用,将外膜蛋白等毒力因子释放到宿主细胞内,从而导致细胞凋亡[7]。Smani[8]通过质谱技术从鲍曼不动杆菌分泌的OMVs中鉴定出了Omp34,它是鲍曼不动杆菌的主要毒力蛋白之一,Omp34是纤维连接蛋白的配体,可使鲍曼不动杆菌黏附侵袭宿主细胞。McConnell MJ用鲍曼不动杆菌OMVs免疫小鼠后可以产生IgG类抗体,对鲍曼不动杆菌再感染具有保护作用,菌体分泌的OMVs中含有6种主要毒力蛋白其中也包括Omp34[9]。
Omp34和外膜蛋白33(Outer membrance protein 33,Omp33)是2005年由Germán Bou从鲍曼不动杆菌JC10/01和JC7/04株上克隆出来的,研究指出这两种蛋白与抗生素耐药高度相关,其表达失活可以提高鲍曼不动杆菌对碳青霉烯药物的耐药率[10]。但目前仅有报道证实Omp33可以介导细胞凋亡并具有调节自噬的功能,其缺失会导致鲍曼不动杆菌的黏附侵袭力减低,减少细胞的死亡[11, 12]。而到目前Omp34的结构和其导致宿主细胞的毒性作用等生物学功能的研究国内外还鲜有报道。由于命名上的差异,有的学者将这两种蛋白认定为同一蛋白[12]。我们通过序列比对发现Omp34与Omp33存在较高同源性,基因序列的相似度为76%,氨基酸序列的相似度为68%,但很显然它们不是同一蛋白。Smani[11]在研究中也提到了Omp34与Omp33基因序列的差异。Omp34与Omp33同属于外膜蛋白家族,基因和氨基酸序列间又有很高相似度,我们推断Omp34与Omp33可能具有类似的生物学功能,Omp34可能是鲍曼不动杆菌非常重要的毒力蛋白之一,其在鲍曼不动杆菌侵袭宿主方面可能发挥了重要作用。所以发现解析鲍曼不动杆菌Omp34的二级结构和功能就显得非常重要,这将从一个新的视角了解鲍曼不动杆菌的致病性,为将来解释鲍曼不动杆菌感染宿主的机制,以及研究其三级结构寻找药物作用靶点治疗鲍曼不动杆菌感染提供了数据支持。
本研究旨在通过分子克隆技术获取鲍曼不动杆菌Omp34,利用圆二色谱技术检测Omp34的二级结构,通过功能试验分析其对宿主细胞的凋亡作用,为进一步研究鲍曼不动杆菌分子致病机制及研发治疗药物奠定基础。
1 材料与方法 1.1 材料Acinetobacter baumannii ATCC 19606和HEK293细胞(CRL-1573)购自美国ATCC;pET28a(+)由本实验室保存;E.coli DH5α、E.coli BL21(DE3)、High Affinity Ni-NTA resin、质粒小提试剂盒、凝胶回收试剂盒、CCK8试剂购自全式金公司(Transgene biotech);限制性内切酶BamH Ⅰ、Xho Ⅰ购自NEB公司;T4 High Ligation V3.0购自TaKaRa公司;超滤管购自milipore公司;His多克隆抗体够自CST公司;凋亡检测试剂盒购自南京凯基生物公司;SK3071非干扰型蛋白定量试剂盒购自上海生工;引物和测序由北京奥科公司完成;Anti-cleaved-caspase3和Anti-cleaved-PARP购自Abcam公司;GAPDH抗体购自CST公司;核酸电泳仪和蛋白质电泳仪为Bio-Rad公司产品;圆二色谱仪J-715为日本Jasco公司产品;流式细胞仪为Beckman coulter公司产品;其余试剂为进口和国产分析纯。
1.2 方法 1.2.1 鲍曼不动杆菌Omp34基因的扩增根据GenBank公布的Omp34基因(AM039631.1)序列,设计引物Ab-Omp34F:5'-TTTGGATCCATGAAAAAACTTGGTTT-3'(划线部分为BamH Ⅰ酶切位点),Ab-Omp34R:5'-GAACTCGAGGAAACGGAATTTAGCA-3'(划线部分为Xho Ⅰ酶切位点),以鲍曼不动杆菌基因组DNA为模板扩增Omp34基因。PCR扩增体系为:上下游引物(10 μmol/L)各1.25 μL,dNTP0.2 μL,10x缓冲液10 μL,Taq DNA聚合酶0.25 μL,加ddH2O至总体积25 μL。反应条件为:94℃预变性10 s,94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环,72℃延伸10 min。1%的琼脂糖凝胶电泳检测扩增产物,目的条带用DNA凝胶纯化试剂盒回收。
1.2.2 重组表达质粒pET28a(+)-Omp34的构建将回收的扩增产物Omp34和pET28a(+)载体分别用BamH Ⅰ和Xho Ⅰ进行双酶切,回收Omp34和pET28a(+)载体,用T4连接酶(TaKaRa)16℃连接30 min,转化E.coil DH5α感受态细胞,37℃倒置培养16 h后从LB平板上挑取单克隆加入3 mL含50 μg/mL卡那霉素的LB液体培养基中,摇床37℃,200 r/min振荡培养6 h后进行菌液PCR验证,选择菌液PCR呈阳性的菌液提取重组质粒pET28a(+)-Omp34双酶切鉴定,阳性质粒送北京奥科公司进行双向测序。
1.2.3 Omp34诱导表达及表达形式鉴定将测序正确的重组质粒pET28a(+)-Omp34转化E.coli BL21(DE3)感受态,37℃培养16 h后挑取单克隆接种至5 mL LB液体培养基(含50 μg/mL卡那霉素),37℃,200 r/min摇菌培养过夜,次日以1:100加入新鲜LB液体培养基中,37℃,200 r/min震荡培养,待OD600达到0.6时,分别在37℃、1 mmol/L IPTG或16℃、0.5 mmol/L IPTG条件下诱导4 h,诱导结束后4℃,12 000×g离心10 min,菌体沉淀用500 μL lysis buffer(50 mmol/L Tris-Hcl,2 mmol/L EDTA,100 mmol/L Nacl,0.5%TritonX100)重悬,加入PMSF至终浓度为1 mmol /L,冰浴超声裂解5-10 min。菌体裂解液于4℃,12 000×g离心10 min分离沉淀和上清,沉淀用500 μL lysis buffer重悬。之后加入电泳上样缓冲液,95℃煮沸10 min,10%SDS-PAGE电泳及Coomassie Brilliant Blue法染色脱色检测重组蛋白表达及其可溶性。
1.2.4 Omp34的亲和层析纯化按照1.2.3方法诱导50 mL菌液,菌体沉淀溶于10 mL lysis buffer,超声波裂解细菌10-20 min,使菌体裂解完全,4℃ 12 000×g离心10 min,弃掉上清,沉淀用lysis buffer洗2遍,之后离心取沉淀用5 mL solution buffer(8 mol/L Urea,50 mmol/L Tris-HCl,300 mmol/L NaCl,0.1%Trition X-114,PH8.0)溶解,离心去除不溶解的沉淀部分,此时的上清部分可用于镍柱层析纯化。取2.5 mL Ni-NTA溶液装柱,室温静置20 min,随后在4℃条件下用上述solution buffer平衡层析柱10 min,将含有目的蛋白的溶解液加入层析柱,此时含有His标签的Omp34已结合在镍柱上,之后用含有8 mol/L Urea,50 mmol/L Tris-HCl,300 mmol/L NaCl,50 mmol/L咪唑,0.1%Trition X-114,pH8.0的washing buffer洗涤层析柱,收集流穿液防止目的蛋白丢失,最后用含有8 mol/L Urea,50 mmol/L Tris-HCl,300 mmol/L NaCl,200 mmol/L咪唑,pH8.0的elution buffer洗脱Omp34,在咪唑洗脱的过程中用考马斯亮蓝R250试剂检测蛋白OD值的方法来判断洗脱终点。
1.2.5 Omp34的复性、免疫印迹分析及蛋白浓度检测采用两种复性缓冲液分别透析。第1种复性缓冲液成分为(0.1 mol/L Tris-HCl pH8.5,2 mmol/L EDTA,6 mol/L尿素),第2种复性缓冲液成分参照文献[13-16]向第1种复性缓冲液中加入1 mol/L L-精氨酸、2 mmol/LGSH、0.2 mmol/LGSSG,其余成分不变。将含有Omp34的透析袋分别置于上述2种复性缓冲液,4℃下低速搅拌透析12 h,再逐步降低复性缓冲液中尿素的含量(4 mol/L、2 mol/L和1 mol/L)梯度透析各8 h,最后用PBS透析过夜去除残存的尿素。透析结束后收集透析袋中的蛋白放入截流10 kD以上蛋白的超滤管浓缩(milipore),最后用10% SDS-PAGE分析复性蛋白纯度并用Western blot鉴定,SK3071非干扰型蛋白定量试剂盒测定蛋白浓度。
1.2.6 Omp34的圆二色谱分析应用J-715(日本Jasco)圆二色谱仪,在20℃条件下对纯化蛋白Omp34进行二级结构测定。波长扫描范围为190-250 nm(远紫外区),扫描速度200 nm/min,步长1 nm,样品池厚度1 mm,停留时间1 min,扫描次数3次,以PBS缓冲液作为空白对照。取信号平均值并进行基线校正。CD谱利用spectra manager软件进行数据处理,所得数据用Dichroweb进行在线二级结构分析(http://dichroweb.cryst.bbk.ac.uk),选择CDSSTR算法计算二级结构的α螺旋、β折叠、β转角和无规卷曲的含量。
1.2.7 Omp34结构生物信息学预测应用bioinf程序(http://bioinf.cs.ucl.ac.uk)和Predict Protein程序(https://www.predictprotein.org/)预测Omp34二级结构。PRED-TMBB(http://bioinformatics.biol.uoa.gr/PRED-TMBB/)预测Omp34跨膜域结构。Phyre2程序(http://www.sbg.bio.ic.ac.uk/phyre2/)预测Omp34的三级结构。
1.2.8 Omp34刺激HEK293细胞形态学观察及CCK8检测细胞存活率将对数生长期的HEK293细胞以每孔5×103接种于96孔培养板中,设3个复孔,每孔加入DMEM完全培养基100 μL。在37℃、5% CO2培养箱中培养24 h,用不同浓度的Omp34(5、10、20、40 μg/mL)刺激HEK293细胞12 h,观察10 μg/mL浓度下细胞形态。之后加入CCK-8试剂10 μL,再孵育4 h。450 nm波长酶标仪检测细胞的OD值。细胞存活率(%)=[A(Omp34)-A(空白)]/[A(对照)-A(空白)],其中A(Omp34)=具有细胞、CCK8试剂和Omp34的孔的吸光度;A(空白)=具有培养基和CCK8试剂而没有细胞的孔的吸光度;A(对照)=具有细胞、CCK8试剂而没有Omp34的孔的吸光度。
1.2.9 流式细胞检测Omp34对HEK293的凋亡作用HEK293以5×104个细胞接种在6孔板上,无菌培养24 h后用10 μg/mL Omp34刺激12 h后离心收集细胞,PBS洗3遍,之后取PBS重悬细胞液500 μL,加入500 μL binding buffer,再加入5 μL Annexin V-FITC和5 μL PI,避光孵育15 min后用流式细胞仪(Beckman coulter Gallios)检测。以Annexin V+/PI-判断为早期凋亡,以Annexin V+/PI +判断为晚期凋亡,两种凋亡率之和为总凋亡率。
1.2.10 Western blot分析凋亡相关蛋白的表达HEK293细胞按每孔1×106个接种在6孔板,无菌培养24 h后,以未刺激的细胞作为对照组,刺激组加入10 μg/mL Omp34分别培养12 h、24 h。RIPA裂解液收集细胞,冰上超声破碎,放置20 min后,12 000×g离心5 min,取上清,采用BCA蛋白定量试剂盒测定蛋白浓度,样品加入6×loading buffer,95℃,10 min,之后进行10%SDS-PAGE电泳,转膜条件100 V、1 h,将蛋白转移到PVDF膜,用5%脱脂牛奶室温封闭1 h,之后用一抗(1:1 000)4℃孵育过夜,PBST洗涤10 min×3次,用IRdye680荧光标记山羊抗小鼠IgG(1:20 000)室温孵育1 h,PBST洗涤10 min×3次,用Odyssey红外激光成像仪(LI-COR)进行图像数据分析。
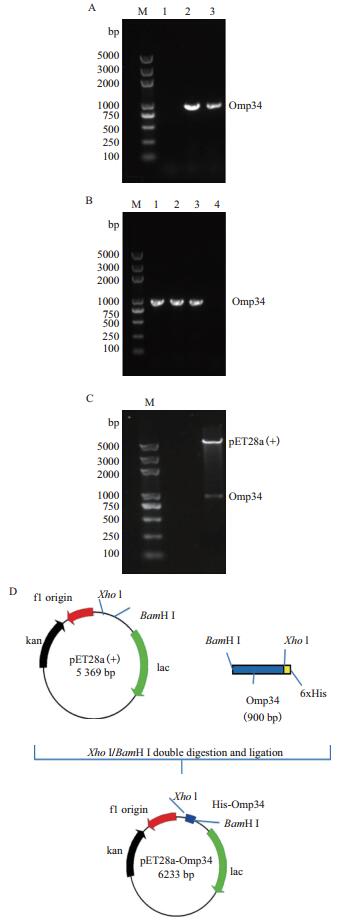
2 结果 2.1 pET28a(+)-Omp34表达质粒的构建与鉴定鲍曼不动杆菌ATCC 19606的基因组DNA为模板,经PCR扩增后得到Omp34基因,用1%琼脂糖凝胶电泳鉴定大小900 bp与预期片段(AM039631.1)大小相一致(图 1-A),未见非特异性扩增带。将扩增的目的片段与表达载体pET28a(+)用BamHⅠ和XhoⅠ双酶切,用T4连接酶连接,转化E.coil DH5α感受态细胞,用Omp34特异性引物进行菌液PCR鉴定结果见图 1-B。测序鉴定为阳性克隆的重组质粒经BamHⅠ和XhoⅠ双酶切,获得约5.3 kb和0.9 kb两条带,大小与载体片段和目的片段长度相符,结果见图 1-C。pET28a(+)-Omp34的质粒结构图见图 1-D。
|
| 图 1 pET28(+)-Omp34表达载体的构建 A:Omp34基因PCR扩增电泳图(M:DNA marker;1:阴性对照;2,3:PCR扩增产物);B:重组质粒pET28a(+)-Omp34菌液的PCR验证(M:DNA marker;1-3:菌液的PCR产物;4:阴性对照);C:pET28a(+)-Omp34的BamH Ⅰ/XhoⅠ双酶切鉴定(M:DNA marker);D:pET28a(+)-Omp34构建图谱 |
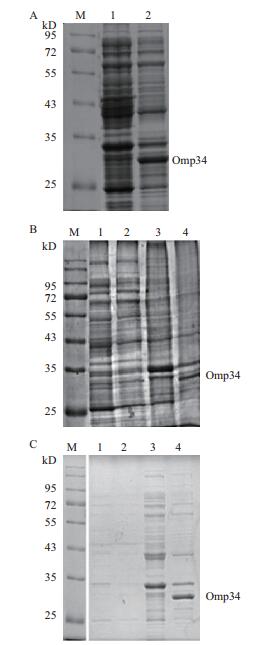
重组质粒pET28a(+)-Omp34转化E.coli BL21(DE3)感受态细胞,用终浓度为1 mmol/L IPTG,37℃诱导4 h,用10% SDS-PAGE分析表达产物。结果(图 2-A)显示,与诱导前相比,IPTG诱导后可以表达32 kD左右的蛋白。重组菌经37℃,1 mmol/LIPTG条件下诱导后上清中无目的蛋白表达,目的蛋白均大量表达于沉淀中(图 2-B)。在16℃,0.5 mmol/L IPTG诱导条件下目的蛋白表达形式依然没有变化,说明降低IPTG浓度和温度对Omp34表达形式没有影响,Omp34以包涵体形式表达(图 2-C)。
|
| 图 2 重组Omp34表达鉴定及其表达形式分析 A:重组蛋白表达鉴定图(M:标准分子量蛋白;1:未诱导细菌总蛋白;2:IPTG诱导细菌总蛋白);B:37℃、1mmol/L IPTG条件下诱导的蛋白表达形式分析(1:未诱导上清;2:IPTG诱导上清;3:未诱导沉淀;4:IPTG诱导沉淀);C:16℃、0.5mmol/L IPTG条件下诱导的蛋白表达形式分析(1:未诱导上清;2:IPTG诱导上清;3:未诱导沉淀;4:IPTG诱导沉淀) |
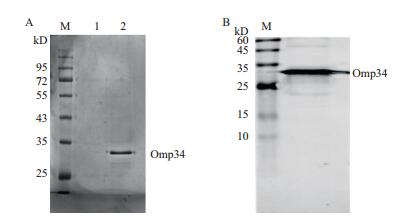
将构建的高表达大肠杆菌BL21-pET28a(+)-Omp34扩大培养并诱导表达,进一步经过镍柱亲和层析纯化、包涵体复性和超滤浓缩,得到的Omp34完整性良好,纯度较高,超滤后流穿液中没有目的蛋白,说明蛋白截留成功(图 3-A)。取复性后的Omp34进行Western blot检测,结果(图 3-B)显示该重组蛋白能被抗His标签抗体识别,在32 kD左右显示出特异条带。纯化后的Omp34采用SK3071非干扰型蛋白定量试剂盒测定,蛋白浓度为1.90 mg/mL,标准方程为:y=-129.75x+121.17,R2=0.997 3。
|
| 图 3 Omp34纯化和免疫印迹鉴定 A:纯化Omp34电泳图(M:标准分子量蛋白;1:超滤后的流穿液;2:超滤浓缩后的Omp34);B:Omp34的western blot鉴定图(M:标准分子量蛋白) |
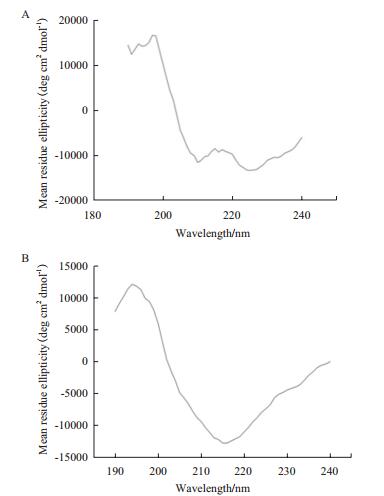
通过圆二色谱鉴定后发现,采用梯度降低尿素浓度的复性方法得到的Omp34不具有β-折叠结构,蛋白没有恢复天然构象(图 4-A)。而在复性液中加入L-精氨酸和GSH/GSSG可以促进二硫键的正确形成,使不正确连接的二硫键重新配对,引导蛋白正确折叠,从而使包涵体中复性的蛋白恢复天然构象。经检测Omp34的圆二色谱曲线在195 nm处有一凸峰、210-215 nm处有一凹峰,是典型的β-折叠结构,说明蛋白恢复了天然构象。通过在线分析软件Dichroweb计算出Omp34的α-螺旋含量为12%、β-折叠为39%、β-转角为22%、无规则卷曲为27%。Omp34的二级结构以β-折叠、转角和无规则卷曲为主,符合革兰氏阴性菌外膜蛋白β桶状结构(图 4-B)。
|
| 图 4 Omp34圆二色谱检测二级结构图 A:不规则折叠的Omp34圆二色谱图,横坐标:波长;纵坐标:平均残基椭圆率;B:正确折叠的Omp34圆二色谱图,横坐标:波长;纵坐标:平均残基椭圆率 |
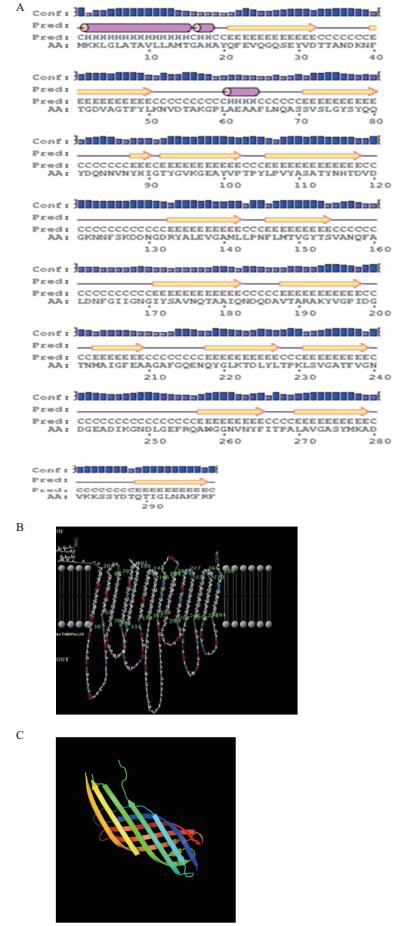
Bioinf程序预测的Omp34二级结构以β折叠和无规则卷曲为主(图 5-A)。PRED-TMBB程序预测Omp34的C端跨膜结构域由14个β-片层组成,N端周质空间结构域不形成β-片层结构,可见Omp34具有典型的革兰氏阴性菌的外膜蛋白β-桶状结构(β-barrel)(图 5-B)。Predict Protein程序是预测蛋白质二级结构的金标准,经分析发现Omp34的二级结构中α螺旋占10.37%、β折叠38.8%、loop结构占50.84%。圆二色谱测定结果与Predict Protein程序预测的结果相似度较高。三级结构预测以鼠疫耶尔森菌Ail蛋白为模板(PDB:c3qraA),结果(图 5-C)显示Omp34为β桶状蛋白,可信度为99%、覆盖率为49%、一致性为14%。
|
| 图 5 生物信息学预测的Omp34结构图 A:Bioinf程序预测的Omp34二级结构图(紫色圆柱表示α螺旋;黄色箭头表示β折叠;黑色实线表示无规则卷曲);B:PRED-TMBB程序Posterior decoding方法预测的Omp34跨膜域结构图;C:Phyre2预测的Omp34三级结构图 |
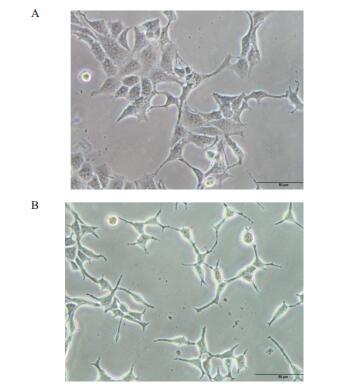
用PBS处理的HEK293细胞形态正常(图 6-A)。而Omp34刺激12 h的HEK293细胞发生了明显的形态改变,细胞皱缩、细胞膜出泡,染色质凝集等细胞凋亡的特征性改变(图 6-B)。
|
| 图 6 Omp34感染HEK293细胞形态观察 |
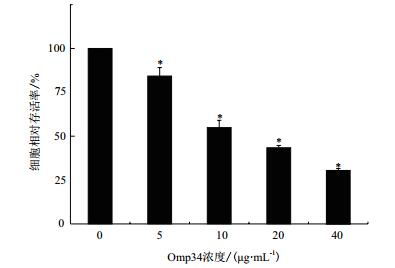
在不同浓度(0、5、10、20和40 μg/mL)Omp34刺激12 h后,随着Omp34刺激浓度增加,OD值呈梯度下降,该作用具有剂量依赖性。5、10、20和40 μg/mL Omp34刺激HEK293细胞12 h后,其存活率显著下降,分别为84.3%、54.9%、43.4%和30.5%,与对照组比较差异具有统计学意义(x± s,*P < 0.05)。大约10 μg/mL浓度为HEK293细胞的半数致死浓度(IC50),结果见图 7。
|
| 图 7 Omp34对HEK293细胞存活率的影响 |
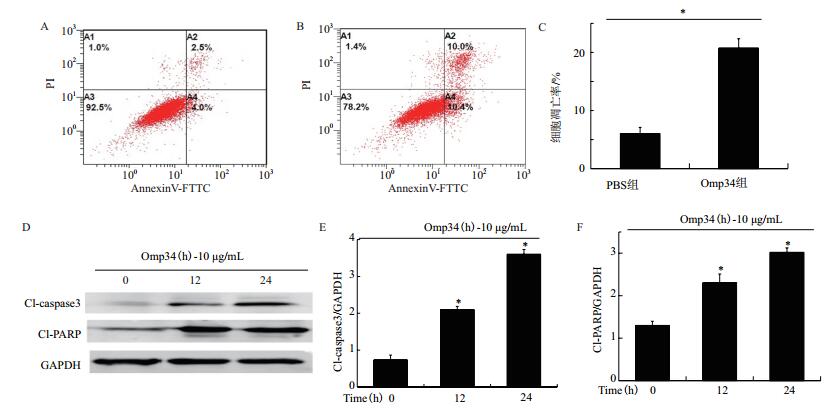
流式细胞术检测结果(图 8-A)显示,PBS处理的HEK293细胞的凋亡率为6.5%,而经10 μg/mL Omp34刺激12 h后的HEK293凋亡率明显上升,为20.4%(图 8-B),Omp34组的凋亡率与PBS组相比差异具有统计学意义(x± s,*P < 0.05)(图 8-C)。为进一步确定凋亡发生,我们检测了凋亡相关蛋白caspase3和PARP的裂解活化部分:Cleaved-caspase3和Cleaved-PARP。在10 μg/mL Omp34刺激12 h后,HEK293细胞中的caspase3和PARP被激活,其活性部分表达量升高,具有时间依赖性(图 8-D),与对照组相比具有统计学差异(x± s,*P < 0.05)(图 8-E和8-F)。
|
| 图 8 Omp34刺激HEK293细胞凋亡分析 A:正常HEK293细胞流式细胞分析图;B:Omp34刺激的HEK293细胞流式细胞分析图;C:凋亡率统计分析图;D:凋亡相关蛋白western blot鉴定图;E:Cl-caspase3表达量统计分析图;F:Cl-PARP表达量统计分析图 |
本研究成功构建了pET28a(+)-Omp34表达质粒,测序结果表明目的基因片段与GenBank中(AM039631.1)鲍曼不动杆菌Omp34基因序列100%一致。经SDS-PAGE鉴定,此次表达纯化的Omp34与GenBank中(CAJ01528.1)报道的Omp34分子量(32 kD)大小一致。但Omp34在大肠杆菌表达系统中以包涵体形式存在,通过优化复性条件得到可溶蛋白,生物信息学预测表明Omp34二级结构中具有大量β折叠,三级结构为β桶状蛋白。圆二色谱也证实了Omp34为β折叠结构。功能试验表明Omp34具有引发宿主细胞凋亡的生物学功能。
为了使Omp34形成可溶性表达,我们采用降低诱导温度和诱导剂含量的方法,但这并不能使Omp34形成可溶性表达,虽然诱导条件的改变对重组蛋白的表达有一定的影响,如温度、IPTG浓度、pH值等,但蛋白是否可以形成可溶性表达还是由蛋白本身的特性决定的。通过生物信息预测到Omp34结构中存在疏水的跨膜域以及N端的分泌信号肽可能都会干扰其形成可溶性表达[17]。未来可以尝试在表达载体上增加亲水性标签或截去Omp34N端信号肽序列或许可以使蛋白形成可溶性表达。
生物功能方面,Omp34可使HEK293细胞形态发生凋亡坏死样改变。CCK8实验说明Omp34可导致HEK293细胞的存活率降低,具有剂量依赖性。通过流式细胞术和免疫印迹试验进一步证明Omp34有促进HEK293细胞凋亡作用。上述结果表明此次从包涵体中复性的Omp34具有良好生物学活性,初步证实其对宿主细胞具有毒性作用,它与已报道的Omp33具有相似功能。研究表明[12]Omp33引起的细胞自噬是一种不完全自噬,即其不能被溶酶体降解,这就为鲍曼不动杆菌在自噬体内大量繁殖创造了必要条件。与它同源的Omp34是否也具有类似的功能,还有待研究证实。未来我们会继续研究Omp34对宿主的毒性作用,以及其在固有免疫和适应性免疫中发挥的作用,了解Omp34与宿主细胞内部分子蛋白的相互作用网络,可以从新的视角解析鲍曼不动杆菌的致病机理。
细菌的外膜孔蛋白是外来分子通过的通道,参与了多种抗菌药物的转运,鲍曼不动杆菌对抗生素耐药的其中一个重要机制就是其外膜孔蛋白的缺失,致使抗生素不能通过此孔道进入菌体内部,使细菌内抗生素浓度降低,当低于有效浓度时就会出现耐药[18]。本研究证实Omp34也是鲍曼不动杆菌的一种外膜孔蛋白,其有可能是抗生素进入菌体的一个重要通道,缺失Omp34的鲍曼不动杆菌对碳氢酶烯类抗生素耐药,我们推测它可能是碳氢酶烯类抗生素进入菌体的特异性通道。因此Omp34在鲍曼不动杆菌的耐药研究方面具有举足轻重的地位。另外,外膜蛋白作为鲍曼不动杆菌的主要毒力因子,具有较好的免疫原性,可以刺激机体产生保护性抗体,现有研究表明多种外膜蛋白可以作为鲍曼不动杆菌疫苗研发的靶点[19-21]。但从我们的发现来看,Omp34即便具有很好的免疫原性,但它是一个膜孔蛋白,其与耐药十分相关,因此可能不适合作为疫苗的候选蛋白。因为当Omp34缺失时,鲍曼不动杆菌就会对抗生素产生耐药,一旦用其作为疫苗免疫宿主后,宿主便产生了大量针对Omp34的抗体,带有Omp34的鲍曼不动杆菌会被免疫反应清除,但缺失Omp34的鲍曼不动杆菌会因此成为优势株而大量繁殖,不但疫苗对其无法起作用,而且还会造成更严重的耐药,将为临床治疗带来巨大问题,因此我们认为将其作为疫苗成分还有待商榷。
4 结论本研究采用原核表达及优化包涵体复性的方法成功获得高纯度的鲍曼不动杆菌ATCC 19606的Omp34,并用圆二色谱鉴定和生物信息分析证明其具有β折叠结构,是一个外膜孔蛋白。纯化的Omp34具有良好的生物学活性可使HEK293细胞发生凋亡。这为进一步研究鲍曼不动杆菌Omp34的生物学功能、解释其耐药机制及研发治疗感染的新药物奠定基础。
| [1] | McConnell MJ, Actis L, Pachón J. Acinetobacter baumannii:human infections, factors contributing to pathogenesis and animal models[J]. FEMS Microbiol Rev, 2013, 37(2): 130–155. DOI:10.1111/j.1574-6976.2012.00344.x |
| [2] | Gordon NC, Wareham DW. A review of clinical and microbiological outcomes following treatment of infections involving multidrug-resistant Acinetobacter baumannii with tigecycline[J]. J Antimicrob Chemother, 2009, 63(4): 775–780. DOI:10.1093/jac/dkn555 |
| [3] | Higgins PG, Dammhayn C, Hackel M, et al. Global spread of carbapenem-resistant Acinetobacter baumannii[J]. J Antimicrob Chemother, 2010, 65(2): 233–238. DOI:10.1093/jac/dkp428 |
| [4] | Perez F, Hujer AM, Hujer KM, et al. Global challenge of multidrug-resistant Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2007, 51(10): 3471–3484. DOI:10.1128/AAC.01464-06 |
| [5] | Talbot GH, Bradley J, Edwards JE, et al. Bad bugs need drugs:an update on the development pipeline from the antimicrobial availability task force of the infectious diseases society of america[J]. Clin Infect Dis, 2006, 42(5): 657–668. DOI:10.1086/499819 |
| [6] | Koebnik R, Locher KP, Van Gelder P. Structure and function of bacterial outer membrane proteins:barrels in a nutshell[J]. Mol Microbiol, 2000, 37(2): 239–253. DOI:10.1046/j.1365-2958.2000.01983.x |
| [7] | Jin JS, Kwon SO, Moon DC, et al. Acinetobacter baumannii secretes cytotoxic outer membrane protein A via outer membrane vesicles[J]. PLos One, 2011, 6(2): e17027. DOI:10.1371/journal.pone.0017027 |
| [8] | Smani Y, McConnell MJ, Pachón J. Role of fibronectin in the adhesion of Acinetobacter baumannii to host cells[J]. PLoS One, 2012, 7(4): e33073. DOI:10.1371/journal.pone.0033073 |
| [9] | McConnell MJ, Rumbo C, Bou G, et al. Outer membrane vesicles as an cellular vaccine against Acinetobacter baumannii[J]. Vaccine, 2011, 29(34): 5705–5710. DOI:10.1016/j.vaccine.2011.06.001 |
| [10] | Maria del Mar Tomas, AlejandroBeceiro, Astrid Perez, et al. Cloning and functional analysis of the gene encoding the 33-to 36-kilodalton outer membrane protein associated with carbapenem resistance in Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2005, 49(12): 5172–5175. DOI:10.1128/AAC.49.12.5172-5175.2005 |
| [11] | Smani Y, Dominguez-Herrera J, Pachon J. Association of the outer membrane protein Omp33 with fitness and virulence of Acinetobacter baumannii[J]. J Infect Dis, 2013, 208(10): 1561–1570. DOI:10.1093/infdis/jit386 |
| [12] | Rumbo C, Tomás M, Fernández Moreira E, et al. The Acinetobacter baumannii Omp33-36 porin is a virulence factor that induces apoptosis and modulates autophagy in human cells[J]. Infect Immun, 2014, 82(11): 4666–4680. DOI:10.1128/IAI.02034-14 |
| [13] | Fraga TR, Chura-Chambi RM, Gon?ales AP, et al. Refolding of the recombinant protein OmpA70 from Leptospira interrogans from inclusion bodies using high hydrostatic pressure and partial characterization of its immunological properties[J]. J Biotechnol, 2010, 148(2-3): 156–162. DOI:10.1016/j.jbiotec.2010.04.007 |
| [14] | Chura-Chambi RM, Nakajima E, de Carvalho RR, et al. Refolding of the recombinant protein Sm29, a step toward the production of the vaccine candidate against schistosomiasis[J]. J Biotechnol, 2013, 168(4): 511–519. DOI:10.1016/j.jbiotec.2013.09.017 |
| [15] | Tsumoto K, Umetsu M, Kumagai I, et al. Role of arginine in protein refolding, solubilization, and purification[J]. Biotechnol Prog, 2004, 20(5): 1301–1308. DOI:10.1021/bp0498793 |
| [16] | Lu D, Liu Z. Dynamic redox environment-intensified disulfide bond shuffling for protein refolding in vitro:molecular simulation and experimental validation[J]. J Phys Chem B, 2008, 112(47): 15127–15133. DOI:10.1021/jp804649g |
| [17] | Rao DE, Rao KV, Reddy VD. Cloning and expression of Bacillus phytase gene(phy)in Escherichia coli and recovery of active enzyme from the inclusion bodies[J]. J Appl Microbiol, 2008, 105(4): 1128–1137. DOI:10.1111/jam.2008.105.issue-4 |
| [18] | Wu X, Chavez JD, Schweppe DK, et al. In vivo protein interaction network analysis reveals porin-localized antibiotic inactivation in Acinetobacter baumannii strain AB5075[J]. Nat Commun, 2016, 7: 13414. DOI:10.1038/ncomms13414 |
| [19] | Huang W, Wang S, Yao Y, et al. OmpW is a potential target for eliciting protective immunity against Acinetobacter baumannii infections[J]. Vaccine, 2015, 33(36): 4479–4485. DOI:10.1016/j.vaccine.2015.07.031 |
| [20] | Badmasti F, Ajdary S, Bouzari S, et al. Immunological evaluation of OMV(PagL)+ Bap(1-487aa)and AbOmpA(8-346aa)+ Bap(1-487aa)as vaccine candidates against Acinetobacter baumannii sepsis infection[J]. Mol Immunol, 2015, 67(10): 552–558. |
| [21] | Huang W, Yao Y, Wang S, et al. Immunization with a 22-kDa outer membrane protein elicits protective immunity to multidrug-resistant Acinetobacter baumannii[J]. Sci Rep, 2016, 6: 20724. DOI:10.1038/srep20724 |




