虹鳟作为主要冷水性养殖鱼类,其不育的雌性三倍体个体较二倍体具有更多的生长优势,且能够避免生殖死亡而得到广泛应用。然而,虹鳟雌性三倍体不育的调控机制至今还不十分明确,使其规模化育种受到限制。近年来,围绕三倍体虹鳟性腺发育的组织学,细胞学开展了系列研究。实验表明,三倍体雌性虹鳟发育至受精后一段时间,卵泡败育并且重新分化,出现类生精样细胞,雌激素水平逐渐降低,雄激素水平逐渐升高,呈现了类雄性化的发育趋势[1]。究竟是何种细胞过程导致了这种颠覆性的变化,还不得而知。
自噬是指一些需降解的蛋白质和细胞器等胞浆成分被包裹成自噬小体,并最终运送至溶酶体降解的过程,为细胞再利用产生能量[2]。细胞在受到外界压力与刺激时,细胞自噬会起到保护作用,消化与代谢掉细胞废物从而维持在正常状态[3]。同时,自噬也是一把双刃剑,往往和细胞凋亡同时出现[4]。细胞凋亡和自噬被认为是细胞死亡机制的连续部分,自噬为凋亡所必需,自噬与凋亡共同促进细胞死亡[5]。细胞自噬过程在进化过程中是高度保守的,用于降解并消除细胞中多余以及受损的结构,例如线粒体等[6]。细胞自噬中最明显的形态结构是部分细胞质与细胞器被双层膜结构的囊泡包裹起来,形成自噬小体,然后自噬小体与溶酶体结合,溶酶体中的水解酶成分可以将自噬小体内的物质降解[7]。细胞自噬的调控机制非常复杂,在酵母中已经有30多种自噬相关基因atg(Autophagy-related genes,atg)被鉴定出来[8]。细胞自噬对哺乳动物的卵泡闭锁起到重要的作用,在调节卵泡细胞重塑的过程中起到重要作用[9]。LC3B蛋白为Atg8在高等动物中的对应蛋白[10]。在细胞发生自噬时,水溶性的LC3B-Ⅰ转变为脂溶性的LC3B-Ⅱ,并结合到自噬小体膜上直到与溶酶体结合[11]。因此,LC3B蛋白表达的水平高低在一定程度上可以反映细胞的自噬程度[12]。
在三倍体雌性虹鳟发育的过程中,性腺发生了重塑,为了验证细胞自噬在三倍体雌性虹鳟性腺败育过程中起到的作用,本研究拟通过透射电镜观察不同发育阶段性腺中自噬小体的形态,并检测不同发育阶段自噬基因lc3b的表达,来证明细胞自噬的发生。利用Western blot实验来检测LC3B-Ⅱ/ LC3B-Ⅰ的表达,阐述其主要的分子机制。
1 材料与方法 1.1 材料 1.1.1 实验动物与饲养本实验的三倍体雌性虹鳟卵均按照Espinosa[13]的方法得到。三倍体雌性虹鳟与二倍体雌性虹鳟饲养于黑龙江水产研究所(哈尔滨)。受精后的虹鳟鱼卵放置于10℃的孵育槽培养,直到受精后24 h移至0.3 m3水箱内,带有水循环系统,水温始终控制在(10+0.1)℃,光周期为12L:12D。受精54 d以后,鱼苗被转移到不同的水箱内,恒定温度为12℃,每天定时投喂虹鳟商业饲料。
1.1.2 实验试剂反转录试剂盒,PMD-18T载体,rTaq酶,限制性内切酶均购于TaKaRa公司,质粒小提试剂盒,荧光定量试剂盒,DNA marker与蛋白marker购自全是金公司,胶回收试剂盒购于Axygen公司,Western blot相关试剂配置于东北农业大学水产动物遗传育种实验室,透射电镜相关试剂配置于东北农业大学电镜中心。基因测序由北京华大公司完成。
1.2 方法 1.2.1 总RNA的提取与cDNA的合成用Trizol试剂提取不同发育阶段三倍体雌性虹鳟性腺中的总RNA,具体发育阶段为180 dpf、200 dpf、220 dpf、240 dpf、270 dpf、300 dpf和360 dpf。按照反转录试剂盒(PrimeScript RT Reagent Kit,TaKaRa)说明书将各发育阶段提取的总RNA反转为cDNA,存放于-20℃冰箱中。
1.2.2 虹鳟lc3b基因编码区的克隆根据NCBI中提供的大西洋鲑lc3b基因(GenBank登录号BT046065),利用Primer 5.0软件设计引物扩增虹鳟lc3b基因的编码区序列。引物序列为(5'-3'):F-CTGTAGACTCCGCAGCAGATAGC,R-GGAAGACAGGGGGATAGGTCTG。反转录PCR反应体系为50 μL:cDNA 1 μL,引物4 μL,rTaq 0.5 μL,10×PCR Buffer 5 μL,dNTPs 4 μL,dH2O 35.5 μL。PCR反应程序为:94℃ 5 min;94℃ 30 s,60℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min。PCR产物在1%的琼脂糖凝胶电泳中观察结果,将目的条带胶回收,连接PMD-18T克隆载体进行测序。
1.2.3 实时定量PCR Real-time PCR检测以上各发育阶段三倍体雌性虹鳟性腺中lc3b基因的表达量。反应体系为20 μL:上游引物0.4 μL,下游引物0.4 μL,SYBR Mix 10 μL,cDNA 1 μL,Dye Ⅱ 0.4 μL,dH2O 7.4 μL。ABI7500仪器设定反应程序为:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。检测lc3b基因表达的引物为(5'-3'):F-AAGGAGGACATTTGAGCAGAGAG,R-AGCTGCTTCTCTCCCTTGTATCTC。以β-acin基因作CGCGGTTACAG,R-TGCCCATCTCCTGCTCAAAG-TCCA。
1.2.4 透射电镜不同发育阶段的虹鳟性腺样本放置于固定液中(2.5%戊二醛和2.5%多聚甲醛),存放于4℃冰箱中过夜,然后用1%的四氧化锇溶液固定1 h。之后样本用氧化丙烯脱水并固定于树脂中,样本进行超薄切片,并放置于120 kV的H-7650透射电镜(Hitachi,Japan)下进行观察。
1.2.5 Western blot不同发育阶段的虹鳟性腺组织蛋白被提取出来,加入SDS-PAGE上样缓冲液,煮沸20 min。通过SDS-PAGE凝胶电泳将蛋白分离出来,并将蛋白转移至PVDF膜上,洗膜之后,用脱脂乳37℃条件下封闭2 h。利用LC3B抗体(Cell Signaling Technology,#2775)作为一抗进行孵育过夜,之后利用rabbit anti-IgG conjugated to horseradish peroxidase(中杉金桥)作为二抗进行孵育,2 h后洗膜,最后进行曝光得到特异条带14 kD和16 kD。
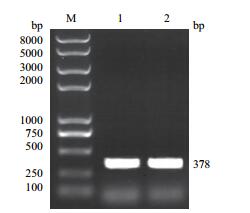
2 结果 2.1 虹鳟lc3b基因编码区的序列分析根据大西洋鲑lc3b基因的编码区序列设计引物,扩增得到虹鳟lc3b基因编码区的片段为378 bp(图 1),经序列测定后,与大西洋鲑的序列一致性达到93.07%。虹鳟lc3b基因编码126个氨基酸,其基因序列被提交到GenBank上,GenBank登录号为KX845472。
|
| 图 1 虹鳟lc3b基因编码区PCR扩增结果 M:DNA Marker;1,2:虹鳟lc3b基因编码区 |
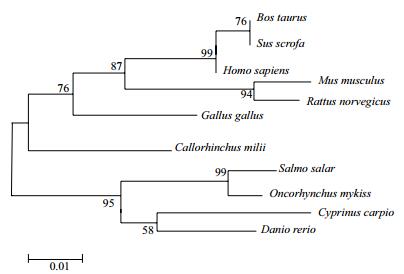
在NCBI上下载相关物种的lc3b基因序列,包括人(Homo sapiens)、猪(Sus scrofa)、牛(Bos Taurus)、小鼠(Mus musculus)、大鼠(Rattus norvegicus)、鸡(Gallus gallus)、叶吻银鲛(Callorhinchus milii)、鲤鱼(Cyprinus carpio)、斑马鱼(Danio rerio),以及大西洋鲑(Salmo salar)与虹鳟鱼的lc3b基因编码区序列进行比较。通过MEGA 6.06软件构建Neighbor-Joining进化树(图 2)。从进化树中可以看出,lc3b基因在进化过程中比较保守,虹鳟的lc3b基因与大西洋鲑落于同一分支中,属于鲑科,大西洋鲑属。
|
| 图 2 lc3b基因系统进化树分析 |
利用Swiss-model软件将虹鳟LC3B蛋白的氨基酸序列与其中搜索到人的Microtubule-associated proteins 1A/1B light chain 3B(PDB number:2zjd.2.A)蛋白模板进行比对(图 3),在这基础上预测虹鳟LC3B蛋白的三维结构(图 4)。二者蛋白的序列一致性达到了92.05%,结构相似性为56%。

|
| 图 3 虹鳟LC3B蛋白的三维结构预测图 |

|
| 图 4 虹鳟LC3B蛋白与Swiss-model模板蛋白氨基酸序列对比图 |
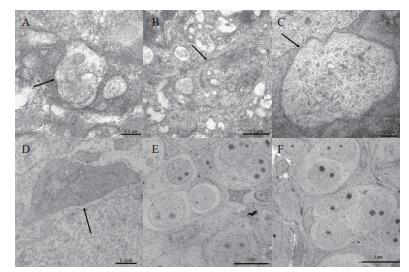
为了验证三倍体雌性虹鳟性腺发育过程中卵泡细胞发生自噬的情况,通过透射电镜对性腺进行了观察,在发育到200 dpf个体的性腺中可观察到自噬小体的结构,是由双层或多层膜构成的囊状结构,其中包含着完整或者正在消化中的细胞器,包括核糖体,高尔基体等。一直持续到270 dpf,在200 dpf-270 dpf这个发育阶段中均可观察到自噬小体的存在。在这个发育阶段的二倍体雌性虹鳟性腺中,透射电镜可观察到完整的卵母细胞结构,细胞膜比较完整,有比较清晰的细胞核结构,并没有类似自噬小体的结构出现(图 5)。通过比较,可以发现三倍体雌性虹鳟的性腺发育过程中出现异常,卵泡细胞中有自噬体结构出现。
|
| 图 5 透射电镜观察二、三倍体雌性虹鳟不同发育阶段性腺的亚显微结构 A:200 dpf三倍体雌性性腺;B:220 dpf三倍体雌性性腺;C:240 dpf三倍体雌性性腺;D:270 dpf三倍体雌性性腺;E:200 dpf二倍体雌性性腺;F:240 dpf二倍体雌性性腺;箭头所指为自噬小体结构 |
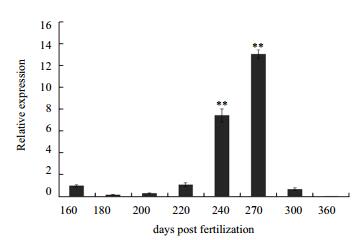
针对三倍体雌性虹鳟性腺发育过程中出现自噬小体的情况,检测lc3b基因在发育各阶段的性腺中的表达。在160 dpf-200 dpf这个发育阶段,虹鳟雌性三倍体性腺中lc3b mRNA水平的表达量相对较低,但在220 dpf-270 dpf这个阶段,该基因的表达出现了显著的升高,较发育初期的表达有显著的差异(P < 0.05)。在之后的发育阶段,直到360 dpf,基因表达又恢复了到了发育初期水平(图 6)。这与透射电镜观察到自噬小体存在的阶段基本一致。
|
| 图 6 lc3b基因在三倍体雌性虹鳟各发育阶段性腺组织中的表达 **表示显著性差异(P < 0.05) |
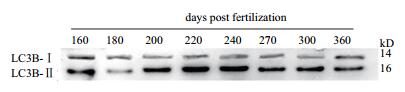
为了更深入的验证三倍体雌性虹鳟性腺发育过程中自噬现象,验证LC3B的蛋白表达水平。LC3B蛋白有两种形式,LC3B-Ⅰ和LC3B-Ⅱ。细胞中没有自噬发生时,该蛋白以LC3B-Ⅰ的形式存在与细胞质中,而细胞自噬发生时,该蛋白以LC3B-Ⅱ的形式存在与自噬小体膜上,因此LC3B-Ⅱ/ LC3B-Ⅰ的比例往往可以代表自噬水平的高低。通过检测不同发育阶段三倍体雌性虹鳟性腺中蛋白的表达,表明LC3B-Ⅱ / LC3B-Ⅰ的表达比在200 dpf-270 dpf这个发育阶段始终处于较高的水平(图 7),即这一阶段细胞自噬也处于较高的水平。
|
| 图 7 LC3B蛋白在三倍体雌性虹鳟各发育阶段的表达 |
在本研究中,细胞自噬与三倍体雌性虹鳟性腺发育异常被联系了起来。首先,克隆了虹鳟自噬基因lc3b 的编码区序列。通过透射电镜观察三倍体雌性不同发育阶段性腺的亚显微结构,确定了自噬小体的存在。检测不同发育阶段自噬基因lc3b的表达,基因的表达结果与自噬小体出现的时期基本吻合。对于检测三倍体雌性虹鳟不同发育阶段性腺中自噬蛋白的表达,实验结果表明,在200 dpf-270 dpf阶段,性腺细胞自噬水平比较强烈。以前的研究表明,在这一阶段之后,性腺组织发生纤维化,导致发育异常。因此,性腺细胞自噬是导致三倍体雌性虹鳟性腺发育异常的主要原因之一。
自噬是广泛存在于真核细胞中的生命现象,贯穿于正常细胞生长发育和生理病理过程,目前已在高等哺乳动物和植物细胞的研究中取得较大的进展,特别是在酵母细胞自噬的研究中更是不断深入[14]。但是目前对鱼类细胞自噬的研究才刚刚开始,对其在控制鱼类细胞分化、生长发育和防治病原感染等方面的研究还不多。多倍体鱼类由于其具有较多的生长优势与经济价值,因此对其生长发育的机制研究有一定的遗传学意义。在哺乳动物的卵泡发育和闭锁过程中,细胞自噬起到重要的作用。在硬骨鱼类的研究,排卵之后的卵巢组织发生了重塑,是卵泡细胞的自噬与凋亡一起协同作用的结果[15, 16]。在我们之前的研究中[1, 17],发现三倍体雌性虹鳟的性腺发生败育,雌性化特征减弱,性腺发生了重塑,因此这里我们将卵泡细胞的自噬与其性腺败育联系在一起进行研究。
通过透射电镜对三倍体雌性虹鳟性腺的亚显微结构观察,我们发现了自噬小体结构。具有多层膜包围,内部具有完整的或者正在消化中的细胞器,这与鱼类闭锁的以及排卵后的卵巢中观察到的自噬体结构相似[18]。自噬调节信号通路复杂,在酵母菌中的研究较为透彻,自噬活动又是十分保守的细胞活动,在不同物种中的调节机制较为相似[19]。我们克隆了虹鳟的自噬基因lc3b的编码区片段为378 bp,并通过进化树分析虹鳟lc3b基因序列与大西洋鲑的序列高度保守,并落在同一分支内。对于虹鳟LC3B蛋白三维结构的预测,与已知的人Microtubule-associated proteins 1A/1B light chain 3B(PDB number:2zjd)的蛋白结构具有很高的相似性。通过对三倍体雌性虹鳟不同发育阶段性腺中lc3b基因表达进行分析,表明该基因在200 dpf-270 dpf阶段始终处于较高的表达水平。
然而在细胞自噬的研究中,LC3B的蛋白水平高低是证明细胞自噬水平高低的有效手段。LC3B蛋白有两种形式,LC3B-Ⅰ和LC3B-Ⅱ。细胞中没有自噬发生时,该蛋白以LC3B-Ⅰ的形式存在与细胞质中,而细胞自噬发生时,该蛋白以LC3B-Ⅱ的形式存在与自噬小体膜上,因此LC3B-Ⅱ / LC3B-Ⅰ的比例往往可以代表自噬水平的高低[20]。通过Western blot实验我们证明了在200 dpf-270 dpf发育阶段,三倍体雌性虹鳟性腺中LC3B-Ⅱ / LC3B-Ⅰ的表达水平很高,证明性腺细胞在这过程中发生了强烈的自噬,性腺发育异常,导致性腺败育。
因此我们推测卵泡细胞的自噬,是导致三倍体雌性虹鳟性腺重新分化的主要原因,是导致三倍体雌性虹鳟不育的重要机制。
4 结论本研究克隆了虹鳟lc3b基因的编码区序列。通过透射电镜观察与分析lc3b基因及LC3B蛋白在三倍体雌性虹鳟性腺不同发育阶段的表达水平,证明了性腺细胞自噬为三倍体雌性虹鳟性腺败育是主要原因之一。
| [1] | Xu G, Huang T, Jin X, et al. Morphology, sex steroid level andgene expression analysis in gonadal sex reversal of triploid female(XXX)rainbow trout(Oncorhynchus mykiss)[J]. Fish Physiol Biochem, 2016, 42(1): 193–202. DOI:10.1007/s10695-015-0129-7 |
| [2] | Fader CM, Colombo MI. Autophagy and multivesicular bodies:two closely related partners[J]. Cell Death Differ, 2009, 16(1): 70–78. DOI:10.1038/cdd.2008.168 |
| [3] | Degterev A, Yuan J. Expansion and evolution of cell death programmes[J]. Nat Rev Mol Cell Biol, 2008, 9(5): 378–390. DOI:10.1038/nrm2393 |
| [4] | Maiuri MC, Zalckvar E, Kimchi A, et al. Self-eating and self-killing:crosstalk between autophagy and apoptosis[J]. Nat Rev Mol Cell Biol, 2007, 8(9): 741–752. DOI:10.1038/nrm2239 |
| [5] | Mizushima N, Levine B, Cuervo A, et al. Autophagy fights disease through cellular self-digestion[J]. Nature, 2008, 451(7182): 1069–1075. DOI:10.1038/nature06639 |
| [6] | Klionsky DJ. Autophagy revisited:a conversation with Christian de Duve[J]. Autophagy, 2008, 4(6): 740–743. DOI:10.4161/auto.6398 |
| [7] | Tanida I. Autophagy basics[J]. Microbiology and Immunology, 2011, 55(1): 1–11. DOI:10.1111/mim.2011.55.issue-1 |
| [8] | Klionsky DJ, Cregg JM, Dunn WA, et al. A unified nomenclature for yeast autophagy-related genes[J]. Dev Cell, 2003, 5(4): 539–545. DOI:10.1016/S1534-5807(03)00296-X |
| [9] | Morais RDVS, Thome RG, Lemos FS, et al. Relationship between bcl-2, bax, beclin-1, and cathepsin-D proteins during postovulatory follicular regression in fish ovary[J]. Theriogenology, 2016, 85(6): 1118–1131. DOI:10.1016/j.theriogenology.2015.11.024 |
| [10] | Kabeya Y, Mizushima N, Ueno T, et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J]. EMBO J, 2000, 19(21): 5720–5728. DOI:10.1093/emboj/19.21.5720 |
| [11] | Ryter SW, Mizumura K, Choi AM. The impact of autophagy on cell death modalities[J]. Int J Cell Biol, 2014, 2014: 502676. |
| [12] | Mizushima N, Yoshimori T. HowtointerpretLC 3 immunoblotting[J]. Autophagy, 2007, 3(6): 542–545. DOI:10.4161/auto.4600 |
| [13] | Espinosa E, Josa A, Gil L, et al. Triploidy in rainbow trout determi-ned by computer-assisted analysis[J]. J Exp Zool A Comp Exp Biol, 2005, 303(11): 1007–1012. |
| [14] | Klionsky DJ. Autophagy:from phenomenology to molecular understanding in less than a decade[J]. Nature Reviews Molecular Cell Biology, 2007, 8(11): 931–937. DOI:10.1038/nrm2245 |
| [15] | Depiereux S, Liagre M, Danis L, et al. Intersex occurrence in rainbow trout(Oncorhynchus mykiss)male fry chronically exposed to ethynylestradiol[J]. PLoS One, 2014, 9(7): e98531. DOI:10.1371/journal.pone.0098531 |
| [16] | Melo RMC, Martins YS, Luz RK, et al. PCNA and apoptosis during post-spawning ovarian remodeling in the teleost Oreochromis niloticus[J]. Tissue & Cell, 2015, 47(6): 541–549. |
| [17] | Han Y, Liu M, Zhang LL, et al. Comparison of reproductive development in triploid and diploid female rainbow trout Oncorhynchus mykiss[J]. J Fish Biol, 2010, 76(7): 1742–1750. DOI:10.1111/jfb.2010.76.issue-7 |
| [18] | Thome RG, Santos HB, Arantes FP, et al. Dual roles for autophagy during follicular atresia in fish ovary[J]. Autophagy, 2009, 5(1): 117–119. DOI:10.4161/auto.5.1.7302 |
| [19] | Sandri M. Basicsofautophagyinmuscle-Cellularmechanisms[J]. Neuromuscular Disorders, 2014, 24(9-10): 791. |
| [20] | Zhang Z, Singh R, Aschner M. Methods for the detection of autophagy in mammalian cells[J]. Curr Protoc Toxicol, 2016, 69: 20121–201226. |




