2. 广东省水产经济动物病原生物学及流行病学重点实验室,湛江 524088
2. Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals, Zhanjiang 524088
在高等脊椎动物,根据表面标志分子CD4和CD8分子表达不同,将成熟T淋巴细胞分为CD4+或CD8+T淋巴细胞两个亚群,其中CD8+T淋巴细胞主要为细胞毒性T淋巴细胞(Cytotoxic T lymphocytes,CTL),是机体参与抗病毒、抗胞内微生物感染、抗肿瘤及抗移植排斥反应的主要效应细胞[1]。CD8分子是一种以αα同源二聚体或αβ异源二聚体形式存在的膜结合糖蛋白[2]。在哺乳动物中,αβ异源二聚体主要表达于成熟T淋巴细胞和胸腺细胞[2],而αα同源二聚体仅表达于自然杀伤(Naturalkiller,NK)细胞[3]、γδT细胞[4]和肠上皮内淋巴细胞[5]。通过mRNA的不同剪接机制,在血清中尚存在着可溶型CD8α或CD8β链(sCD8)[7],但其功能尚不清楚。CD8α和CD8β链均属于免疫球蛋白超家族成员,由信号肽、胞外免疫球蛋白超家族(Immunoglobulin superfamily,IgSF)可变区、近膜端铰链区、跨膜区和胞浆区组成[7]。
CD8分子在TCR介导的抗原肽-MHCI识别过程中与MHC I和β2-微球蛋白(β2m)相互作用而发挥共受体的功能。晶体结构研究表明CD8α通过A/B β折叠和胞外免疫球蛋白超家族可变区内的互补决定区与β2微球蛋白及MHC I分子的α2、α3结构域进行结合,有助于稳定TCR与抗原肽-MHCI复合物的相互作用[1]。此外,CD8α链胞浆区存在一个保守的CXC基序,该基序结合并激活淋巴细胞特异性酪氨酸蛋白激酶p56lck[8],继而磷酸化CD3多肽链中的ITAM基序,从而诱导细胞毒性T淋巴细胞的快速活化[9]。CD8β链不含有CXC基序,但在T细胞的分化和成熟过程中同样发挥重要作用[10]。亦有研究表明其参与细胞膜表面脂筏的形成[11]。
近年来,陆续开展了有关鱼类的T细胞免疫的相关研究。2000年,Hansen等[12]在虹鳟(Oncorhynchus mykiss)中报道了第一个鱼类CD8分子,随后多种鱼类如大西洋鲑(Salmo salar)[13]、鲫鱼(Carassius auratus langsdorfii)[14]、舌齿鲈(Dicentrarchus labrax L.)[15]、大西洋庸蝶(Hippoglossus hippoglossus)[16]、斜带石斑鱼(Epinephelus coioides)[17]和鳜鱼(Siniperca chuatsi)[18]的CD8分子先后得到克隆鉴定。研究也发现了鱼类白细胞具有与哺乳动物CTL细胞相似的细胞毒功能[19],如同种异体移植排斥反应和杀伤病毒感染的细胞。但与哺乳动物相比,鱼类的T细胞免疫研究仍然处于初始阶段,对于鱼类CD8+T细胞的功能和其介导的信号转导机制及其他T细胞标记物的联系仍有待阐明。
红笛鲷(Lutianus sanguineus)是我国南方重要的海水养殖鱼种,然而近年来集约化养殖规模的不断扩大和养殖环境日益恶化,受到病原侵袭导致病害频繁爆发,对其养殖业造成了巨大的经济损失。目前对鱼病尚缺乏有效的防治手段,阐明鱼类的免疫防御机制对于鱼病防治具有重要的指导意义。然而,到目前为止尚未有红笛鲷T细胞表面标志基因的报道。本研究克隆红笛鲷CD8基因的cDNA全长,应用实时荧光定量PCR(Real-time quantitative PCR,qRT-PCR)分析CD8基因在健康红笛鲷组织中的表达和哈维氏弧菌疫苗诱导后在红笛鲷免疫相关组织中的表达变化,旨在为进一步研究红笛鲷T细胞介导的免疫奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验鱼及菌株实验用红笛鲷(体质量80-100 g)购自湛江某海水养殖网箱,经检测无病虫害,健康活力好,于水温25-28℃的水泥池中进行养殖,24 h连续充氧,每天早晚投喂商品饲料各1次,日换水量1/3,试验前暂养1周。哈维氏弧菌(Vibrio harveyi)强毒株分离自患病红笛鲷并保存于本实验室。
1.1.2 组织样品采集将哈维氏弧菌强毒株接种于TSB(2% NaCl)培养基中,28℃振荡培养16 h,用平板计数法计数菌液浓度后,加入终浓度为0.3%的福尔马林,28℃灭活48 h。经检验灭活完全后,6 000 r/min离心20 min去培养基后用无菌PBS(0.01 mol/L,pH 7.4)将菌苗浓度调整为1×109CFU/mL,置2-8℃保存待用。将试验鱼分成2组,刺激组每尾鱼腹腔注射0.2 mL疫苗,对照组注射等量无菌PBS。于刺激后的4、8、12、24、48和72 h分别采集鳃、头肾、脾脏和肠组织,每个时间点采集5尾红笛鲷,投入RNAlater后于-80℃保存备用,收集的组织主要用于荧光定量PCR分析。另取5尾健康红笛鲷,分别取鳃、胸腺、头肾、肝、脾、肠、中肾、心脏、脑、皮肤和肌肉组织立即投入RNAlater后于-80℃保存备用,收集的组织主要用于CD8 cDNA克隆和组织分布分析。
1.1.3 头肾淋巴细胞样品采集头肾淋巴细胞分离参考Xu[17]和Guo[18]的方法稍加改动。分别取5尾健康红笛鲷用MS-222麻醉后,75%酒精短暂浸泡消毒,无菌条件下取出头肾,迅速置于RPMI1640(含100 U青霉素、100 μg/mL链霉素和0.5%胎牛血清),用无菌剪刀将其剪成小块后置于100目的无菌细胞筛网上,用无菌注射器头轻轻研磨头肾组织,用RPMI1640冲洗筛网,制备成头肾细胞悬液备用。吸取2 mL头肾细胞悬液沿管壁小心缓慢地加到34%和51%不连续密度梯度Percoll分离液界面上。于4℃ 400 r/min离心30 min,小心吸取两层Percoll细胞分离液中间层白细胞,用RPMI1640洗涤2次,将细胞悬液浓度调整为5.0×105,以每孔接种1 mL接种到24孔板中,25℃培养4 h后去除单核细胞和巨噬细胞等粘附细胞,收集细胞悬液,重新接种到新的24孔板中。试验组每孔分别加入终浓度为10 μg/mL的LPS、10 μg/mL ConA和50 μg/mL PolyI﹕C,对照组加入PBS,每种处理组设3个重复,分别于4、8、12和24 h取样。将样品于4℃ 500 r/min条件下离心10 min去除培养基,加入500 μL TRIzol于-80℃保存备用。
1.2 方法 1.2.1 总RNA提取和cDNA合成按Trizol(全式金)说明书分别提取红笛鲷各组织和细胞总RNA,1%琼脂糖凝胶电泳检测RNA完整性,紫外分光光度法检测其纯度和浓度,确保其OD260/OD280在1.8-2.0。各组织的总RNA按照PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa)说明书合成cDNA第一链,置-20℃保存待用。另取头肾的总RNA,按SMARTerTM RACE cDNA Amplification Kit(TaKaRa)说明书分别合成用于3'与5'RACE的cDNA,置-20℃保存待用。
1.2.2 引物设计与基因部分序列扩增根据GenBank上已有的硬骨鱼类CD8α和CD8β核酸的保守区域设计简并引物F与R(表 1),运用降落PCR从红笛鲷头肾cDNA第一链中扩增红笛鲷CD8α和CD8β基因的部分序列。PCR反应条件如下:95℃预变性3 min,94℃ 30 s,62℃ 30 s,72℃30 s 5个循环;94℃ 30 s,58℃ 30 s,72℃30 s 5个循环;94℃ 30 s,54℃ 30 s,72℃ 30 s 30个循环,72℃延伸6 min。PCR反应产物经1%琼脂糖凝胶电泳切下目的条带,使用GeneJET Kit(Thermo fisher scientific)进行回收,与pMD-19T Vector连接后转化DH5α感受态,筛选阳性克隆送至深圳华大基因股份有限公司进行测序。
根据获得的CD8α和CD8β基因部分序列设计特异性巢式引物用于3'RACE和5'RACE(表 1)。将3'CD8αF1、3' CD8βF1和5'CD8αR1、5'CD8βR1分别与UPM Mix引物进行3' RACE与5'RACE第一轮降落PCR。反应条件为:95℃预变性3 min,94℃ 30 s,70℃ 2 min 5个循环;94℃ 30 s,68℃ 30 s,72℃ 2 min 5个循环;94℃ 30 s,65℃ 30 s,72℃ 2 min 20个循环,72℃延伸6 min,4℃保存。将第一轮PCR产物稀释20倍作为模板,将3'CD8αF2、3'CD8βF2和5'CD8αR2、5'CD8βR2分别与NUP进行第二轮降落PCR,反应条件为:95℃预变性3 min,94℃ 30 s,65℃30 s,72℃ 2 min 35个循环,72℃延伸6 min。PCR产物回收和测序步骤同1.2.2。
1.2.4 生物学信息分析使用在线Blast程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列同源性比对和相似性分析;使用Genetyx 6.0和protparam(http://web.expasy.org/protparam/)预测开放阅读框(Open Reading Frame,ORF)、分子量(Mw)和理论等电点(pI)等;在线软件SignalP 3.0 Server(http://www.cbs.dtu.dk/services/SignalP)和TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM)分别预测信号肽和跨膜结构域;在线程序NetGlyc1.0(http://www.cbs.dtu.dk/services/NetNGlyc)和NetOGlyc(http://www.cbs.dtu.dk/services/NetOGlyc/)预测N-糖基化和O-糖基化位点;运用SMART(http://smart.embl-heidelberg.de/)分析蛋白质功能结构域;使用ClustalX 2.0及MEGA 6.0软件以邻位相连法(Neighbor-joining)构建系统进化树,自检数为1 000。物种CD8分子序列号,见表 2。
将cDNA第一链稀释5倍后用作qRT-PCR的模板,根据CD8α和CD8β基因ORF设计引物reCD8αF、reCD8αR和reCD8βF、reCD8βR(表 1),以β-actin为内参基因,利用ABI7300实时荧光定量PCR仪对红笛鲷CD8α和CD8β基因的表达量进行分析,每个样本设3个重复。PCR反应条件为:94℃预变性3 min,94℃变性20 s,60℃退火20 s,60℃延伸20 s,40个循环。采用2ˉΔΔCt法计算红笛鲷CD8α和CD8β基因的相对表达量,应用SPSS 11.0软件对数据进行进行ANOVA单因素方差分析和Tukey HSD多重比较。
2 结果 2.1 序列特征分析红笛鲷CD8αcDNA全长为1 576 bp(GenBank登录号:KF285563),包含94 bp 5'非翻译区(Untranslated Region,UTR)、804 bp 3' UTR和678 bp ORF。其ORF推导编码225个氨基酸,预测的分子量和等电点分别为24.90 kD和9.44,无N-糖基化位点。红笛鲷CD8βcDNA全长为1 486 bp(GenBank登录号:KF285564),包含74 bp 5' UTR、779 bp 3' UTR和633 bp ORF。其ORF推导编码210个氨基酸,预测的分子量和等电点分别为23.58 kD和9.81,含有1个N-糖基化位点。SignalP 4.1 Server和TMHMM Server V. 2.0预测显示CD8α和CD8β氨基酸序列均属于I型跨膜蛋白分子,由信号肽、免疫球蛋白超家族(Immunoglobulin superfamily,IgSF)可变区、胞外区、跨膜区和胞浆区5个结构域组成。
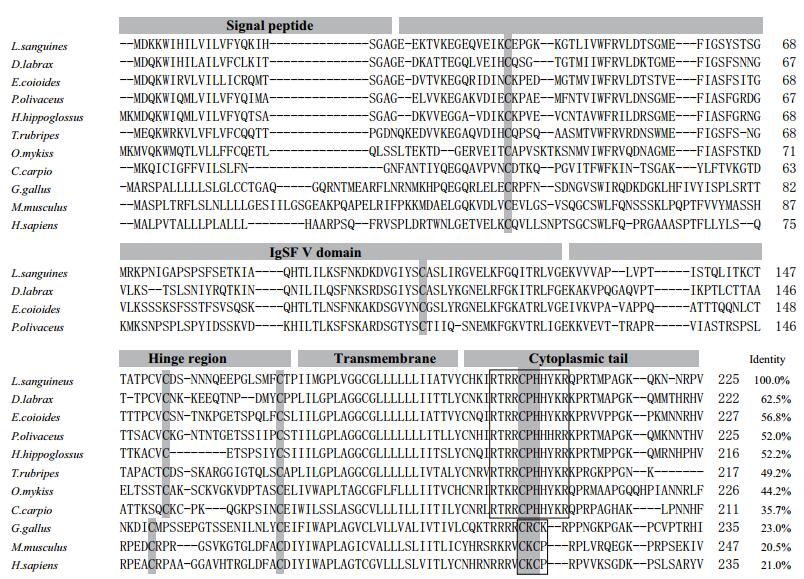
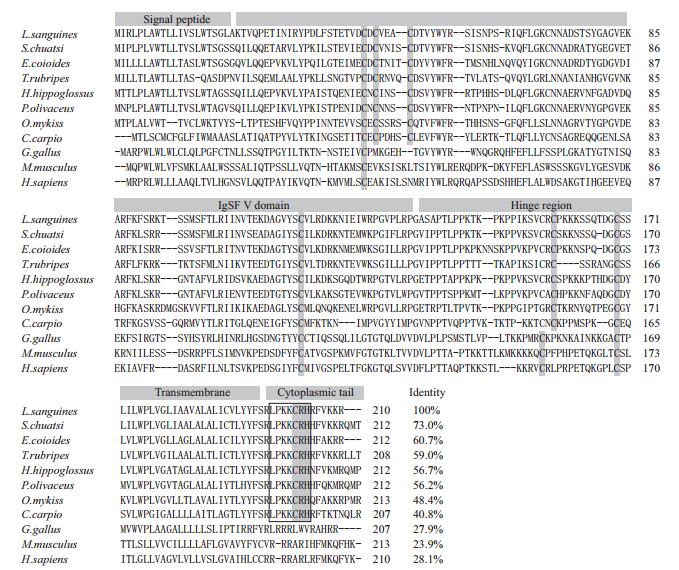
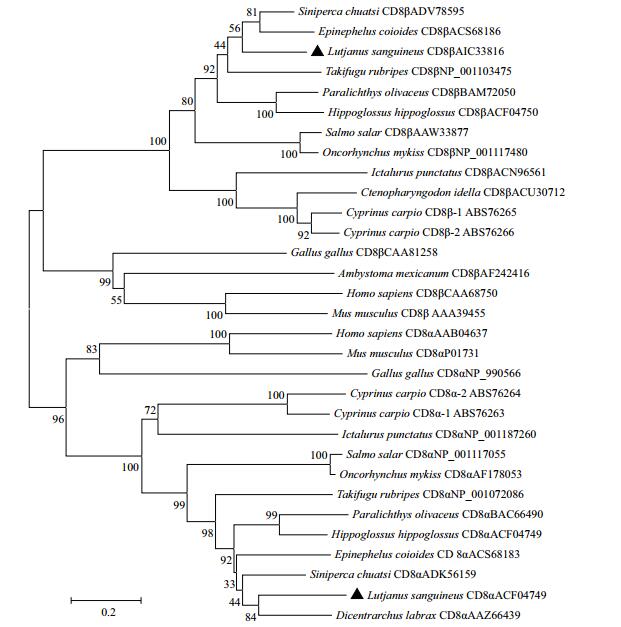
2.2 氨基酸序列比较及系统发育分析将红笛鲷CD8α和GenBank已登录的其他动物的CD8α进行氨基酸序列同源性比对,结果见图 1和图 2。其中红笛鲷CD8α和舌齿鲈的CD8α同源性最高,达62.5%,与哺乳动物和鸟类的同源性较低,为20.5%-23.0 %。红笛鲷CD8β和鳜鱼的CD8β同源性最高,达73.0%,与哺乳动物和鸟类的同源性较低,为23.9%-28.1%。氨基酸序列多重比对发现,包括红笛鲷在内的鱼类CD8α和CD8β的IgSF可变区和铰链区分别含有一对保守的Cys残基,而且铰链区富含Thr、Ser和Pro残基,形成多个O-糖基化位点。此外,CD8α和CD8β的胞浆区均无p56lck的结合位点CXC基序,但分别含有鱼类中高度保守的RTRRCPHHYKR和LPKKCRH基序(图 1,图 2)。利用MEGA 6.0的Neighbor-Joining法构建CD8氨基酸序列系统进化树,结果(图 3)显示,CD8α和CD8β分别形成两个独立的进化分支,在CD8α分支上,红笛鲷与硬骨鱼鲈形目的舌齿鲈聚在一起,表明它们亲缘关系最近。在CD8β分支上,红笛鲷与鳜鱼和斜带石斑鱼聚在一起,表明它们亲缘关系最近。在两个分支上红笛鲷均与鸟类和哺乳类遗传距离较远,这与blastp的结果一致。
|
| 图 1 红笛鲷CD8α与其他脊椎动物CD8α氨基酸序列比较 “-”:间隔氨基酸;灰色背景突出显示保守氨基酸;方框:功能基序 |
|
| 图 2 红笛鲷CD8β与其他脊椎动物CD8β氨基酸序列比较 “-”:间隔氨基酸;灰色背景突出显示保守氨基酸;方框:功能基序 |
|
| 图 3 基于NJ法构建的CD8α和CD8β氨基酸序列系统进化树 |
应用qRT-PCR技术检测CD8α和CD8β在健康红笛鲷不同组织中的相对表达水平,分析结果(图 4)显示,CD8α和CD8β在各组织均有不同程度的表达,其中CD8α和CD8β均在胸腺的表达量最高,CD8α在中肾、鳃、肠、皮肤、脾和头肾组织中表达量次之,CD8β则在中肾、鳃、肠、皮肤、肌肉和心组织中表达量次之;其他组织表达量较低。
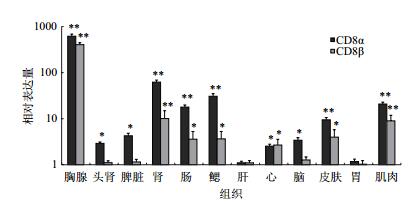
|
| 图 4 CD8α和CD8β在红笛鲷各组织的相对表达 *表示与肝组织表达量相比差异显著(P < 0.05),**表示与肝组织表达量相比差异极显著(P < 0.01) |
应用qRT-PCR检测了红笛鲷头肾淋巴细胞体外经LPS、ConA和PolyI:C刺激后CD8α和CD8β的表达变化。结果(图 5,图 6)显示,在试验期内,LPS处理组的表达量与对照组无明显上升(P>0.05)。ConA和PolyI﹕C处理组的CD8α和CD8β的表达量于刺激后4 h显著升高(P < 0.05),并于8 h达到最高(P < 0.01),然后开始快速下降,于24 h内回归到基础表达水平。
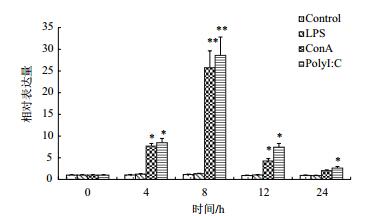
|
| 图 5 头肾淋巴细胞体外经LPS、ConA和PolyI:C刺激后CD8α mRNA的表达变化 *表示试验组与对照组表达量相比差异显著(P < 0.05),**表示试验组与对照组表达量相比差异极显著(P < 0.01)。下同 |
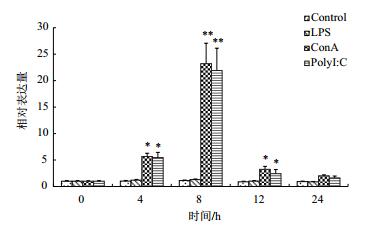
|
| 图 6 头肾淋巴细胞体外经LPS、ConA和PolyI:C刺激后CD8β mRNA的表达变化 |
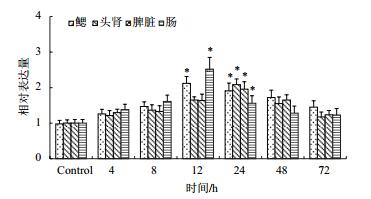
应用qRT-PCR检测了哈维氏弧菌疫苗刺激红笛鲷4、8、12、24、48和72 h后CD8α和CD8β的mRNA在红笛鲷鳃、头肾、脾脏和肠的表达变化。结果(图 7,图 8)显示,在哈氏弧菌疫苗刺激4 h后,CD8α和CD8β mRNA表达量开始轻微上调表达,在鳃和肠中于12 h达到最高(P < 0.05),在头肾和脾脏中的表达量于24 h达到最高,显著高于对照组(P < 0.05),然后开始缓慢下降,72 h后回落到基础表达水平。
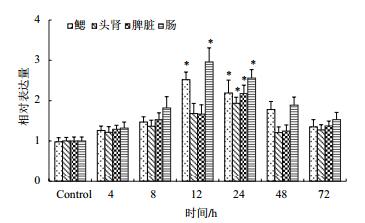
|
| 图 7 哈维氏弧菌免疫后CD8α mRNA在鳃、头肾、脾和肠组织中的表达水平 |
|
| 图 8 哈维氏弧菌免疫后CD8β mRNA在鳃、头肾、脾和肠组织中的表达水平 |
作为MHC I类限制性T细胞识别抗原的辅助受体,CD8分子在T细胞增殖和分化的信号转导中起重要作用。本研究获得了红笛鲷CD8α和CD8β基因的cDNA全序列,分别编码225和210个氨基酸,与已发现的其他鱼类和哺乳动物的CD8结构相类似,均由信号肽、IgSF可变区、铰链区、跨膜区和胞浆区组成。尽管与哺乳动物的同源性较低,但仍具有一些高度保守的氨基酸残基、糖基化位点和功能基序,对CD8分子的正确折叠和执行功能起关键作用[20]。
氨基酸序列多重比较显示,红笛鲷CD8α和CD8β的IgSF可变区均包含一对保守的半胱氨酸,用以形成结构域内二硫键[21]。铰链区同样存在一对保守的半胱氨酸残基,参与同源二聚体(在一对保守的半胱氨酸残基形成结构域内二硫键度[22],预示鱼类CD8分子与哺乳动物的CD8同样可二聚化形成二聚体。值得注意的是,大部分硬骨鱼CD8α的跨膜区及CD8βDIgSF可变区均含有额外两个保守的半胱氨酸残基,然而,对于它们的功能尚未清楚,有待进一步研究加以阐明。此外,红笛鲷CD8铰链区富含Thr、Ser和Pro,而且含有多个潜在的O-糖基化位点,有助于其保持伸展状态从而提高与TCR和MHC I的α3结构域结合能力[21],增强其辅助受体功能[23]。
跨膜区和胞浆区在所有物种中均相对保守,其中含有较多带正电荷的氨基酸残基和一些保守基序[15]。高等哺乳动物和鸟类的CD8分子胞浆区含有CXC基序,该基序通过形成锌扣结构结合络氨酸蛋白激酶p56lck[24],参与T细胞活化增殖信号的转导,但包括红笛鲷在内的硬骨鱼中均未发现,代之为CXH基序。Moore等[13]推测Cys和His同样可通过形成相似的锌扣结构将p56lck激酶连接到胞浆区尾部,但Turner等[8]也发现用Ala残基替换第二个Cys残基后会降低p56lck激酶与CXC基序的亲和力。尽管目前的研究表明表明鱼类CD8+T细胞可发挥细胞毒功能[19, 25],但是鱼类中p56lck激酶与鱼类CD8分子胞浆区中的保守基序的结合方式和结合能力仍未清楚,有待进一步研究。
本研究发现除了CD8β在头肾和脾脏组织中表达量较低外,CD8α和CD8β mRNA在其余组织中的表达模式较相似,二者的表达量均在胸腺中最高,是其他组织表达量的10-800倍,与其在大西洋鲑[13]、舌齿鲈[15]、大西洋庸鲽[16]和鳜鱼[17]等鱼类的研究结果相似。胸腺是鱼类中枢免疫器官,CD8在胸腺中的高表达再次表明胸腺是T淋巴细胞产生、成熟和分化的场所。脾脏和头肾是鱼类重要的外周免疫器官,中肾是鱼类的排泄器官,其中的造血组织间同样含有T淋巴细胞[26],研究发现T淋巴细胞散在分布于其中参与系统免疫应答[27]。此外,发现CD8在红笛鲷皮肤、肠和鳃中等也具有较高的的表达量,与在大西洋鲑[13]和金银鲫[14]、舌齿鲈[15]的发现相一致,可能是由于在黏膜相关淋巴组织内存在一定数量的CD8阳性细胞[28],表明CD8分子在局部黏膜免疫应答中发挥重要作用。
LPS是一种经典的促B细胞活化的有丝分裂原,头肾淋巴细胞体外经LPS刺激后CD8在各时段的表达量没有改变,与小鼠T淋巴细胞的研究结果相同[29],表明其不能诱导CD8+T细胞增殖。经ConA和PolyI:C刺激后CD8均显著上调表达,其表达模式与鳜鱼的CD8分子的表达模式相似[18]。而PolyI:C是一种双链RNA病毒类似物,可激活细胞毒性T细胞和NK细胞。ConA通过有丝分裂原受体与T淋巴细胞结合刺激其增殖,研究表明河豚的CD8阳性细胞在ConA和PHA刺激下显著增殖[30],此外还可刺激人外周血单核细胞中CD8持续上调表达[31]。因此,推测鱼类的CD8阳性细胞具有哺乳类CD8阳性细胞部分相似的特性。
本实验中哈维氏弧菌疫苗免疫12 h后CD8α和CD8β在头肾、脾脏、鳃和肠中均有一定程度的上调表达,与耶尔森氏菌疫苗免疫虹鳟后的研究结果相似[32]。在牙鲆感染爱德华氏菌(Edwardsiella tarda)和病毒性出血性败血症病毒(Viral hemorrhagic septicemia virus,VHSV)后也出现CD8出现表达水平显著升高的现象[33]。CD8是细胞毒性T淋巴细胞的标记分子,病原感染后表达量升高表明引起CD8阳性细胞活化增殖参与细胞免疫应答,但它们在免疫反应过程中的作用和调节机制仍有待进一步研究。此外,本研究中红笛鲷的CD8α和CD8β mRNA在健康状态及感染后组织表达模式非常相似,预示组织中的CD8αβ可能以异二聚体形式存在相同的细胞中表达,Kato等[33]发现牙鲆CD8α和CD8βmRNA存在于脾和头肾中的相同细胞簇中,Takizawa等[34]使用单克隆抗体鉴定虹鳟CD8α+细胞同时表达CD8β mRNA,该两项研究提供了CD8αβ异二聚体阳性细胞存在的间接证据。本研究克隆了CD8α和CD8β基因,为进一步制备单克隆抗体、分选CD8+T细胞以及细胞毒性T淋巴介导的的免疫应答研究奠定了基础。
4 结论本研究克隆获得了红笛鲷CD8α和CD8β基因,均由信号肽、免疫球蛋白超家族可变区、铰链区、跨膜区和胞浆区组成,健康红笛鲷CD8α和CD8β基因在胸腺中表达量最高,其次为中肾、鳃、皮肤、脾、头肾和肠。红笛鲷头肾淋巴细胞CD8α和CD8β体外经LPS、ConA和PolyI﹕C刺激后表达量上调。哈维氏弧菌疫苗免疫24 h后鳃、头肾、脾脏、和肠的CD8α和CD8β表达量上升。
| [1] | 龚非力. 医学免疫学[M]. 第3版. 北京: 科学出版社, 2009: 63-79. |
| [2] | Janeway CA Jr, Medzhitov R. Innate immune recognition[J]. Annual Review of Immunolgy, 2002, 20(1): 197–216. DOI:10.1146/annurev.immunol.20.083001.084359 |
| [3] | Detotero D, Tazzari PL, DiSanto JP, et al. Heterogeneous immunophenotype of granular lymphocyte expansions:differential expression of the CD8α and CD8β chains[J]. Blood, 1992, 80(7): 1765–1773. |
| [4] | Poussier P, Julius M. Thymus independent T cell development and selection in the intestinal epithelium[J]. Annual Review of Immunolgy, 1994, 12(1): 521–553. DOI:10.1146/annurev.iy.12.040194.002513 |
| [5] | Reimann J, Rudolphi A. Co-expression of CD8α in CD4+ T cell receptor αβ+ T cells migrating into the murine small intestine epithelial layer[J]. European Journal of Immunology, 1995, 25(6): 1580–1608. DOI:10.1002/(ISSN)1521-4141 |
| [6] | Giblin P, Ledbetter JA, Kavathas P. A secreted form of the human lymphocyte cell surface molecule CD8 arises from alternative splicing[J]. Proceedings of the National Academy of Sciences, 1989, 86(3): 998–1002. DOI:10.1073/pnas.86.3.998 |
| [7] | Frazer JK, Capra JD. Fundamental immunology[M]. New York: Lippincott-Raven, 1999: 37-74. |
| [8] | Turner JM, Brodsky MH, Irving BA, et al. Interaction of the unique N-terminal region of tyrosine kinase p56lck with cytoplasmic domains of CD4 and CD8 is mediated by cysteine motifs[J]. Cell, 1990, 60(5): 755–765. DOI:10.1016/0092-8674(90)90090-2 |
| [9] | Barber EK, Dasgupta JD, Schlossman SF, et al. The CD4 and CD8 antigens are coupled to a protein-tyrosine kinase(p56Lck)that phosphorylates the CD3 complex[J]. Proc Natl Acad Sci USA, 1989, 86(9): 3277–3281. DOI:10.1073/pnas.86.9.3277 |
| [10] | Nakayama K, Nakayama K, Negishi I, et al. Requirement for CD8β chain in positive selection of CD8-lineage T cells[J]. Science, 1994, 263(5150): 1131–1133. DOI:10.1126/science.8108731 |
| [11] | Arcaro A, Grégoire C, Boucheron N, et al. Essential role of CD8 palmitoylation in CD8 coreceptor function[J]. The Journal of Immunology, 2000, 165(4): 2068–2076. DOI:10.4049/jimmunol.165.4.2068 |
| [12] | Hansen JD, Strassburger P. Description of an ectothermic TCR coreceptor, CD8α, in rainbow trout[J]. The Journal of Immunology, 2000, 164(6): 3132–3139. DOI:10.4049/jimmunol.164.6.3132 |
| [13] | Moore LJ, Somamoto T, Lie KK, et al. Characterisation of salmon and trout CD8α and CD8β[J]. Molecular Immunology, 2005, 42(10): 1225–1234. DOI:10.1016/j.molimm.2004.11.017 |
| [14] | Somamoto T, Yoshiura Y, Nakanishi T, et al. Molecular cloning and characterization of two types of CD8α from ginbuna crucian carp, Carassius auratus langsdorfii[J]. Developmental & Comparative Immunology, 2005, 29(8): 693–702. |
| [15] | Buonocore F, Randelli E, Bird S, et al. The CD8α from sea bass(Dicentrarchus labrax L.):Cloning, expression and 3D modelling[J]. Fish & Shellfish Immunology, 2006, 20(4): 637–646. |
| [16] | Patel S, Overgård AC, Nerland AH. CD8α and CD8β in Atlantic halibut, Hippoglossus hippoglossus:cloning, characterization and gene expression during viral and bacterial infection[J]. Fish & Shellfish Immunology, 2008, 5(5): 570–80. |
| [17] | Xu SW, Wu JY, Hu KS, et al. Molecular cloning and expression of orange-spotted grouper(Epinephelus coioides)CD8α and CD8β genes[J]. Fish & Shellfish Immunology, 2011, 30(2): 600–608. |
| [18] | Guo Z, Wang GL, Fu JP, et al. Characterization and expression of Cd8 molecules in mandarin fish Siniperca chuatsi[J]. Journal of Fish Biology, 2013, 82(1): 189–205. DOI:10.1111/jfb.2013.82.issue-1 |
| [19] | Fischer U, Utke K, Somamoto T, et al. Cytotoxic activities of fish leucocytes[J]. Fish & Shellfish Immunology, 2006, 20(2): 209–226. |
| [20] | Parnes JR. Molecular biology and function of CD4 and CD8[J]. Advances in Immunology, 1989, 44(4): 265–311. |
| [21] | Leahy DJ, Axel R, Hendrickson WA. Crystal structure of a soluble form of the human T cell coreceptor CD8 at 2. 6 A resolution[J]. Cell, 1992, 68(6): 1145–1162. DOI:10.1016/0092-8674(92)90085-Q |
| [22] | Littman DR, Thomas Y, Maddon PJ, et al. The isolation and sequence of the gene encoding T8:a molucule defining functional classes of T lymphocytes[J]. Cell, 1985, 40(2): 237–246. DOI:10.1016/0092-8674(85)90138-2 |
| [23] | Wong JS, Wang X, Witte T, et al. Stalk regionof β chain enhances the coreceptor function of CD8[J]. The Journal of Immunology, 2003, 171(2): 867–74. DOI:10.4049/jimmunol.171.2.867 |
| [24] | Kim PW, Sun ZY, Blacklow SC. A zinc clasp structure tethers lck to T cell coreceptors CD4 and CD8[J]. Science, 2003, 301(5640): 1725–1728. DOI:10.1126/science.1085643 |
| [25] | Chang YT, Kai YH, Chi SC, et al. Cytotoxic CD8α+ leucocytes have heterogeneous features in antigen recognition and class I MHC restriction in grouper[J]. Fish & Shellfish Immunology, 2011, 30(6): 1283–1293. |
| [26] | Katakura F, Yamaguchi T, Yoshida M, et al. Demonstration of T cell and macrophage progenitors in carp(Cyprinus carpio)kidney hematopoietic tissues. Development of clonal assay system for carp hematopoietic cells[J]. Developmental & Comparative Immunology, 2010, 34(6): 685–689. |
| [27] | 李珠, 吴灶和, 简纪常, 等. 红笛鲷脾脏、头肾和胸腺中IgM+细胞与ANAE+T细胞的分布[J]. 广东海洋大学学报, 2007, 27(3): 55–59. |
| [28] | Nuñez Ortiz N, Gerdol M, Stocchi V, et al. T cell transcripts and T cell activities in the gills of the teleost fish sea bass(Dicentrarchus labrax)[J]. Developmental & Comparative Immunology, 2014, 47(2): 309–318. |
| [29] | Milner EC, Rudbach JA, Voneschen KB. Cellular responses to bacteriallipopolysaccharide:T cells recognize LPS determinants[J]. Scandinavian Journal of Immunology, 1983, 18(1): 21–28. DOI:10.1111/sji.1983.18.issue-1 |
| [30] | Araki K, Suetake H, Kikuchi K, Suzuki Y. Characterization and expression analysis of CD3ε and CD3γδ in fugu, Takifugu rubripes[J]. Immunogenetics, 2005, 57(1-2): 158–163. DOI:10.1007/s00251-005-0772-8 |
| [31] | Jason J, Inge KL. Mitogen-induced modulation of CD3, CD4, and CD8(1)[J]. Human Immunology, 2000, 61(3): 202–211. DOI:10.1016/S0198-8859(99)00128-7 |
| [32] | Raida MK, Buchmann K. Bath vaccination of rainbow trout(Oncorhynchus mykiss Walbaum)against Yersinia ruckeri:effects of temperature on protection and gene expression[J]. Vaccine, 2008, 26(8): 1050–1062. DOI:10.1016/j.vaccine.2007.12.029 |
| [33] | Kato G, Goto K, Akune I, et al. CD4 and CD8 homologues in Japanese flounder, Paralichthys olivaceus:Differences in the exp-ressions and localizations of CD4-1, CD4-2, CD8α and CD8β[J]. Developmental & Comparative Immunology, 2013, 39(3): 293–301. |
| [34] | Takizawa F, Dijkstra JM, Kotterba P, et al. The expression of CD8α discriminates distinct T cell subsets in teleost fish[J]. Developmental & Comparative Immunology, 2011, 35(7): 752–763. |