2. 中国科学院大学,北京 100049;
3. 广州市白云联佳精细化工厂,广州 510412
2. University of Chinese Academy of Sciences, Beijing 100049;
3. Guangzhou Baiyun Lianjia Fine Chemical Factory, Guangzhou 510412
微藻作为一种光合自养型生物,能够利用光能及无机营养盐合成多种生物活性物质,如脂质、蛋白质、多糖及色素等。目前,微藻脂质应用于生物柴油的研究已广泛报道,除此之外,微藻的蛋白质、多不饱和脂肪酸、类胡萝卜素(如β-胡萝卜素、虾青素、叶黄素)等生物活性物质也被广泛应用于饲料、食品、保健等行业中[1, 2]。由此可见,开发利用微藻资源,实现微藻资源产业化具有重要意义。
大量研究表明,温度、光照、盐度等环境因子的变化会影响微藻细胞内生物活性物质的合成[3, 4]。通过高盐诱导微藻内油脂、类胡萝卜素等高值化产物积累的相关研究得到了国际上的高度关注[5, 6]。Kim等[7]分离的一株淡水微藻Chlorella sorokiniana在30‰盐环境下,油脂含量是淡水培养的1.6倍。Paliwal等[8]报道,Synechocystis sp.的总胡萝卜素含量随着盐度递增呈现先增后减趋势,在0.2 mol/L(约11.7‰)素含量随着盐度-胡萝卜素在1 mol/L(约58‰)素含量随着盐度递增呈现先增3倍多。
目前淡水和耕地资源匮乏问题正日益制约着全球经济、生态环境及人类生存发展。相比之下,我国海岸线长,拥有丰富的海水资源以及大面积待开发利用的滩涂、盐碱地,是微藻规模化培养的理想用水、用地。另外,海水中富含无机营养盐,利用海水培养微藻既能充分利用现有资源又能降低生产成本[9, 10]。由此可见,利用海水培养微藻,发展微藻生物产业具有诱人前景。已有报道表明,有些耐盐性强的淡水微藻通过在海水环境中驯化培养后,可成为在天然海水中良好生长的水微藻通过[11],其中经海水驯化的螺旋藻不仅能快速生长,而且品质得到显著提高,目前已成功实现商业化生产[12]。
虽然微藻的高盐适应机制已被广泛研究,但主要集中在杜氏盐藻、螺旋藻等少数藻类[11-13],淡水藻种的海水驯化与海水培养模式也仅有个别成功案例,相关研究仍具有巨大的创新与应用开发空间。本研究所用的栅藻(Scenedesmus sp.)藻株是一株生长速度快、能适应高pH环境并富含多种高附加值产品的淡水微藻,适宜室外开放式培养。通过分析比较栅藻经不同盐度人工海水培养后生长及生化组成的变化,评估海水培养该藻株的应用开发潜力,初步探索其高盐适应机制,以期为进一步的海水驯化与培养奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 藻种本实验藻株由中国科学院南海海洋研究所微藻组分离纯化所得,经18S rDNA测序,初步确定为栅藻。
1.1.2 培养条件采用改良的ZSNT培养基培养:1 g/L NaHCO3,1.5 g/L NaNO3,0.05 g/L NaH2PO4·2H2O,0.02 g/L CaCl2,0.05 g/L MgSO4·7H2O,0.1 g/L KCl,1 mL/L A5 solution。不同盐度组通过补充NaCl调节。以300 mL管式光生物反应器作为培养体系,培养温度为(24±1)℃,光强为150 μmol/(m2·s),24 h持续光照。每组设置3个平行,培养周期12 d。
1.2 方法 1.2.1 显微观察与生长测定用Olympus BX53显微镜观察藻细胞,培养7 d后用NIS-Elements软件测量藻细胞大小;微藻生物量采用干重法测定[14]。
1.2.2 主要生化组成测定 1.2.2.1 总脂测定与分级采用改良的Khozin-Goldberg法提取总脂并测定含量[15];总脂分级采用Christie的方法[16],将总脂分为中性脂、糖脂、磷脂。
1.2.2.2 总蛋白质测定采用凯氏定氮法测定总蛋白质含量。以蛋白质的F值为6.25计算。
1.2.2.3 多糖测定称取10 mg藻粉加入5 mL 0.5 mol/L H2SO4,于80℃水浴搅拌0.5 h,5 000 r/min离心5 min,收集上清。反复抽提3次,合并上清后用去离子水定容到100 mL,得到总糖提取液;可溶性糖的提取采用热水浸提法;淀粉提取采用高氯酸水解法。多糖含量的测定采用苯酚-硫酸法[17]。
1.2.3 色素测定称取10 mg藻粉,置于10 mL玻璃离心管中,加入5 mL丙酮,避光冰浴搅拌提取1-2 d,直至藻渣变白,再5 000 r/min离心5 min,收集上清得到色素提取液。采用分光光度法测定总类胡萝卜素含量[18]、HPLC法测定色素组成和虾青素、法-胡萝卜素组分含量[17]。色谱条件:Agilent Ecl-ipse XDB-C18柱(150 mm*4.6 mm,5 μm);流动相A为90%乙腈、B为乙酸乙酯;流速1 mL/min;进样量10 μL;梯度洗脱如下:0-1 min,90% A、10% B;1-21 min,90%-0A、10%-100% B;21-23 min,0% A、100% B;23-25 min,0-90% A、100%-10% B。
1.2.4 脂肪酸测定称取25 mg冻干藻粉放入离心管中,加入2 mL 2% H2SO4无水甲醇放入离心9:1 V/V),充入氮气,再80℃水浴搅拌1.5 h,依次加入1 mL的去离子水和1 mL正己烷,震荡后3 500 r/min离心5 min,将上层有机相转移到另一小玻璃瓶,氮气吹干,再加入1 mL正己烷密封,并用孔径为0.22 μm的滤膜过滤,最后通过气相色谱(GC)进行脂肪酸测定[14]。
1.3 数据统计和分析采用SPSS13.0统计软件进行统计分析,数值变量资料以x±s,再加入量素含量解法。多糖t检验。检验水平计α=0.05,P < 0.05差异有统计学意义。
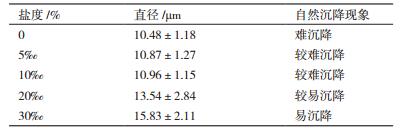
2 结果 2.1 不同盐度对Scenedesmus sp.细胞及生长的影响如表 1所示,随着培养盐度递增,细胞大小有增大趋势。当培养基盐度较低时(0-10‰),藻细胞平均直径约10.8 μm;当培养盐度升到20‰,细胞直径极显著增加(P < 0.01),平均直径13.5 μm;而当盐度进一步升至30‰时,平均直径达到15.8 μm,个别细胞直径甚至达到了20 μm。
此外,实验还发现高盐度(20‰-30‰)组的藻细胞在培养后期存在自然沉降现象(表 1),其中30‰组最为明显,培养末期停止培养通气15 min后,藻细胞自然沉降于反应器底部并与培养液形成明显的分层,静置过夜后,所有藻细胞沉降粘结为更薄更实的“藻泥层”,此时,可将上清液(培养基)与藻细胞倾析分离,收获几乎全部的藻细胞。
在12 d的培养周期内,栅藻生长受培养基中盐度的影响。如图 1所示,在培养早期,低盐度对其生长影响较小,低盐度各组的生长速度相近,随后逐渐出现差异。到达第12天,各盐度组的生物量随盐度递增而极显著下降(P < 0.01)。其中,0盐度组和30‰盐度组生物量分别为6.38 g/L和2.84 g/L,而40‰盐度组生长完全被抑制。
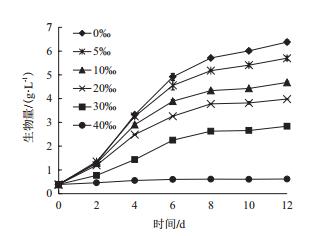
|
| 图 1 不同盐度组Scenedesmus sp.生长曲线 |
经不同盐度培养12 d后,对各盐度组栅藻的生化组成进行分析。结果如图 2所示,三大生化成分占据各组藻细胞含量的85%-92%。高盐环境下蛋白质大量积累,其含量随盐度增加而极显著增加(P < 0.01)。30‰组含量达到27.74%,与淡水组相比提高了95.40%,最终使得各组蛋白质产率变化不大,在65-75 mg/(L·d)范围内;总脂作为主要的生化组分不受盐度的影响,各组含量均占干重42%左右,差异并不显著(P>0.05)。但随着盐度的提高,中性脂比例略微下降,与此同时,糖脂、磷脂比例有所增加;总糖和淀粉含量则随盐度的增加而减少,然而可溶性糖成分含量却有所增加。尽管各组油脂含量无显著变化,但受高盐导致的生物量下降影响,产率随着盐度增加而逐步下降,30‰组的中性脂产量下降了58.98%。高盐下含量下降的多糖,其产率更是大幅度下降,30‰组多糖产率下降了66.01%。

|
| 图 2 不同盐度组Scenedesmus sp.蛋白质(A)、油脂(B)和多糖(C)含量及产率 |
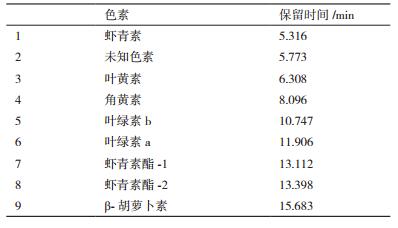
通过分光光度法和HPLC法对培养末期各盐度组色素成分进行分析,结果如表 2、表 3所示,栅藻主要由叶绿素a、叶绿素b、叶黄素、虾青素、绿-胡萝卜素、角黄素等色素组成。
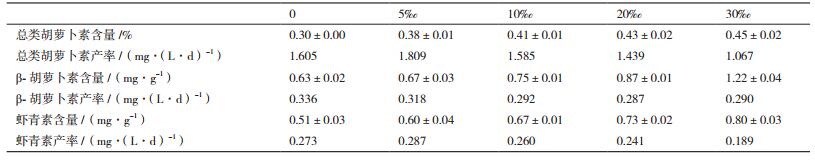
高盐环境下,总类胡萝卜素含量显著增加(P < 0.05),30‰盐度组提高到0‰组的1.5倍。其中β-胡萝卜素、虾青素等成分大量诱导生成,随盐度提高含量逐步提高,最终30‰组的β-胡萝卜素、虾青素含量提高到0组的193.65%和156.86%。
综合含量与生物量变化对产率的影响进行分析,总类胡萝卜素与虾青素在低盐度下产率有所提高,5‰盐度达到最高。此条件下的总类胡萝卜素产率比0组提高12.74%,而β-胡萝卜素产率略有降低。当盐度达到30‰,总类胡萝卜素与虾青素产率都较大幅度降低。
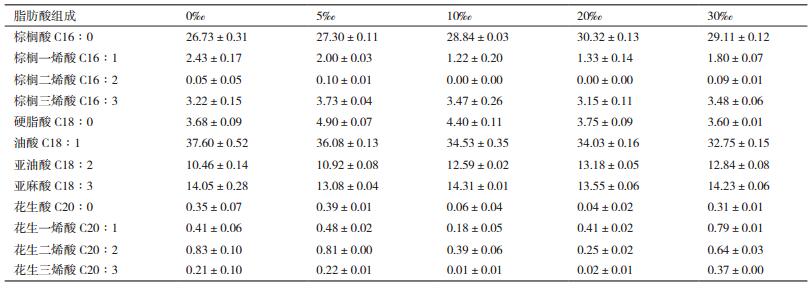
2.4 不同盐度对Scenedesmus sp.脂肪酸组成的影响GC分析结果(表 4)显示,栅藻的脂肪酸主要包括C16:0、C18:1、C18:2、C18:3。不同盐度条件下的特征脂肪酸种类没有发生改变,但个别成分含量发生了变化:C16:0和C18:2随着盐度的递增有增加的趋势;而C18:1则呈现相反的趋势,随着盐度的递增减少;C18:3在各组中无明显的变化趋势。对脂肪酸组成进一步分析发现,随着盐度的增加,单不饱和脂肪酸含量减小,饱和脂肪酸和多不饱和脂肪酸含量增加,30‰组分别提高了7.4%和9.8%。
本研究结果(表 1)显示,高盐培养会导致栅藻细胞变大,当反应器停止通气后,藻细胞极易出现自然沉降现象,初步推测细胞变大以及蛋白、可溶性糖含量的较大变化可能是其自然沉降的原因。在规模化生产过程中,由于微藻细胞微小,目前普遍采用高成本的离心法采收,采收成本约占整个生产成本的20%-30%[19],成为制约微藻大规模养殖开发的关键因素之一,而利用细胞自然下沉的特性,可以实现低成本高效率采收,采收成本几乎可以忽略不计。本实验室目前已开展采用天然海水培养淡水栅藻的室外培养试验,规模已达40 m2。试验中采用自然沉降法采收藻细胞,加之海水富含无机营养盐,可节约大量肥料元素,使其生产总成本降低了30%以上(结果另文发表)。因此,通过海水培养降低栅藻的生产成本具有重要的现实意义。
3.2 不同盐度对Scenedesmus sp.生长与品质的影响盐度是影响微藻生长繁殖的重要环境因子。很多淡水微藻都能在一定的盐度范围内生长[20],但调节渗透压需要消耗高能量,因而盐度变化往往会导致生物量下降甚至停止生长[21]。本研究的栅藻在高达30‰盐度环境下仍有生长或醒,说明该藻株具有一定的耐盐能力。
目前我国的蛋白源高度依赖进口,其中饲料蛋白源进口量已达到6 300 t/年[22]。本研究结果表明,在高盐条件下,栅藻细胞中许多有价值的生物活性物质含量得以提高。随着盐度增加,蛋白质含量变化最为显著,在30‰盐度组达到最高,比淡水0组提高了95.40%,并且高盐对蛋白质产率的影响不大,30‰盐度组可达65.66 mg/(L·d)。综合考虑前文所讨论的成本因素,通过海水培养可以较大幅度降低栅藻蛋白质的生产成本。同时,由于高盐培养的栅藻β-胡萝卜素、虾青素及多不饱和脂肪酸含量也显著增加,这些生物活性物质对维持动物正常生长繁殖、体色,提高饲料利用效率具有重要作用[23, 24],可增加饲料蛋白源的应用价值。因此,海水培养栅藻用作饲料蛋白源开发具有一定的潜力。
而栅藻β-胡萝卜素、虾青素等类胡萝卜素及油脂的产率在高盐(20%-30‰)条件下均显著降低。同时,根据油脂产率和脂肪酸相对含量变化可以推测,脂肪酸产率也应显著降低。因此,综合考虑前文所述的成本降低因素,采用海水培养栅藻开发类胡萝卜素、油脂及不饱和脂肪酸的意义不大。
目前,已有淡水螺旋藻成功驯化成“海水种”并藉此提高其产量和品质、实现商业化生产的报道[12]。本研究显示,有必要进一步增强栅藻对海水高盐度的适应性,筛选、驯化完全适宜天然海水培养、快速生长的优势藻株。
3.3 Scenedesmus sp.的高盐适应机制微藻适应盐度的机制因藻种不同而存在差异,但大体上都是通过合成具有渗透调节作用的物质,以平衡胞外高盐所形成的高渗透压[25, 26]。或者通过膜上的离子转运体将K+运输到胞内,Na+排出胞外,实现细胞内外的离子渗透平衡[27]。
已有研究表明,可溶性糖可作为盐度适应的渗透调节物质[28, 29],这也与本研究的结果一致:随着盐度增加,栅藻细胞内可溶性糖含量逐步提高。而前人对杜氏藻(Dunaliella sp.)的研究发现,淀粉与其渗透调节物质可相互转化[13]。在本研究中,高盐条件也引起了栅藻淀粉含量的显著下降。因此我们推测,栅藻可能通过淀粉(多糖)的分解形成小分子可溶性糖而实现对高盐的适应。
胁迫条件下微藻细胞内起抗氧化作用的β-胡萝卜素、虾青素等次生色素含量会显著增加[8, 30],以应对胁迫引起的氧化压力[31]。β-胡萝卜素可消除盐胁迫下大量积累的活性氧,从而提高对盐胁迫导致的氧化胁迫抗性;虾青素不但能通过淬灭活性氧原子获得能量以实现自身的合成,其抗氧化能力甚至是β-胡萝卜素的10倍[24, 31]。本研究发现高盐诱导了栅藻内β-胡萝卜素的大量合成,同时总类胡萝卜素、虾青素的含量也有增加的趋势。因此,抗氧化色素的积累也可能是其高盐适应的重要机制之一。
4 结论随着盐度增加,淡水栅藻生长受抑制程度逐步增加,盐度达40‰时,藻细胞生长完全停止。高盐(20‰-30‰)培养导致藻细胞明显变大、易自然沉降,可直接收获藻细胞。在30‰盐度下,该藻株仍能良好生长,此条件下培养的栅藻保持其高油脂含量,而蛋白质、β-胡萝卜素、虾青素含量大幅度提高,蛋白质产率略有降低,油脂、β-胡萝卜素、虾青素产率下降。
| [1] | Tang YT, Rosenberg JN, Bohutskyi P, et al. Microalgae as a feedstock for biofuel precursors and value-added products:green fuels and golden opportunities[J]. BioResources, 2016, 11: 36. |
| [2] | Spolaore P, Joannis-Cassan C, Duran E, et al. Commercial applications of microalgae[J]. Journal of Bioscience and Bioengineering, 2006, 101: 87–96. DOI:10.1263/jbb.101.87 |
| [3] | Sibi G, Shetty V, Mokashi K. Enhanced lipid productivity approaches in microalgae as an alternate for fossil fuels-A review[J]. J Energy Inst, 2016, 89: 330–334. DOI:10.1016/j.joei.2015.03.008 |
| [4] | Minhas AK, Hodgson P, Barrow CJ, et al. A Review on the assessment of stress conditions for simultaneous production of microalgal lipids and carotenoids[J]. Front Microbiol, 2016, 7: 19. |
| [5] | Rao AR, Dayananda C, Sarada R, et al. Effect of salinity on growth of green alga Botryococcus braunii and its constituents[J]. Bioresource Technology, 2007, 98: 560–564. DOI:10.1016/j.biortech.2006.02.007 |
| [6] | Fazeli MR, Tofighi H, Samadi N, et al. Effects of salinity on beta-carotene production by Dunaliella tertiolecta DCCBC26 isolated from the Urmia salt lake, north of Iran[J]. Bioresource Technology, 2006, 97: 2453–2456. DOI:10.1016/j.biortech.2005.10.037 |
| [7] | Kim BH, Ramanan R, Kang Z, et al. Chlorella sorokiniana HS1, a novel freshwater green algal strain, grows and hyperaccumulates lipid droplets in seawater salinity[J]. Biomass Bioenerg, 2016, 85: 300–305. DOI:10.1016/j.biombioe.2015.12.026 |
| [8] | Paliwal C, Pancha I, Ghosh T, et al. Selective carotenoid accumula-tion by varying nutrient media and salinity in Synechocystis sp. CCNM 2501[J]. Bioresource Technology, 2015, 197: 363–368. DOI:10.1016/j.biortech.2015.08.122 |
| [9] | 刘建国, 龙元薷, 黄园, 等. 微藻生物柴油研究现状与发展策略[J]. 海洋科学, 2013, 37(10): 132–141. |
| [10] | 孙丽英, 何皓, 田宜水, 等. 微藻规模化生产的关键问题[J]. 可再生能源, 2012, 30(9): 70–74. |
| [11] | 吴伯堂, 何汝洪, 彭云辉. 钝顶螺旋藻海水驯化的初步研究[J]. 海洋与湖沼, 1988, 19(2): 197–200. |
| [12] | 向文洲, 李涛, 吴华莲, 等. 海水螺旋藻产业发展战略研究[J]. 广西科学, 2014(6): 573–579. |
| [13] | Chen H, Jiang JG. Osmotic responses of Dunaliella to the changes of salinity[J]. Journal of Cellular Physiology, 2009, 219: 251–258. DOI:10.1002/jcp.v219:2 |
| [14] | Li T, Wan LL, Li AF, et al. Responses in growth, lipid accumula-tion, and fatty acid composition of four oleaginous microalgae to different nitrogen sources and concentrations[J]. Chin J Oceanol Limnol, 2013, 31: 1306–1314. DOI:10.1007/s00343-013-2316-7 |
| [15] | Khozin-Goldberg I, Shrestha P, Cohen Z. Mobilization of arachidonyl moieties from triacylglycerols into chloroplastic lipids following recovery from nitrogen starvation of the microalga Parietochloris incisa[J]. Biochimica Et Biophysica Acta-Molecular and Cell Biology of Lipids, 2005, 1738: 63–71. DOI:10.1016/j.bbalip.2005.09.005 |
| [16] | Christie WW. Lipid analysis:isolation, separation, identification, and structural analysis of lipids[M]. Pergamon Press, 1982. |
| [17] | Li T, Xu J, Gao B, et al. Morphology, growth, biochemical composition and photosynthetic performance of Chlorella vulgaris(Trebouxiophyceae)under low and high nitrogen supplies[J]. Algal Res, 2016, 16: 481–491. DOI:10.1016/j.algal.2016.04.008 |
| [18] | Lichtenthaler HK. Chlorophylls and carotenoids:Pigments of photosynthetic biomembranes[M]. Method Enzymol: Academic Press, 1987: 350-382. |
| [19] | Grima EM, Belarbi EH, Fernandez FGA, et al. Recovery of microalgal biomass and metabolites:process options and economics[J]. Biotechnology Advances, 2003, 20: 491–515. DOI:10.1016/S0734-9750(02)00050-2 |
| [20] | von Alvensleben N, Magnusson M, Heimann K. Salinity tolerance of four freshwater microalgal species and the effects of salinity and nutrient limitation on biochemical profiles[J]. Journal of Applied Phycology, 2016, 28: 861–876. DOI:10.1007/s10811-015-0666-6 |
| [21] | Oren A. Bioenergetic aspects of halophilism[J]. Microbiology and Molecular Biology Reviews, 1999, 63: 334–348. |
| [22] | 麦康森. 水产饲料的蛋白源问题[J]. 科学养鱼, 2014, 6: 4. |
| [23] | 苏小凤, 邵庆均. 多不饱和脂肪酸在鱼类营养与饲料中的作用及其氧化稳定性[J]. 饲料研究, 2002, 3: 11–14. DOI:10.3969/j.issn.1002-2813.2002.03.004 |
| [24] | Dufosse L, Galaup P, Yaron A, et al. Microorganisms and microal-gae as sources of pigments for food use:a scientific oddity or an industrial reality?[J]. Trends in Food Science and Technology, 2005, 16(9): 389–406. DOI:10.1016/j.tifs.2005.02.006 |
| [25] | Lyon BR, Bennett-Mintz JM, Lee PA, et al. Role of dimethylsulfoni-opropionate as an osmoprotectant following gradual salinity shifts in the sea-ice diatom Fragilariopsis cylindrus[J]. Environ Chem, 2016, 13: 181–194. DOI:10.1071/EN14269 |
| [26] | Scholz B, Liebezeit G. Compatible solutes in three marine intertidal microphytobenthic Wadden Sea diatoms exposed to different salinities[J]. European Journal of Phycology, 2012, 47: 393–407. DOI:10.1080/09670262.2012.720714 |
| [27] | Talebi AF, Tabatabaei M, Mohtashami SK, et al. Comparative salt stress study on intracellular ion concentration in marine and salt-adapted freshwater strains of microalgae[J]. Notulae Scientia Biologicae, 2013, 5: 309. |
| [28] | 毕永红, 邓中洋, 胡征宇, 等. 发状念珠藻对盐胁迫的响应[J]. 水生生物学报, 2005, 29(2): 125–129. |
| [29] | 毛桂莲, 许兴, 徐兆桢. 植物耐盐生理生化研究进展[J]. 中国生态农业学报, 2004, 12(1): 43–46. |
| [30] | Sarada R, Tripathi U, Ravishankar GA. Influence of stress on astaxanthin production in Haematococcus pluvialis grown under different culture conditions[J]. Process Biochem, 2002, 37: 623–627. DOI:10.1016/S0032-9592(01)00246-1 |
| [31] | Lemoine Y, Schoefs B. Secondary ketocarotenoid astaxanthin biosynthesis in algae:a multifunctional response to stress[J]. Photosynthesis Research, 2010, 106: 155–177. DOI:10.1007/s11120-010-9583-3 |