2. 河北师范大学生命科学学院,石家庄 050024
2. College of Life Sciences, Hebei Normal University, Shijiazhuang 050024
BIN2(Brassinosteroid Insensitive 2) 是类糖原合成酶激酶3(Glycogen synthase kinase 3,GSK3) 家族的成员。GSK3是一类在真核生物中非常保守的基因家族,广泛参与调控众多的生物学过程,具有典型的结构特征,从N端到C端依次由可变域、保守激酶域及C末端域组成[1, 2]。拟南芥中GSK-LIKE家族共有10个成员,依据序列同源性又可细分为4个亚家族,其中BIN2是Ⅱ亚家族中的AtSK21。拟南芥GSK-LIKE成员在植物BR(Brassinosteroid,油菜素内酯)信号转导,生长素信号转导、花发育、侧根的发育、非生物胁迫响应和气孔发育等多方面发挥重要作用[3-9]。
在拟南芥中BIN2作为负调控因子参与BR信号通路。BR是一种重要的植物内源激素,在植物细胞伸长,维管组织分化,植物的抗逆抗病等诸多生长发育过程中发挥重要作用,它是目前公认的继生长素、赤霉素、细胞分裂素、脱落酸、乙烯之后被发现的第六大类植物激素。BR合成缺失突变体或对BR不敏感的突变体表现为植株矮小、叶片暗绿及暗中光形态建成等表型[10, 11]。近年来,关于BR信号转导方面的研究一直是生物学领域研究的热点问题之一,并且取得了很多重大的科研成果,鉴定出了很多参与BR信号转导的组分,BR通过一条磷酸化信号转导通路调节基因表达。当植物体内BR浓度较低时,BIN2持续磷酸化转录因子BZR1(Brassin-azole Resistant 1) 和BES1(bri1-Ethylmethane Suppr-essor 1)。随着BR浓度升高,BIN2的活性受到抑制,失活的BIN2不能继续磷酸化下游的BZR1和BE-S1,而BZR1和BES1会被蛋白磷酸酶PP2A(Protein Phosphatase 2A)去磷酸化进而调控下游基因的表达。在这一系列的蛋白质可逆磷酸化修饰过程中,激酶BIN2与磷酸酶PP2A相互配合控制核心转录因子BZR1/BES1的磷酸化状态在BR信号转导通路中发挥十分重要的作用[12-16]。近年来的研究表明,BIN2可以磷酸化并抑制MAPKKK(YDA)活性而参与植株气孔发育[4, 17]。BIN2在BR信号转导与植株气孔发育的交叉互作中发挥核心作用。基于BIN2功能的重要性,纯化BIN2蛋白并解析其晶体结构将更有助于理解其结构与功能的关系。
目前,纯化蛋白通常利用融合表达的亲和标签,获得带有标签蛋白的融合蛋白。常用的标签有两类:一类是一些多肽表位,能够与固定在树脂上的分子配体或多肽结合。如Flag标签,生物素受体多肽标签以及钙调蛋白结合多肽标签等; 另一类是能够与固定在层析介质上的小分子配体结合的大蛋白标签,如GST,MBP标签等。无论哪种标签都会干扰蛋白的生物学活性,影响其晶体结构。通常情况下可以用一种高度特异性的蛋白内切酶切割和去除标签,但是这些蛋白酶对不同蛋白质的切割效率差异很大,并且蛋白切割操作步骤比较复杂,很可能在切割过程中对蛋白造成影响,比如蛋白质变性、降解等。本研究中利用Bio-Rad公司的Profinity eXact纯化系统很好的解决了上述问题。该系统把eXact标签与固定在纯化介质上的突变的丝氨酸蛋白酶结合,利用卤素离子氟离子或者叠氮化钠在标签和目的蛋白之间剪切,使标签滞留在纯化介质上,而目的蛋白从层析柱上洗脱下来。蛋白洗脱与切割一步完成,切割下来的目的蛋白不含有eXact纯化标签的残留,能够保持目的蛋白本身的生理特性[18-20]。本研究拟利用Profinity eXact纯化系统来纯化不带标签的、且具有较好激酶活性的BIN2蛋白,为进一步研究其蛋白晶体结构及生物学功能奠定基础。
1 材料与方法 1.1 材料基因克隆所用酶类及试剂购于康为世纪公司; IPTG诱导剂购于Sigma公司; eXact纯化介质购于美国Bio-Rad公司。
1.2 方法 1.2.1 BIN2基因的克隆及eXact-BIN2原核表达载体的构建利用BIN2的基因特异引物扩增获得其全长基因。将BIN2扩增片段与空载体pPAL8分别用SpeⅠ和NotⅠ双酶切,回收目的条带,经连接酶连接后转化大肠杆菌DH5α。挑取一些克隆进行双酶切鉴定,选取酶切鉴定的阳性克隆测序。测序正确的重组载体eXact-BIN2转化大肠杆菌BL21(DE3)。
1.2.2 IPTG诱导浓度、诱导温度和诱导时间对eXact-BIN2蛋白表达的影响将转化eXact-BIN2重组载体的BL21大肠杆菌在LB液体培养基中培养过夜,1:200扩培后继续培养至菌液OD600在0.6-0.8之间,分别使用终浓度为0.1 mmol/L和0.5 mmol/L的IPTG,在37℃、30℃和23℃ 3种不同温度下诱导1-6 h收集菌体。SDS-PAGE电泳检测eXact-BIN2蛋白表达情况,确定合适的IPTG浓度、诱导温度以及诱导时间。
1.2.3 BIN2蛋白的纯化利用eXact介质进行纯化。收集经IPTG诱导的菌体,弃去上清,用样品缓冲液(0.1 mol/L磷酸盐缓冲液,pH7.2) 重悬菌体,超声破碎后,14 000 r/min 4℃离心15 min。收集上清液与eXact介质低温混匀1-2 h。1 500-2 000 g/min离心,弃去上清。用加入0.2% Triton-X100的样品缓冲液洗涤eXact介质数次除去杂蛋白。利用蛋白洗脱缓冲液(0.1 mol/L磷酸盐缓冲液,pH7.2,0.1 mol/L NaF)与eXact介质孵育5-10 min,离心收集洗脱液,重复洗脱多次。取0.5-1 µg获得的蛋白进行SDS-PAGE电泳,检测蛋白纯化效果。
1.2.4 体外蛋白激酶试验准备50 mmol/L Tris.HCl,pH7.4,10 μmol/L ATP,1 mmol/L MgCl2作为激酶反应液。将1 μg BIN2蛋白与0.5 μg MBP-BZR1蛋白加入到激酶反应液中至总体系20 μL,室温孵育10-30 min。然后利用SDS-PAGE电泳通过分析电泳迁移率的变化判断MBP-BZR1是否被BIN2磷酸化。蛋白质被磷酸化后,分子量变大,电泳时迁移速度变慢,使用合适浓度的蛋白分离胶可以区分出磷酸化前后蛋白质分子量的差异。因此,可以通过分析底物蛋白质在激酶反应前后的电泳迁移情况来判断MBP-BZR1是否被BIN2磷酸化。
2 结果 2.1 BIN2基因的克隆及eXact-BIN2原核表达载体的构建利用基因特异性引物扩增获得1 143 bp的BIN2全长基因(图 1-A),经SpeⅠ和NotⅠ双酶切鉴定获得大约1 000 bp的小片段和大约6 000 bp的大片段,分别与基因片段和空载体大小相符。再利用SpeⅠ进行单酶切鉴定,获得大约7 000 bp的片段,与BIN2基因加空载体的总大小相符(图 1-B)。挑取克隆测序后获得正确的eXact-BIN2原核表达载体。
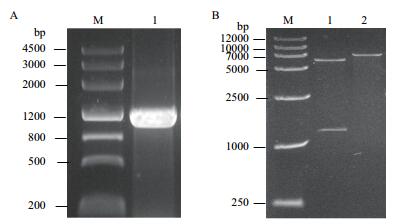
|
| 图 1 eXact-BIN2原核表达载体的构建 A:BIN2基因的扩增(1:BIN2基因); B:eXact-BIN2载体的酶切鉴定(1:SpeⅠ和NotⅠ双酶切结果; 2:SpeⅠ单酶切结果) |
将转化eXact-BIN2重组载体的BL21大肠杆菌分别使用终浓度为0.1 mmol/L和0.5 mmol/L的IPTG,在37℃、30℃和23℃ 3种不同温度下诱导1-6 h收集菌体。SDS-PAGE检测结果(图 2) 表明,诱导的eXact-BIN2融合蛋白为51 kD,并且该蛋白对诱导条件的要求并不十分严格,在37℃、30℃和23℃温度下eXact-BIN2蛋白表达量均较高,0.1 mmol/L和0.5 mmol/L IPTG的诱导效果也没有明显差异。

|
| 图 2 不同诱导条件下eXact-BIN2融合蛋白的表达 A:37℃,0.1 mmol/L或0.5 mmol/L IPTG诱导eXact-BIN2融合蛋白表达; B:30℃,0.1 mmol/L或0.5 mmol/L IPTG诱导eXact-BIN2融合蛋白表达; C:23℃,0.1 mmol/L或0.5 mmol/L IPTG诱导eXact-BIN2融合蛋白表达 |
经过摸索,确定IPTG诱导浓度为0.1 mmol/L,然后在37℃、30℃和23℃温度下分别对BIN2蛋白进行诱导和纯化。SDS-PAGE表明获得的eXact-BIN2融合蛋白纯度质量均较高,洗脱后切除eXact标签的BIN2蛋白分子量大小为43 kD(图 3)。测定蛋白浓度,发现37℃诱导后纯化的蛋白浓度较低,为93.4 µg/L; 30℃诱导后纯化的蛋白浓度为420.4 µg/L; 23℃诱导后纯化的BIN2蛋白浓度最高,为997.2 µg/L,可能是23℃诱导时产生的可溶性BIN2蛋白量最多。
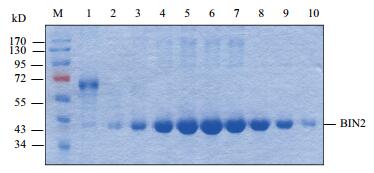
|
| 图 3 切除eXact标签的BIN2蛋白的洗脱结果 1-10:连续收集的10份BIN2蛋白洗脱液; M:蛋白标准分子量 |
将试验所获得的BIN2蛋白通过体外蛋白激酶试验检测其活性,结果如图 4所示,跟孵育前的MBP-BZR1(泳道2) 相比,与BIN2共同孵育后的MBP-BZR1分子量变大,电泳迁移变慢,表明MBP-BZR1已经被BIN2磷酸化成为磷酸化状态的BZR1(pBZR1)(泳道3)。泳道1为单独的MBP蛋白,泳道4为单独的BIN2蛋白。
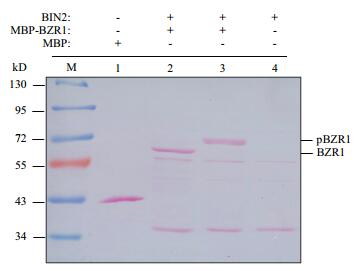
|
| 图 4 BIN2能够体外磷酸化MBP-BZR1 |
可逆磷酸化是一种重要的蛋白质翻译后修饰方式,广泛参与植物体内细胞分裂和伸长、激素信号转导、植物对逆境胁迫的反应、光合作用和衰老等众多生物学过程。植物体内蛋白激酶种类很多,BIN2作为一类丝氨酸/苏氨酸蛋白激酶,属于GSK3家族成员,对其大部分底物都以负调节的作用方式发挥作用。BIN2通过磷酸化BZR1在BR信号转导通路中发挥负调控作用[12]。
研究蛋白质修饰的试验中经常会利用标签来纯化目的蛋白,然而,标签蛋白作为融合蛋白的一部分会一起被纯化出来,并且标签的大小、亲疏水性,以及带电荷情况都会对目的蛋白的表达、可溶性以及活性等方面产生影响。为了避免标签的干扰,获得更接近生理条件下的蛋白,纯化不带标签的蛋白是一种非常重要的手段。不带标签的蛋白可以通过纯化后对融合蛋白进行标签剪切获得,但是分离去除标签蛋白操作步骤比较复杂,并且可能在剪切过程中导致蛋白质变性、降解等。Bio-Rad公司的Profinity eXact纯化系统将蛋白洗脱与蛋白切割一步完成,切割下来的目的蛋白不含有纯化标签,能够保持目的蛋白本身的生理特性。这是与传统的蛋白纯化标签相比而具有的一个极大的优点[19, 20]。本研究获得的不带标签的BIN2蛋白保留了很好的激酶活性,能够在体外磷酸化底物MBP-BZR1蛋白。在纯化过程中,多次重复试验,收集的第一管蛋白洗脱液中都含有一个分子量大约70 kD的蛋白,推测可能是对维持BIN2正确构象与激酶活性密切相关的伴侣蛋白,也可能是与纯化介质非特异结合的杂蛋白。
4 结论本研究成功构建了eXact-BIN2原核表达载体,诱导出51 kD的eXact-BIN2融合蛋白。利用eXact纯化介质成功获得了不带标签的,大小约为43 kD的BIN2蛋白,该BIN2蛋白具有较好的激酶活性,能够在体外磷酸化底物MBP-BZR1蛋白。
| [1] | Li J, Nam KH. Regulation of brassinosteroid signaling by a GSK3/SHAGGY-like kinase[J]. Science, 2002, 295(5558): 1299–1301. |
| [2] | Yan ZY, Zhao J, Peng P, et al. BIN2 functions redundantly with other Arabidopsis GSK3-Like kinases to regulate brassinosteroid signaling[J]. Plant Physiology, 2009, 150(2): 710–721. DOI:10.1104/pp.109.138099 |
| [3] | Kim TW, Guan S, Sun Y, et al. Brassinosteroid signal transduction from cell-surface receptor kinases to nuclear transcription factors[J]. Nature Cell Biology, 2009, 11(10): 1254–1260. DOI:10.1038/ncb1970 |
| [4] | Kim TW, Michniewicz M, Bergmann DC, et al. Brassinosteroid regulates stomatal development by GSK3-mediated inhibition of a MAPK pathway[J]. Nature, 2012, 482(7385): 419–U1526. DOI:10.1038/nature10794 |
| [5] | Khan M, Rozhon W, Bigeard J, et al. Brassinosteroid-regulated GSK3/Shaggy-like kinases phosphorylate mitogen-activated protein(MAP)kinase kinases, which control stomata development in Arabidopsis thaliana[J]. Journal of Biological Chemistry, 2013, 288(11): 7519–7527. DOI:10.1074/jbc.M112.384453 |
| [6] | Cho H, Ryu H, Rho S, et al. A secreted peptide acts on BIN2-mediated phosphorylation of ARFs to potentiate auxin response during lateral root development[J]. Nature Cell Biology, 2014, 16(1): 66–76. |
| [7] | Vert G, Walcher CL, Chory J, et al. Integration of auxin and brassinosteroid pathways by Auxin Response Factor 2[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(28): 9829–9834. DOI:10.1073/pnas.0803996105 |
| [8] | Dal Santo S, Stampfl H, Krasensky J, et al. Stress-induced GSK3 regulates the redox stress response by phosphorylating glucose-6-phosphate dehydrogenase in Arabidopsis[J]. Plant Cell, 2012, 24(8): 3380–3392. DOI:10.1105/tpc.112.101279 |
| [9] | Wang RJ, Liu MM, Yuan M, et al. The Brassinosteroid-activated BRI1 receptor kinase is switched off by dephosphorylation mediated by cytoplasm-localized PP2A B' Subunits[J]. Molecular Plant, 2016, 9(1): 148–157. DOI:10.1016/j.molp.2015.10.007 |
| [10] | Clouse SD, Langford M, McMorris TC. A brassinosteroid-insensitive mutant in Arabidopsis thaliana exhibits multiple defects in growth and development[J]. Plant Physiology, 1996, 111(3): 671–678. DOI:10.1104/pp.111.3.671 |
| [11] | Li J, Nagpal P, Vitart V, et al. A role for brassinosteroids in light-dependent development of Arabidopsis[J]. Science, 1996, 272(5260): 398–401. DOI:10.1126/science.272.5260.398 |
| [12] | Kim TW, Wang ZY. Brassinosteroid signal transduction from receptor kinases to transcription factors[J]. Annual Review of Plant Biology, 2010, 61: 681–704. DOI:10.1146/annurev.arplant.043008.092057 |
| [13] | Tang W, Yuan M, Wang R, et al. PP2A activates brassinosteroid-responsive gene expression and plant growth by dephosphorylating BZR1[J]. Nature Cell Biology, 2011, 13(2): 124–131. DOI:10.1038/ncb2151 |
| [14] | Kim TW, Guan S, Burlingame AL, et al. The CDG1 kinase mediates brassinosteroid signal transduction from BRI1 receptor kinase to BSU1 phosphatase and GSK3-like kinase BIN2[J]. Molecular Cell, 2011, 43(4): 561–571. DOI:10.1016/j.molcel.2011.05.037 |
| [15] | Hartwig T, Wang ZY. The molecular circuit of steroid signalling in plants[J]. Essays Biochem, 2015, 58: 71–82. DOI:10.1042/bse0580071 |
| [16] | Fan M, Bai MY, Kim JG, et al. The bHLH transcription factor HBI1 mediates the trade-off between growth and pathogen-associated molecular pattern-triggered immunity in Arabidopsis[J]. Plant Cell, 2014, 26(2): 828–841. DOI:10.1105/tpc.113.121111 |
| [17] | Gudesblat GE, Schneider-Pizon J, Betti C, et al. SPEECHLESS integrates brassinosteroid and stomata signalling pathways[J]. Nature Cell Biology, 2012, 14(5): 548–U214. DOI:10.1038/ncb2471 |
| [18] | Huang L, Mao X, Abdulaev NG, et al. One-step purification of a functional, constitutively activated form of visual arrestin[J]. Protein Expression And Purification, 2012, 82(1): 55–60. DOI:10.1016/j.pep.2011.11.007 |
| [19] | 李青, 张强, 邹丽云, 等. 应用Profinity eXact标签在真核表达系统中纯化EGFP蛋白[J]. 免疫学杂志, 2011, 27(2): 144–148. |
| [20] | 冯金, 洪愉, 黄芬, 等. 基于Profinity eXact系统的可溶性egfp表达和纯化[J]. 生命科学研究, 2014, 18(4): 310–314. |




