甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)是一种重要的糖酵解酶,它催化三磷酸甘油酸氧化磷酸化成为1,3-二磷酸甘油酸,主要有参与能量代谢、DNA修复、蛋白表达调节等多种生理功能。关于哺乳动物GAPDH蛋白各种生物性能的鉴定已有较多报道[1],包括运输和膜融合中的作用、微管组装、核输出和蛋白磷酸转移酶/激酶反应。同时也发现真核生物GAPDH与细胞附着有关,可能起到增强细胞骨架结构的作用[2]。GAPDH作为管家基因,在真核和原核生物中高度保守,氨基酸序列同源性高达70%-100%,且在同种组织或细胞的不同时期表达量相对恒定,因而被作为内参蛋白广泛应用[3]。
目前对基因进行表达定量的常用方法有实时定量PCR、RNA印迹、核糖核酸酶保护分析、基因芯片等,在蛋白水平进行定量的方法有蛋白印迹、免疫共沉淀等,都需应用内参基因对目的基因和蛋白进行校正,以获得真实可靠的结果。管家基因有几百种,最常用的有甘油醛-3-磷酸脱氢酶(GAPDH)[4-7]、肌动蛋白(Actin)[4, 6-8]、微管蛋白(Tubulin)[6, 9]、组蛋白3(H3)[10, 11]、核糖体蛋白L3(RPL3)[7, 12]和泛素结合蛋白(UBC)[13, 14]等。GAPDH作为内参基因的一种,它具有高度的保守性,在各种类型组织和细胞中均恒定表达。
家蚕是重要的经济昆虫和鳞翅目模式生物,在研究昆虫遗传发育、基因调控分子机制和功能基因组学中具有重要作用。内参基因在家蚕的相关基因功能研究中发挥着必不可少的作用。本研究以家蚕为研究对象,通过对家蚕GAPDH基因进行克隆、原核表达和纯化,获得GAPDH蛋白的多克隆抗体,并检测GAPDH多克隆抗体在家蚕不同时期不同组织样品中的杂交效果,旨在为家蚕不同蛋白表达水平分析提供了前提,同时为家蚕和其他同源物种昆虫的蛋白功能研究提供更加高效的抗体。
1 材料与方法 1.1 材料pET-28a表达载体和原核表达菌株Rosetta由南阳师范学院河南省伏牛山昆虫生物学重点实验室保存,辣根过氧化物标记的羊抗兔抗体购自北京中山金桥; 福氏完全佐剂,福氏不完全佐剂购自Sigma公司; 2.5 kg左右雄性新西兰纯种大白兔购自郑州大学实验动物中心。
1.2 方法 1.2.1 家蚕总RNA的提取及cDNA的合成利用Trizol试剂(Invitrogen)提取家蚕细胞的总RNA,按照大连宝生物的PrimeScript Ⅱ反转录试剂盒合成第一条链cDNA。
1.2.2 家蚕GAPDH基因的克隆及测序根据NCBI数据库中编码家蚕GAPDH序列(LOC692786) 设计特异引物(表 1),以家蚕RNA反转录产物为模板,进行PCR扩增。PCR反应体系:10×buffer 2 µL,dNTP 1.6 µL cDNA 1 µL,rTaq酶0.2 µL,上下游引物各0.8 µL,加无菌水补至20 µL。PCR反应条件:95℃预变性5 min,30个循环(95℃变性30 s,55℃退火30 s,72℃延伸30 s),72℃延伸10 min。检测正确的PCR产物通过胶回收试剂盒对目的条带进行切胶回收。将回收的目的片段连接pMD-19T载体(TaKaRa),转化大肠杆菌,通过蓝白斑筛选挑取阳性克隆,经PCR和双酶切鉴定后送深圳华大基因科技服务有限公司进行测序。
将测序正确的GAPDH/pMD-19T用BamH Ⅰ和EcoR Ⅰ进行双酶切,并切胶纯化目的片段,将纯化产物连接到带有His标签的pET-28a载体,对阳性菌落进行PCR和双酶切鉴定,经鉴定正确的重组质粒用于转化Rosetta感受态细胞进行蛋白诱导表达。
1.2.4 GAPDH融合蛋白的原核表达纯化及鉴定将重组质粒GAPDH/pET-28a转入大肠杆菌Rosetta感受态细胞中,37℃,220 r/min振荡培养过夜; 次日,按照1:100的比例(V/V),取1 mL菌液加入到100 mL新的含有卡那霉素培养基中,37℃,220 r/min至OD600值为0.6-0.8时按1:1 000的比例(V/V)加入终浓度为0.4 mmol/L IPTG,37℃,220 r/min诱导3 h,SDS-PAGE检测目的蛋白表达情况。诱导后有目的蛋白表达的菌液,4℃,6 000 r/min离心10 min收集菌体,弃上清,用2 mL pH7.4,50 mmol/L Tris-HCl缓冲液重悬沉淀,超声破碎30 min并离心,SDS-PAGE检测目的蛋白的表达形式。结果表明,GAPDH以包涵体的形式存在于沉淀中。
GAPDH包涵体蛋白按照文献报道的KCl染色切胶方法进行纯化[15]。将超声破碎后的样品4℃,12 000 r/min离心5 min,弃上清,沉淀加入适量蛋白上样缓冲液重悬,沸水浴加热10 min后SDS-PAGE电泳分离,然后用适量的0.25 mol/L的KCl溶液染色5 min,用手术刀片切下染成银白色的目的条带,用PBS洗3次后,将胶条碾碎并移入EP管中,并加入适量PBS于4℃振荡透析过夜。离心后取上清,电泳检测目的蛋白的纯度和浓度,并利用His单抗与纯化后GAPDH融合蛋白进行Western blot杂交鉴定。
1.2.5 GAPDH多克隆抗体的制备和效价测定选取新西兰纯种大白兔,将纯化后的GAPDH蛋白作为抗原与等体积的弗氏完全佐剂进行1:1充分混合乳化,在双肩周围皮下进行多点注射,注射前取少量正常血清作为阴性对照。首次免疫10 d后,以相同抗原与等体积的弗氏不完全佐剂1:1充分混合进行第2次免疫,之后每隔7-10 d免疫1次。免疫3次后取少许血清检测免疫效果。经4次免疫10 d后,进行心脏采血,分离血清进行效价检测。
采用酶联免疫吸附(Enzyme-linked immuno sor-bent assay,ELISA)测定方法检测抗体的效价,用浓度为0.5 mg/mL融合His-GAPDH于4℃过夜包被ELISA板,采用3%牛血清蛋白缓冲液进行封闭,将兔抗GAPDH的多抗血清按照1:500、1:1 000、1:2 000、1:4 000、1:8 000、1:16 000和1:32 000进行稀释,一抗孵育2 h,二抗孵育1 h,最后加入显色液反应15 min,用酶标仪检测450 nm处吸光值,未免疫前的血清为阴性对照。
1.2.6 Western blot检测GAPDH多克隆抗体的特异性将家蚕幼虫不同龄期以及家蚕成虫各个组织进行液氮研磨,然后加入适量含1 mmol/L PMSF蛋白酶抑制剂的50 mmol/L pH7.4 Tris-HCl缓冲液,充分混匀后在4℃,12 000 r/min离心20 min,取上清通过12% SDS-PAGE电泳检测。将家蚕各样品的总蛋白通过半干转印系统(15 V,10 min)转到PVDF膜上,用PBST + 2.5%的脱脂牛奶室温封闭2 h,然后加入1:500稀释的GAPDH多克隆抗体室温孵育2 h,洗膜后加入1:1 000稀释的辣根过氧化物酶标记的羊抗兔IgG,室温孵育1 h,最后用增强型DAB显色试剂盒(Solarbio)显色至条带清晰。
2 结果 2.1 家蚕GAPDH的PCR克隆及序列分析以家蚕RNA反转录后的cDNA为模板,用设计的特异引物进行PCR扩增,结果(图 1) 显示在1 000 bp处有一条与预期大小相同的目的带。经试剂盒回收纯化后与pMD19T载体连接,并筛选阳性重组子,经测序鉴定后用ClustalW软件与家蚕GAPDH序列比对,结果一致。该基因全长999 bp,共编码333个氨基酸(图 2-A),理论分子量为35.428 kD,等电点为8.31。在NCBI上用Blast分析发现家蚕GAPDH与部分鳞翅目昆虫的氨基酸序列一致性达到90%以上。利用MEGA5软件对不同物种模式生物的GAPDH氨基酸序列构建系统进化树,通过Neighbor Joining法重复1 000次,其他参数采用默认设置。结果(图 2-B)表明,GAPDH在不同物种中具有一定的保守性,其中家蚕与棉铃虫(Helicoverpa armigera)的氨基酸保守性最为接近,氨基酸序列一致性达到93%,黑腹果蝇(Drosophila melanogaster)和意大利蜜蜂(Apis mellifera)为83%,小家鼠(Mus musculus)为78%,人类(Homo sapiens)为77%,斑马鱼(Danio rerio)为75%。
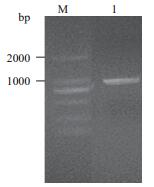
|
| 图 1 GAPDH基因的PCR产物电泳检测 M:DNA分子量标准DL2000;1:PCR产物 |

|
| 图 2 家蚕GAPDH基因的cDNA序列、氨基酸序列及不同物种GAPDH系统进化树 A:家蚕GAPDH基因的cDNA核苷酸序列及氨基酸序列; B:不同物种GAPDH系统进化树 |
测序鉴定后的GAPDH/pMD19T载体用BamH Ⅰ和EcoR Ⅰ酶切后连接到表达载体pET-28a转化感受态细胞,阳性重组子提取质粒后双酶切鉴定经电泳检测可看到大小为1 000 bp的目的基因片段(图 3)。鉴定正确的质粒经华大基因测序后用ClustalW分析表明,测序结果与家蚕GAPDH氨基酸序列一致,说明原核表达载体构建成功。
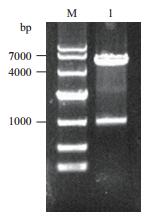
|
| 图 3 重组表达载体GAPDH/pET-28a的双酶切产物电泳检测 M:DNA分子量标准DL2000;1:双酶切产物 |
将重组质粒GAPDH/pET-28a转化大肠杆菌Rosetta感受态细胞,IPTG诱导前后的菌液样品的SDS-PAGE电泳检测结果显示,诱导后的样品中有一条明显的大小约为39 kD的条带,与融合His标签的目的蛋白分子量一致。大量诱导表达后的菌液经超声破碎、离心后,上清和沉淀通过SDS-PAGE检测,结果表明GAPDH蛋白以包涵体的形式表达。进一步用切胶回收的方式纯化包涵体中的目的蛋白,纯化后蛋白经SDS-PAGE电泳检测结果(图 4-A)显示,目的条带单一。为了验证纯化后的蛋白为带His标签的融合蛋白,利用His单抗与纯化后GAPDH融合蛋白进行Western blot杂交,杂交结果(图 4-B)显色有一条单一的条带,并与目的蛋白理论分子量一致,由此表明该蛋白为带His标签的融合目的蛋白,可作为抗原用于后续多克隆抗体制备。
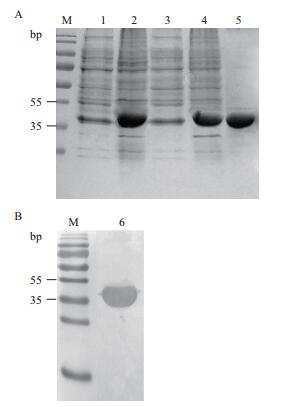
|
| 图 4 重组GAPDH诱导前后、超声前后、纯化后的SDS-PAGE电泳检测(A)及His单抗的Western blot杂交检测(B) M:蛋白质分子质量标准; 1:IPTG诱导前总蛋白; 2:IPTG诱导后总蛋白; 3:超声破碎后上清; 4:超声破碎后沉淀; 5:纯化后的GAPDH蛋白; 6:GAPDH抗原 |
在GAPDH蛋白免疫新西兰大白兔4次后,将制备的GAPDH多抗血清以不同比例稀释后作为一抗进行ELISA检测。结果如图 5所示,不同稀释比例的抗血清均可与GAPDH融合蛋白进行特异结合,由此表明GAPDH多抗血清具有较好的免疫原性。按照酶标仪检测的OD450值大于阴性对照2倍并且数值大于0.25的标准,能够检测到抗原抗体特异结合信号的最大稀释浓度为1:8 000,即GAPDH抗体的效价为1:8 000。
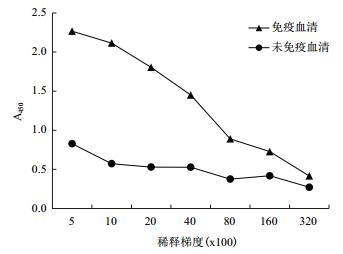
|
| 图 5 ELISA检测GAPDH多克隆抗血清的效价 |
为了进一步检测制备抗体在家蚕中的特异性,采用Western blot方法分别与家蚕幼虫(图 6-A)、家蚕雄性成虫(图 6-B)和家蚕雌性成虫(图 6-C)不同部位的总蛋白进行杂交检测。结果显示,所有样品中在分子量为35 kD处都有一清晰的条带,与GAPDH的理论分子量一致。由此表明,GAPDH抗体能特异的结合家蚕幼虫各龄期蛋白、家蚕成虫雄性与雌性不同部位的GAPDH蛋白,从而为后续研究家蚕中其他蛋白的功能奠定了基础。
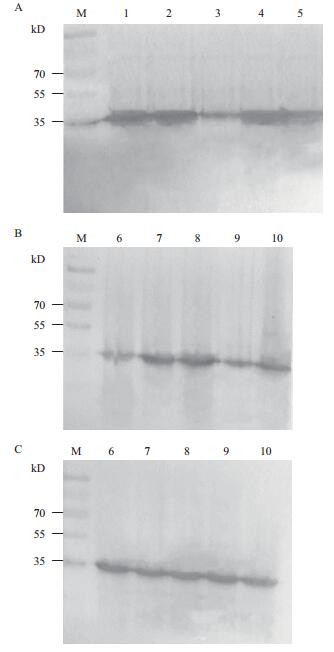
|
| 图 6 GAPDH抗体在家蚕不同龄期幼虫(A)、雄性成虫(B)和雌性成虫(C)中的Western blot杂交检测 M:蛋白质分子质量; 1:1龄; 2:2龄; 3:3龄; 4:4龄; 5:5龄; 6:头部; 7:翅; 8:足; 9:胸部; 10:腹部 |
目前,对于功能蛋白的定性和定量分析最常用的方法即Western杂交,而用于Western杂交的内参蛋白抗体的种类和来源也很多。其中国外文献报道中使用GAPDH内参的较多[4-7],对于细胞核蛋白,组蛋白H3使用较多[10, 11],而对于植物样本常用ACTIN蛋白作为内参[16-18]。市场上商品化的动物多克隆和单克隆抗体、内参抗体的抗原为同时具有蛋白特异性和种属通用性的内参蛋白部分序列,其检测种属较为广泛。如目前商品化的GAPDH、ACTIN和TUBULIN的抗体在大部分动物和部分昆虫中都具有保守性,但其在昆虫中的杂交结果不太稳定。
GAPDH是真核细胞和细菌都表达的具有关键作用的蛋白[19-20],同时作为一种多功能蛋白参与许多亚细胞水平活动,包括催化围观聚合,参与膜融合和膜转运、参与蛋白磷酸化修饰、调节蛋白表达、促进细胞凋亡、参与DNA损伤修复、作为铁蛋白受体等[21-23]。GAPDH广泛存在于众多生物体中,在细胞中含量丰富,占总蛋白的10%-20%[24]。GAPDH作为内参基因的一种,具有高度的保守性,在各种类型组织和细胞中均恒定表达。基于GAPDH的特点及其在蛋白功能研究中的作用,利用PCR技术对家蚕GAPDH基因进行克隆,并连接到pET-28a载体上,通过原核表达最终得到了GAPDH蛋白,为制备家蚕GAPDH抗体提供了前提。家蚕GAPDH基因序列全长999 bp,编码333个氨基酸,理论分子量为35 kD,等电点为8.31。将切胶回收后的GAPDH蛋白免疫纯种新西兰大白兔,获得了家蚕GAPDH的兔抗血清。ELISA检测GAPDH抗体的效价为1:8 000,Western blot检测结果显示该血清能与前期纯化的His-GAPDH融合蛋白和天然家蚕总蛋白结合,表明该血清具有较好的特异性。
GAPDH作为应用最广泛的内参抗体之一,在蛋白功能研究中仍存在障碍。目前商品化的GAPDH抗体大部分为哺乳动物来源,价格昂贵。本课题组选择同源性较高的商品化小鼠GAPDH单克隆抗体检测家蚕总蛋白,但未能与家蚕蛋白特异性的结合。因而获得GAPDH多克隆抗体是检测家蚕及鳞翅目昆虫中不同蛋白表达规律的前提条件。针对家蚕特殊的生命周期,其信号传导、蛋白合成与代谢的变化快速显著,其各组织的分化特异性高,组织之间的功能差异较大,选择合适的内参基因不仅可用于分析家蚕中基因和蛋白表达水平,也为进一步比较分析GAPDH与ACTIN和TUBULIN抗体在家蚕不同发育时期、不同组织和不同刺激条件下的稳定性和优缺点奠定了基础。
4 结论本研究从家蚕中克隆得到了GAPDH基因,构建了其原核表达载体,并在原核中成功表达并纯化了GAPDH蛋白。利用纯化的融合GAPDH蛋白作为抗原免疫新西兰大白兔,获得针对家蚕GAPDH特异性较高,并能特异结合家蚕天然蛋白的多克隆抗体。
| [1] | Sheokand N, Malhotra H, Kumar S, et al. Moonlighting cell-surface GAPDH recruits apotransferrin to effect iron egress from mammalian cells[J]. J Cell Sci, 2014, 127(Pt 19): 4279–4291. |
| [2] | Madureira P, Baptista M, Vieira M, et al. Streptococcus agalactiae GAPDH is a virulence-associated immunomodulatory protein[J]. J Immunol, 2007, 178(3): 1379–1387. DOI:10.4049/jimmunol.178.3.1379 |
| [3] | 张然然, 刘华淼, 邢秀梅, 等. 鹿茸组织中内参基因的筛选和验证[J]. 中国畜牧兽医, 2015, 42(4): 883–889. |
| [4] | Wang H, Zhang X, Liu Q, et al. Selection and evaluation of new reference genes for RT-qPCR analysis in epinephelus akaara based on transcriptome data[J]. PLoS One, 2017, 12(2): e0171646. DOI:10.1371/journal.pone.0171646 |
| [5] | Delunardo F, Soldati D, Bellisario V, et al. Anti-GAPDH autoantibodies as a pathogenic determinant and potential biomarker of neuropsychiatric diseases[J]. Arthritis Rheumatol, 2016, 68(11): 2708–2716. DOI:10.1002/art.v68.11 |
| [6] | Zhu Y, Yang C, Weng M, et al. Identification of TMEM208 and PQLC2 as reference genes for normalizing mRNA expression in colorectal cancer treated with aspirin[J]. Oncotarget, 2017. DOI:10.18632/oncotarget.15191 |
| [7] | Wan G, Yang K, Lim Q, et al. Identification and validation of reference genes for expression studies in a rat model of neuropathic pain[J]. Biochem Biophys Res Commun, 2010, 400(4): 575–580. DOI:10.1016/j.bbrc.2010.08.106 |
| [8] | Volland M, Blasco J, Hampel M. Validation of reference genes for RT-qPCR in marine bivalve ecotoxicology:Systematic review and case study using copper treated primary Ruditapes philippinarum hemocytes[J]. Aquat Toxicol, 2017, 185: 86–94. DOI:10.1016/j.aquatox.2017.01.003 |
| [9] | Zalis MC, Johansson S, Englund-Johansson U. Immunocytochemical profiling of cultured mouse primary retinal cells[J]. J Histochem Cytochem, 2017. DOI:10.1369/0022155416689675 |
| [10] | Xu J, Lu MX, Cui YD, et al. Selection and evaluation of reference genes for expression analysis using qRT-PCR in Chilo suppressalis(Lepidoptera:Pyralidae)[J]. J Econ Entomol, 2017. DOI:10.1093/jee/tow297 |
| [11] | Li J, Jia H, Han X, et al. Selection of Reliable Reference Genes for gene expression analysis under abiotic stresses in the desert biomass willow, Salix psammophila[J]. Front Plant Sci, 2016, 7: 1505. |
| [12] | Xiao Z, Sun X, Liu X, et al. Selection of reliable reference genes for gene expression studies on Rhododendron molle G.Don[J]. Front Plant Sci, 2016, 7: 1547. |
| [13] | Wang Y, Shan Q, Meng Y, et al. Mrpl10 and Tbp are suitable reference genes for peripheral nerve crush injury[J]. Int J Mol Sci, 2017, 18(2). DOI:10.3390/ijms18020263 |
| [14] | Chi C, Shen Y, Yin L, et al. Selection and validation of reference genes for gene expression analysis in vigna angularis using quantitative real-time RT-PCR[J]. PLoS One, 2016, 11(12): e0168479. DOI:10.1371/journal.pone.0168479 |
| [15] | 于在江, 马学恩, 周建华. 切胶纯化表达蛋白包涵体的可行性分析[J]. 生物技术, 2007, 17(3): 46–48. |
| [16] | Auler PA, Benitez LC, do Amaral MN, et al. Evaluation of stability and validation of reference genes for RT-qPCR expression studies in rice plants under water deficit[J]. J Appl Genet, 2017, 58(2): 163–177. DOI:10.1007/s13353-016-0374-1 |
| [17] | Zhang MF, Liu Q, Jia GX. Reference gene selection for gene expression studies in lily using quantitative real-time PCR[J]. Genet Mol Res, 2016, 15(2). DOI:10.4238/gmr.15027982 |
| [18] | FerradásY, ReyL, MartínezÓ, 等. Identification and validation of reference genes for accurate normalization of real-time quantitative PCR data in kiwifruit[J]. Plant Physiol Biochem, 2016, 102: 27–36. |
| [19] | Han-Saem C, Sang WS, Young MK, et al. Engineering glyceraldehyde-3-phosphate dehydrogenase for switching control of glycolysis in Escherichia coli[J]. Biotechnol Bioeng, 2012, 109(10): 2612–2619. DOI:10.1002/bit.v109.10 |
| [20] | Centeno-Leija S, Utrilla J, Flores N, et al. Metabolic and transcriptional response of Escherichia coli with a NADP+-dependent glyceraldehydes 3-phosphate dehydrogease from Streptococcus mutans[J]. Antonie Van Leeuwenhoek, 2013, 104(6): 913–924. DOI:10.1007/s10482-013-0010-6 |
| [21] | Hara MR, Agrawal N, Kim SF, et al. Snitrosylated GAPDH initiates apoptotic cell death by nuclear translocation following Siahl biding[J]. Nat Cell Biol, 2005, 7(7): 665–674. DOI:10.1038/ncb1268 |
| [22] | 付国良, 黄晓红. 甘油醛-3-磷酸脱氢酶功能的研究进展[J]. 生物物理学报, 2013, 29(3): 181–191. |
| [23] | Jacquin MA, Chiche J, Zunino B, et al. GAPDH binds to active Akt, leading to Bcl-xL increase and escape from caspase independent cell death[J]. Cell Deach Differ, 2013, 20(8): 1043–1054. DOI:10.1038/cdd.2013.32 |
| [24] | 李洁, 谢文光, 沈倍奋, 等. GAPDH功能多样性研究进展[J]. 军事医学科学院刊, 2006, 30(5): 483–486. |





