水体的富营养化已成为世界各地水污染治理中普遍遇到的环境问题,而因此产生的藻类过度繁殖进而引起水华是导致水环境恶化的关键因子之一[1]。除了造成水体生物化学性质发生改变和水体功能下降之外,部分藻类还会向水体释放的有毒次生代谢物质,严重危害到人类和动物的健康[2]。如何控制和消除富营养化水体中有害藻类的暴发性增长是生态学和环境科学领域的重要研究课题。
与化学和物理控藻方法相比,生物控藻技术具有成本低、持续周期长等特点,近年来成为研究的热点[3],已有大量研究表明采用溶藻细菌、水生植物分泌的化感物质、食藻微小动物和鱼类等生物控制技术防治藻类爆发,都具有较好的效果[4]。但综合现有的研究报道来看,筛选得到的溶藻生物除藻能力低、生长速度慢、治理成本高等缺点仍然是制约生物除藻的关键因素[5],而枯草芽孢杆菌由于具备菌体密度高、培养及运输方便等优点,在水体污染治理方面具有巨大的应用潜力[6]。本研究以铜绿微囊藻(Microcystis aeruginosa)和小球藻(Chlorella)为目标藻体,筛选对其具有较好抑制作用的枯草芽孢杆菌,并对其生长特性和溶藻方式进行研究,以期为富营养化水体处理及生物控藻提供参考。
1 材料与方法 1.1 材料 1.1.1 菌种枯草芽孢杆菌(Bacillus subtilis)、铜绿微囊藻(Microcystis aeruginosa)及小球藻(Chlorella)均为课题组自行保存。
1.1.2 培养基枯草芽孢杆菌培养基采用LB固体培养基[7],115℃灭菌25 min; 藻种培养采用BG11培养基[8],115℃灭菌25 min。
1.2 方法 1.2.1 溶藻菌的筛选将铜绿微囊藻及小球藻菌种接至BG11培养基,课题组自行保存的枯草芽孢杆菌采用LB培养基活化8 h(菌细胞浓度大约为1.0×108 cells/mL)后按1:9的比例接入BG11培养基,28℃,光照4.8±0.2 klx(日光灯源)培养,同时设空白对照,培养4 d后分别测定叶绿素a浓度和藻体蛋白含量,计算溶藻菌对叶绿素a及藻体蛋白合成的抑制率。叶绿素a测定采用丙酮提取法,具体测定及计算方法见参考文献[9]。蛋白质含量测定参照文献[5]进行,略有改动。培养4 d后,分别取培养液2 000 r/min离心10 min,用无菌水进行洗涤,重复上述操作4次,最终获得藻泥,然后用细胞破碎仪对藻泥进行细胞破碎,破碎液在4℃下10 000 r/min离心15 min,收集上清液,采用紫外线测定其中蛋白质浓度,测定波长为280 nm和260 nm,蛋白质含量(g/L)计算公式如下:蛋白质含量(g/L)=1.55×OD280-0.76×OD260。
1.2.2 菌株及共培养生长曲线测定将保存在固体培养基上的5#菌株接种到装有15 mL灭菌LB液体培养基试管中,经过8 h培养活化后用无菌移液枪按1.0%的接种量接种到装有100 mL LB液体培养基的三角瓶中,于28℃,150 r/min进行振荡培养,定时取样,在721分光光度计上测OD600值。共培养生长曲线方法如下:将生长对数期的5#菌培养液(菌细胞浓度大约为1.0×108 cells/mL),按体积比1﹕9加入到藻培养液中进行共培养。菌藻共培养条件为28℃,光照4.8±0.2 klx(日光灯源),每隔48 h取藻菌培养液,对细胞进行计数,计数方法采用直接计数法,以藻单独培养液做对照。藻细胞计数参照文献进行,将藻培养液用力振荡混匀,然后于无菌操作台取1 mL加入到2.5 mL EP管中,再加入1滴KI-I2溶液,染色15 min。每个样品设3个平行,将染色后液体滴入藻细胞计数板,于光学显微镜(100×)观察并计数,每样计数10次,计算平均数。
1.2.3 环境条件对溶藻菌生长的影响设置不同温度、pH值及盐度条件研究5#菌株对环境条件的耐受能力。采用LB液体培养基于28℃、150 r/min条件下进行振荡培养,24 h后测定发酵液OD600值。
1.2.4 铵及磷酸盐对溶藻菌生长的影响向基础LB培养基中添加不同浓度的NH4Cl及KH2PO4,28℃,150 r/min进行振荡培养,24 h后测定发酵液OD600值。
1.2.5 丙二醛(MDA)、谷胱甘肽(GSH)含量及相关酶活测定藻细胞裂解液的制备同1.2.1。各种物质含量及酶活测定均采用南京建成生物工程公司生产的测定试剂盒进行,方法参照说明书。
1.2.6 统计分析除特别说明外,每个试验均设置3个对照。数据处理及绘图采用ORIGIN 8.1进行。
2 结果 2.1 枯草芽孢杆菌对藻叶绿素a及藻体蛋白合成的抑制以课题组保存的5株枯草芽孢杆菌为筛选对象,研究其生长性能及其对两种藻类叶绿素a及藻体蛋白合成的抑制效果,结果(图 1) 显示,5株枯草芽孢杆菌对两种藻类都具有一定的抑制效果,其中以对铜绿微囊藻的抑制效果较好。5#菌株对两种藻类叶绿素a的抑制率最高,而1#和5#菌株对两种藻类蛋白抑制率最佳。从生长能力来看,2#菌株的生长速度最快,24 h后OD600可达2.8以上,而5#和1#菌株的生长能力次之。综上,选择枯草芽孢杆菌5#作为代表菌株来进行后续研究。
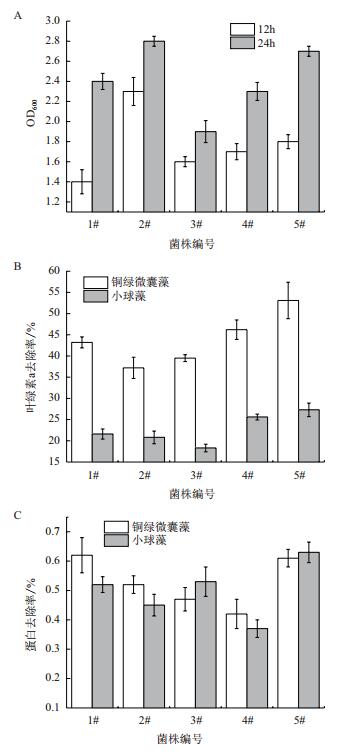
|
| 图 1 不同菌株的生长能力(A)及其对叶绿素a(B)及藻体蛋白(C)的去除率 |
分别研究了5#菌株的生长曲线及其对藻类生长的影响,结果如图 2所示。从图 2-A可以看出,5#菌株的迟缓期较短,而对数增长期繁殖速度较快,当培养到15 h左右时,5#菌株的生长量达到最大,经平板计数其最大生物量可达1.0×1010 cells/mL以上,随培养时间延长菌体生物量略有降低。从图 2-B中可以看出,5#菌株与两种藻类共培养过程中,铜绿微囊藻和小球藻的生长均受到一定的抑制,其中以铜绿微囊藻所受影响最为显著。
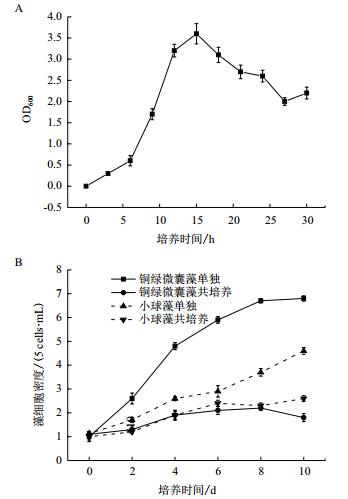
|
| 图 2 5#菌株的生长曲线(A)及其对藻类生长的影响(B) |
5#菌株在不同温度、pH及NaCl浓度条件下的生长情况(图 3) 显示,其在低温条件下生长会受到一定的抑制,而在30-37℃条件下生长最为良好。从酸碱适应情况来看,该菌株在中性条件下生长最为良好,过酸或过碱的条件均会对其生长造成不利影响,而高浓度的盐也会对其生长造成不利的影响。
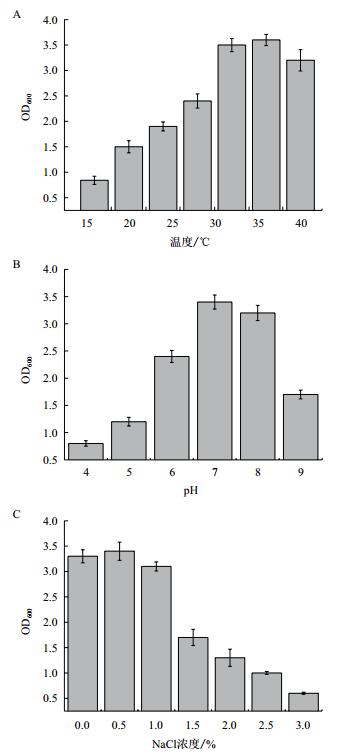
|
| 图 3 温度(A)、pH(B)及NaCl浓度(C)对5#菌株生长的影响 |
从图 4的结果可以看出,在基础培养基基础上适当增加氮、磷的含量,能够提高5#菌株的生长能力,但当营养物质继续升高时,菌体的生长能力受到一定的抑制。
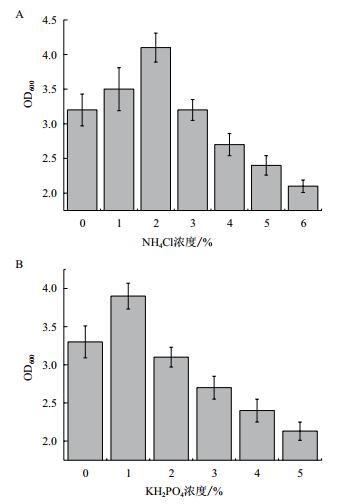
|
| 图 4 NH4+(A)及PO43-(B)对5#菌株生长的影响 |
不同处理条件下的发酵液对藻类生长的抑制效果(图 5) 可以看出,去除发酵液后重新悬浮的单一细胞对于铜绿微囊藻和小球藻只有很小的抑制能力,而无菌滤液的抑制能力则高达60%以上,与未过滤的原菌株菌液的溶藻活性相当,这表明菌株的溶藻活性主要来源于发酵后的滤液,并不需要细菌细胞与藻细胞直接接触,即菌株对于藻类的抑制效应并不是通过直接溶藻方式,而是通过产生溶藻活性物质到滤液中以间接溶藻方式实现的。

|
| 图 5 菌株5#对藻类生长的影响 |
选择铜绿微囊藻为目标藻种,研究在细菌溶藻过程中细胞的抗氧化系统(MDA、GSH、SOD和CAT)含量(活性)的变化,结果如图 6所示。加入溶藻细菌后,铜绿微囊藻的MDA含量从第1天便开始上升,这可能与此时藻细胞膜结构受到严重损伤有关,而对照组MDA的测定值一直维持在较低水平,说明其脂膜过氧化水平很低。而GSH含量、SOD及CAT活性的变化也有类似的趋势。说明加入溶藻细菌后,藻细胞受到氧化胁迫,其抗氧化系统启动以保护自身细胞不受损害。
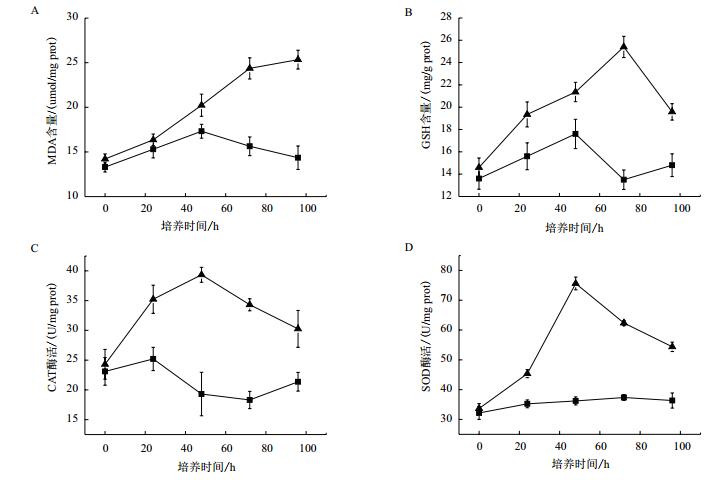
|
| 图 6 菌株5#对铜绿微囊藻MDA(A)、GSH(B)含量及CAT(C)、SOD(D)活性的影响 |
工农业和生活污染排放等因素所导致的水体富营养化和浮游藻类污染目前有日益加剧的趋势[10],目前已引起研究人员的广泛关注[11]。通过溶藻病毒、溶藻细菌、溶藻真菌、放线菌等微生物来控制藻体的水华已成为近年来研究的热点,其中最为常见的是利用溶藻细菌的作用来抑制藻类生长[12]。恶臭假单胞菌(Pseudomonas putida)[13]、荧光假单胞菌(Pseudomonas. fluorescens)、噬胞菌(Cytophaga)等微生物均对藻类有一定抑制作用[14],但这些从水体等环境中直接筛选得到的微生物虽然有较好的溶藻特性,但普遍存在生长速度缓慢、环境适应性差等缺点,且部分菌株为条件致病菌,在水体治理领域容易造成二次污染,不能大规模使用。枯草芽孢杆菌在自然界广泛存在,具有生产成本低、生长速度快、易形成芽孢方便运输等优点,在水质净化、动物饲料添加等方面有广泛的应用。尤为重要的是,枯草芽孢杆菌具有良好的生物安全性,不会造成环境的二次污染,因此我国《饲料添加剂品种目录(2013)》及美国食品药品监督管理局《可直接饲用微生物目录(1989)》中均将其列入其中[15]。本研究以课题组保存的枯草芽孢杆菌为筛选对象,不仅考虑其溶藻特性,同时兼顾生物安全性和应用潜力。
目前利用微生物进行藻类控制的研究可以分为两大类型,一是利用微生物的次级代谢产物抑制藻类生长,目前已有较多报道[16]。张化俊等[14]发现溶藻细菌BS01所产得二异丁氧基苯基胺能够通过引起藻细胞内部氧化损伤的方式引起藻细胞的死亡,同时该化合物仅针对少数几种藻类具有杀藻效果,在赤潮的治理方面具有较好的应用前景; 孔赟等[17]发现橄榄网状链霉菌SG-001的活性物质能够强烈抑制铜绿微囊藻的生长,但对小球藻的生长具有明显的促进作用; Sakata等[18]从日本海域中分离得到1株Pseudomonas sp. C55a-2,对角毛藻、海洋卡盾藻等藻类均具有较好的抑制作用,经过鉴定其主要活性成分为2,3-二氢吲哚二酮(2,3-indolinedione)。另外一类则是研究直接添加菌体对藻类的抑制效果[19, 20]。从使用的角度来说,直接施用发酵菌体显然成本更低,更具备规模化使用的潜力。
枯草芽孢杆菌在藻类控制等领域的研究尚处于起步阶段[21-24],本研究所得菌株不仅具有较好的抑制藻类生长特性,同时在温度、pH及盐浓度等方面具有较好的环境适应性,特别是在中温(30-37℃)、pH接近中性的水体中生长性能最为良好,可以考虑以直投式菌剂的形式应用于富营养化的水体,具备一定的开发的潜力。
4 结论本实验筛选得到一株对铜绿微囊藻和小球藻均具有较好抑制作用的枯草芽孢杆菌,其代谢产物对两种藻类均有较好的抑制作用,且菌株具有较好的环境适应性。将枯草芽孢杆菌与铜绿微囊藻共培养后,可引起藻体抗氧化系统的应激反应。
| [1] | Torres MA, Barros MP, et al. Biochemical biomarkers in algae and marine pollution:a review[J]. Ecotoxicol Environ Saf, 2008, 71(1): 1–15. DOI:10.1016/j.ecoenv.2008.05.009 |
| [2] | 张翀, 赵亮, 张莹, 等. 藻类爆发危害及其控制技术研究进展[J]. 环境保护科学, 2015, 3: 107–112. DOI:10.3969/j.issn.1004-6216.2015.03.026 |
| [3] | Zhang H, Lv J, et al. Cell death in a harmful algal bloom causing species Alexandrium tamarense upon an algicidal bacterium induct-ion[J]. Appl Microbiol Biotechnol, 2014, 98(18): 7949–7958. DOI:10.1007/s00253-014-5886-1 |
| [4] | 王红强, 李宝宏, 张东令, 等. 藻类的生物控制技术研究进展[J]. 安全与环境工程, 2013, 20(5): 38–41. |
| [5] | 陆洪省, 刘文君, 张瑶, 等. 溶藻菌R1的分离鉴定以及对栅藻共处代谢的影响[J]. 微生物学通报, 2016, 43(3): 495–503. |
| [6] | 张睿, 王广军, 李志斐, 等. 枯草芽孢杆菌对铜绿微囊藻抑制效果的研究[J]. 中国环境科学, 2015, 35(6): 1814–1821. |
| [7] | 周德庆. 微生物学实验教程[M]. 第3版. 北京: 高等教育出版社, 2013. |
| [8] | Mu RM, Fan ZQ, Pei HY, et al. Isolation and algae-lysing characteri-stics of the algicidal bacterium B5[J]. J Environ Sci, 2007, 19(11): 1336–1340. DOI:10.1016/S1001-0742(07)60218-6 |
| [9] | 李文利, 刘征宇, 等. 蜡样芽孢杆菌培养条件的优化及其溶藻方式的研究[J]. 环境污染与防治, 2016, 38(8): 20–24. |
| [10] | Cong-Cong YU, Chen WU, et al. Pollutions by algae and microcys-tins in surface water in Shenqiu County in Huaihe River basin[J]. Journal of Environment & Health, 2013, 30(11): 967–971. |
| [11] | Hettiarachchi IU, et al. Contamination status of algae toxins microc-ystins in some selected water bodies in sri lanka[C]. Proceedings of International Forestry & Environment Symposium, 2014. |
| [12] | 倪兆林, 申元英. 溶藻微生物净化富营养化水体的作用[J]. 微生物学通报, 2014, 41(1): 156–160. |
| [13] | Shim H, Yang ST. A continuous fibrous-bed bioreactor for BTEX biodegradation by a co-culture of Pseudomonas putida and Pseudomonas fluorescens[J]. Advances in Environmental Research, 2002, 7(1): 203–216. DOI:10.1016/S1093-0191(01)00132-0 |
| [14] | 张化俊, 等. 溶藻细菌BS01产二异丁氧基苯基对塔玛亚历山大藻生长的影响[J]. 微生物学报, 2015, 55(7): 834–842. |
| [15] | 张新雄, 彭锋, 毛光平, 等. 饲用芽孢杆菌研究与应用进展[J]. 应用与环境生物学报, 2013, 19(5): 891–897. |
| [16] | Zhang Y, Xi Y, Wu G. Advances on algicidal substances produced by algicidal bacteria[J]. Microbiology, 2004, 31(1): 127–131. |
| [17] | 孔赟, 缪礼鸿, 等. 溶藻放线菌对铜绿微囊藻和小球藻竞争生长的影响[J]. 生态环境学报, 2010, 19(11): 2657–2662. DOI:10.3969/j.issn.1674-5906.2010.11.024 |
| [18] | Sakata T, Yoshikawa T, et al. Algicidal activity and identification of an algicidal substance produced by marine Pseudomonas sp. C55a-2[J]. Fisheries Science, 2011, 77(3): 397–402. DOI:10.1007/s12562-011-0345-8 |
| [19] | 刘征宇, 宁喜斌, 等. 3株太湖溶藻细菌的分离及溶藻特性的初步研究[J]. 食品与发酵工业, 2016, 42(2): 59–64. |
| [20] | 马迪迪, 赵耕毛, 等. 2株溶藻菌培养条件优化及溶藻特性研究[J]. 烟台大学学报:自然科学与工程版, 2015, 1: 24–29. |
| [21] | Kim HS, Ahn CY, Joung SH, et al. Growth inhibition of Microcystis aeruginosa by a glycolipid-type compound from Bacillus subtilis C1[J]. J Microbiol Biotechnol, 2010, 20(8): 1240–1242. DOI:10.4014/jmb |
| [22] | Gumbo JR, Cloete TE, Zyl GJJV, et al. The viability assessment of Microcystis aeruginosa cells after co-culturing with Bacillus mycoides B16 using flow cytometry[J]. Physics & Chemistry of the Earth Parts A/b/c, 2014, 72. |
| [23] | Guan C, Guo X, et al. Novel algicidal evidence of a bacterium Baci-llus sp. LP-10 killing Phaeocystis globosa, a harmful algal bloom causing species[J]. Biological Control, 2014, 76(3): 79–86. |
| [24] | Zhao L, Chen L, Yin P. Algicidal metabolites produced by Bacillus sp. strain B1 against Phaeocystis globosa[J]. Journal of Industrial Microbiology, 2014, 41(3): 593–599. DOI:10.1007/s10295-013-1393-0 |




