沾化冬枣是黄河三角洲地区特晚熟鲜食果品,自推广种植给广大枣农带来了巨大的经济利益,目前种植面积已达30余万hm2,年产量近3.5亿kg。但随着冬枣栽培面积的迅速增加,冬枣病害的发生愈来愈重,其中冬枣轮纹病是冬枣采摘季节较为常见并危害严重的真菌病害。冬枣轮纹病不仅直接造成冬枣产量下降与品质降低,而且病原真菌可产生对人体有害的代谢物,对人们的健康构成极大威胁[1]。目前,对冬枣轮纹病的防治主要是喷洒化学农药多菌灵和退菌特[2],化学农药具有诱导抗药性、农药残留、环境污染等缺点[3],严重制约了沾化冬枣的可持续发展。放线菌是一类具有重要经济价值的微生物资源,是抗生素、酶制剂和免疫调节剂等多种生物活性物质的主要生产者,目前农业和临床使用的抗生素有四分之三是由放线菌生产的[4]。利用放线菌产生的活性物质制备的生物农药,因其具有高效、低毒无污染、不易使有害生物产生抗药性等特点,已成为未来农药的发展方向[5]。
冬枣轮纹病生物防治相关工作开始的较晚,冬枣轮纹病的病原菌于2005年才被分离鉴定[1]。近年来,马海玲,刘俊华等[6, 7]对苔藓植物水浸提液对冬枣轮纹病病菌的抑菌效果进行了初步研究,而在拮抗微生物方面鲜有报道[8]。随着放线菌研究工作的广泛开展,新放线菌的发现越来越难,大量放线菌和活性代谢产物被多次重复发现和描述[9, 10],这也成为新型放线菌药物开发的瓶颈。为了破解这些难题,一些学者提出“新来源,新菌种,新基因,新产物,新用途”的概念,建议从新环境来获得新菌种,发现新的活性物质[11, 12]。
黄河三角洲贝壳堤位于山东省滨州市无棣县、沾化县境内,与美国圣路易斯安娜州和南美苏里南的贝壳堤并称为世界三大古贝壳堤,是典型且特殊的海岸带生态系统类型[13]。特殊的生境为我们发现放线菌新物种,进而开发新型微生物源农药提供了良好的资源。本研究旨在从贝壳堤贝沙沉积物中筛选出高效的生防菌,并对其抑菌效果进行研究,以期为冬枣轮纹病的生物防治及微生物源农药的研发提供基础材料。
1 材料和方法 1.1 材料 1.1.1 供试土样贝砂土样采自贝壳堤汪子岛(经度:117°52-56″,纬度:38°14' 30″),采样区域在向海侧,样品采集深度为5-30 cm,共采集土样20份,置于4℃备用。
1.1.2 供试菌株供试菌为冬枣轮纹病病原真菌,本实验室分离保存。
1.1.3 供试菌培养基病原真菌培养用PDA培养基(马铃薯200 g; 葡萄糖20 g; 琼脂15 g; 水1 000 mL; pH自然); 放线菌分离采用高氏一号培养基(可溶性淀粉20 g; KNO3 1 g; K2HPO4 0.5 g; MgSO4·7H2O 0.5 g; NaCl 0.5 g; FeSO4·7H2O 0.01 g; 琼脂20 g; 水1 000 mL; pH 7.2-7.4)。分离放线菌时,培养基加入重铬酸钾,终浓度为100 μg/mL; 查氏培养基、马铃薯葡萄糖培养基、ISP2(酵母-麦芽膏琼脂)培养基、ISP4(无机盐淀粉琼脂)培养基、ISP6(蛋白胨酵母-铁琼脂)培养基、ISP6(蛋白胨酵母-铁琼脂)培养基,以及高氏一号培养基用于放线菌培养特征观察,配制方法参照文献[14]进行。
1.1.4 供试品种供试冬枣为沾化冬枣一代,购自滨州市沾化县。
1.2 方法 1.2.1 拮抗菌的分离筛选土样100℃干热预处理1 h,用无菌水适当稀释后,涂布于高氏一号平板,28℃恒温培养1-3周。培养获得的放线菌根据菌落形态和颜色进行分类和编号,并经反复划线进行纯化。将得到的纯培养物接种于斜面培养基上,置于4℃冰箱中保存。菌株对冬枣轮纹病菌的抑制作用采用对峙培养法:打孔法在PDA平板中央接种直径为5 mm的真菌菌块,将分离纯化的放线菌在高氏一号培养基上培养5 d后,打孔法接于指示菌四周,28℃恒温培养5-8 d后,观察抑菌情况。
1.2.2 菌株BK的分类鉴定 1.2.2.1 形态和培养特征采用盖玻片插片法培养,将放线菌划线接种高氏一号琼脂培养基,28℃培养7 d,观察并记录培养菌落特征。取盖玻片插片用普通光学显微镜高倍镜观察菌丝体形态。将菌株BK分别接种到查氏、马铃薯葡萄糖、ISP2、ISP4、ISP6、ISP6,以及高氏一号培养基上,28℃培养,分别在7、15、30 d观察记录基内菌丝、气生菌丝和可溶性色素的颜色变化。
1.2.2.2 生理生化特征参照《放线菌快速鉴定与系统分类》中的方法进行[15]。
1.2.2.3 16S rRNA序列分析及系统发育树构建将菌株BK接种于高氏一号培养基,120 r/min,28℃震荡培养36 h,离心收集菌体,悬浮后加入溶菌酶和SDS破壁,采用酚-氯仿法提取基因组DNA,用正向引物27F(5'-GAGAGTTTGATCCTG GCTCAG-3' ),和反向引物1541R(5' '-AAGG AGGTGATCCAGCC-3' ),对其16S rRNA基因进行PCR扩增。采用25 μL PCR反应体系:2.5 mmol/ L dNTPs 1 μL、10 μmol /L上游引物1 μL、10 μmol /L下游引物1 μL、Taq plus DNA聚合酶3 U、1 0× PCR buffer 2.5 μL、模板DNA 0.5 μg。反应条件为:94℃ 5 min,94℃ 30 s,55℃ 30 s,72℃ 1 min,共30个循环,最后72℃延伸10 min。将扩增的产物由北京三博公司进行测序。将获得的16S rRNA序列在网站http://eztaxon-e.ezbiocloud.net中进行比对分析,然后利用MAGE 5.0软件,采用Neighbor-Joining法构建系统进化树,确定菌株BK的分类地位。
1.2.3 菌株BK的抑菌和防治效果 1.2.3.1 发酵滤液对冬枣轮纹病菌丝生长的影响用接种针挑取在高氏一号培养基上活化培养3 d的菌株BK,接种到含15 mL种子培养液的试管中,在28℃培养4 d,按8%的接种量接种到内装100 mL培养基的250 mL三角烧瓶中,200 r/min 28℃振荡培养7 d,菌悬液10 000 r/min、4℃条件下离心20 min,上清用0.22 μm的微孔滤膜过滤,得到发酵滤液4℃保存备用。采用含毒介质法测定菌株BK对菌丝生长的抑制作用:分别配制20 mL含菌株BK发酵滤液的PDA平板[16],用打孔器取直径为5 mm的病原真菌菌丝块,移入平板中心处,28℃培养5-7 d测量菌丝生长直径(mm),计算抑菌率。以无菌发酵液和蒸馏水为对照。发酵液分别稀释5倍、10倍、20倍、50倍和100倍,每个处理重复3次。抑菌率=[(对照菌落直径-试验处理菌落直径)/对照菌落直径]×100%
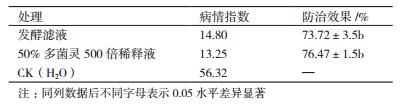
1.2.3.2 BK对冬枣离体果实的防效测定参考文献[17]中的方法,选择健康、大小且成熟度接近的冬枣果实,用蒸馏水洗干净,待果面稍干后在果实上刺一伤口并接种冬枣轮纹病菌孢子悬液(浓度为1×108 CFU/mL),于24 h后喷施菌株BK发酵液、50 %多菌灵500倍液,另设喷无菌水为对照。每个处理15个果实,3次重复在25℃保温、保湿贮藏,5 d后调查病情指数,计算防治效果。
1.2.4 数据分析试验数据采用SAS 9.1统计分析软件进行方差分析,并用Duncan氏新复极差法检验差异显著性(P < 0.05)。
2 结果 2.1 放线菌的分离与筛选结果共分离到198株放线菌,经平板初筛获得对冬枣轮纹病菌有拮抗作用的放线菌8株(图 1),根据抑菌作用的大小,选择拮抗性最强的一株菌作为本实验的目的高效菌株,命名为BK(图 2)。经测定,菌株BK遗传稳定性好,传代培养6次后,抑菌作用无明显变化。因此,选定菌株BK作为进一步研究对象。
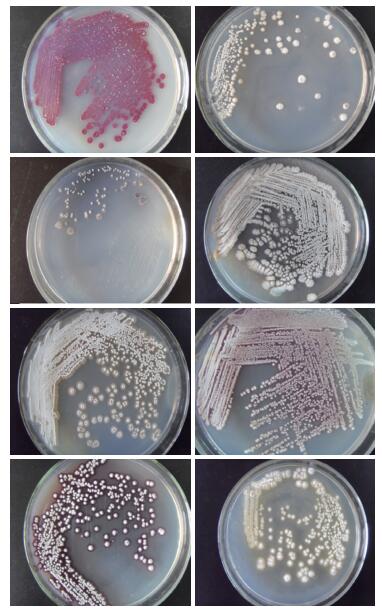
|
| 图 1 8株对冬枣轮纹病菌有拮抗作用的放线菌的菌落照片 |
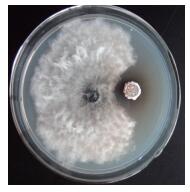
|
| 图 2 菌株BK对冬枣轮纹病菌的抑制作用 |
菌株BK发酵滤液对冬枣轮纹病菌菌丝生长具有较强的抑制作用,5倍稀释液的发酵滤液可完全抑制冬枣轮纹病菌丝生长。随着发酵滤液浓度的降低对冬枣轮纹病菌菌丝生长抑制率逐渐降低,但下降不剧烈。稀释10、20、50和100倍时的抑制率分别为72.3%、61.7%、47.2%和39.3%。无菌发酵液与蒸馏水对照一致,对菌丝生长没有抑制作用(表 1)。说明放线菌菌株BK分泌在发酵液中的代谢产物质具有较高的抑菌活性。
结果(表 2) 表明,24 h后接种处理的冬枣轮纹病的病情指数为14.80,防效为73.72%,与50 %多菌灵500倍液的防治效果差异性不显著,说明菌株BK的发酵液对离体冬枣果实轮纹病具有一定的防治效果。
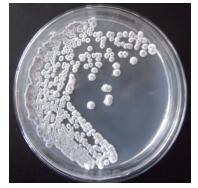
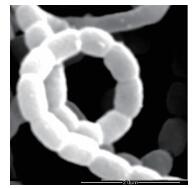
结果(图 3) 表明,菌株BK为革兰氏阳性菌,在高氏一号培养基平板上培养7 d的菌落直径4-6 mm,表面致密、干燥、多皱、不易挑起。菌丝细长,分枝多,孢子呈椭圆形表面光滑,孢子丝呈螺旋形(图 4)。菌株BK在大多数培养基上不产生可溶性色素,气生菌丝白色或灰白色,基内菌丝无色、浅黄色或褐色。
|
| 图 3 菌株BK的菌落形态(高氏一号培养基28℃培养7 d) |
|
| 图 4 菌株BK的孢子形态 |
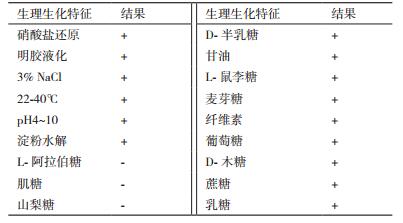
菌株BK生长温度22-40℃,pH4-10,NaCl耐受性1%-3%。硝酸盐还原、淀粉水解试验、纤维素水解试验、明胶液化实验均为阳性,不凝固但胨化牛奶,能够利用D-半乳糖、甘油、L-鼠李糖、麦芽糖、葡萄糖、D-木糖、蔗糖、乳糖,不能利用山梨糖、肌糖、L-阿拉伯糖。
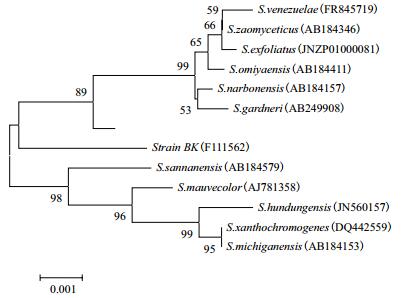
2.3.2 BK的16S rRNA分析BK的16S rRNA基因序列长度为1 406 bp,在GenBank中的登录号为KF111562,比对结果(图 5) 显示与其同源性较高的菌株均属于链霉菌属,选取其中的12株模式菌株,构建系统进化树,菌株BK与绛红北里孢菌(Streptomyces purpureus)NBRC 13927T(AB184547) 亲缘关系最近,16S rRNA基因序列相似性为99.15%。因此,结合培养特征和生理生化特性(表 3) 初步鉴定BK菌株为绛红北里孢菌(S.purpureus)。
|
| 图 5 放线菌BK的16S rRNA基因序列系统发育树 |
贝壳堤是典型而又特殊的海岸带类型,目前,针对黄河三角洲贝壳堤海岸生态系统的研究主要集中在贝壳堤的发育演变[18]、土壤理化特征[19]和植被多样性和生物区系等方面[20],有关微生物多样性的报道甚少[21]。本研究共分离到198株放线菌,其中对冬枣轮纹病菌有拮抗作用的放线菌8株,这说明贝壳堤放线菌资源丰富,值得进一步发掘。本研究分离筛选的菌株BK经鉴定为苯胺紫链霉菌,对冬枣轮纹病菌抑制作用较强,其发酵滤液5倍稀释液对冬枣轮纹病的抑制效果与50%多菌灵可湿性粉剂500倍稀释液相当。因此,菌株BK具有的防治冬枣轮纹病生防潜力,有进一步开发应用的价值。
菌株BK分离自贝壳堤岛,特殊的生态环境可能会赋予其特殊的代谢途径,进而获得新颖的活性代谢产物,初步研究表明,菌株BK产生的抗真菌活性成分为脂肽类物质(待发表),下一步我们将对菌株BK活性代谢产物的结构及其抑菌作用机理开展研究,期望BK能在防治冬枣轮纹病方面发挥积极作用。另外,我们目前通过DGGE、宏基因组学等免培养方法对该区域的放线菌资源作进一步研究,以期更全面地阐明该地区土壤放线菌的多样性,获得更多具有生物活性的放线菌新种。
4 结论本研究从黄河三角洲贝壳堤贝沙土样中分离了198株放线菌,从中筛选出1株对冬枣轮纹病具有极强拮抗作用的放线菌菌株BK,经鉴定菌株BK为苯胺紫链霉菌Streptomyces purpureus。菌株BK对冬枣轮纹病菌菌丝生长和离体冬枣果实轮纹病都有很好的抑制效果,是一株较为理想的拮抗菌,在冬枣轮纹病生物防治方面有很好的应用前景。
| [1] | 季延平, 吴玉柱, 刘慇, 等. 冬枣轮纹病病原菌的研究[J]. 山东林业科技, 2005, 157(2): 22–24. |
| [2] | 靳雅君, 张泽勇. 冬枣轮纹病的发生与防治[J]. 北京农业, 2006, 9: 31. DOI:10.3969/j.issn.1000-6966.2006.01.043 |
| [3] | 任迁琪, 吴洪生, 李季, 等. 西瓜枯萎病拮抗链霉菌分离鉴定及盆栽抗病试验[J]. 生物技术通报, 2016, 32(9): 107–113. |
| [4] | 姜怡, 徐平, 娄恺, 徐丽华, 等. 放线菌药物资源开发面临的问题与对策[J]. 微生物学通报, 2008, 35(2): 272–274. |
| [5] | 周启, 王道本. 农用抗生素和微生物杀虫剂[M]. 北京: 农业出版社, 1995. |
| [6] | 马海玲, 刘俊华. 褐黄水灰藓提取液对冬枣轮纹病菌的抑制效应[J]. 落叶果树, 2014, 46(5): 13–15. |
| [7] | 刘俊华, 张孝霖. 黄牛毛藓水提液对冬枣轮纹病致病菌抑制效应的初步研究[J]. 安徽农学通报, 2015, 21(23): 23–25. DOI:10.3969/j.issn.1007-7731.2015.23.009 |
| [8] | 刘雪红, 王宝琴. 冬枣轮纹病病原真菌的分离及其拮抗菌的初筛[J]. 华北农学报, 2014, 29(1): 227–231. DOI:10.7668/hbnxb.2014.01.041 |
| [9] | Berdy J. Bioactive microbial metabolites, a personal review[J]. Journal of Antibiotics, 2005, 58(4): 1–26. |
| [10] | 姜怡, 曹艳茹, 韩力, 等. 五种动物粪便纯培养放线菌的多样性及生物活性[J]. 微生物学报, 2012, 52(10): 1282–1289. |
| [11] | Jensen PR. Linking species concepts to natural product discovery in the post-genomic era[J]. Journal of Industrial Microbiology and Biotechnology, 2010, 7: 219–224. |
| [12] | 田守征, 刘凯, 徐丽华, 等. 嗜盐放线菌资源及次生代谢产物研究进展[J]. 微生物学通报, 2014, 41(9): 1882–1890. |
| [13] | 田家怡, 谢文军, 孙景宽. 黄河三角洲贝壳堤岛脆弱生态系统破坏现状及保护对策[J]. 环境科学与管理, 2009, 34(8): 138–143. |
| [14] | Shirling EB, Gottlieb D. Methods for characterization of Streptom-yces species[J]. International Journal of Systematic and Evoluti-onary Microbiology, 1966, 16(3): 313–340. |
| [15] | 阮继生, 黄英. 放线菌快速鉴定与系统分类[M]. 北京: 科学出版社, 2011-77. |
| [16] | 徐大勇, 李志栋, 李峰, 等. 番茄灰霉病菌拮抗放线菌的筛选、鉴定及其活性评价[J]. 中国生物防治学报, 2012, 28(2): 298–302. |
| [17] | 陆继臣, 迟乃玉, 张庆芳. 生防细菌CNY-04筛选、鉴定及其对灰霉病菌的防效[J]. 微生物学通报, 2013, 40(9): 1631–1637. |
| [18] | 杜廷芹, 黄海军, 王珍岩, 等. 黄河三角洲北部贝壳堤岛的近期演变[J]. 海洋地质与第四纪地质, 2009, 29(3): 23–29. |
| [19] | 刘庆, 孙景宽, 田家怡, 等. 黄河三角洲贝壳堤岛典型建群植物养分吸收积累特征[J]. 水土保持研究, 2010, 17(3): 153–156, 161. |
| [20] | 赵丽萍, 段代祥. 黄河三角洲贝壳堤岛自然保护区维管植物区系研究[J]. 武汉植物学研究, 2009, 27(5): 552–556. |
| [21] | 赵艳云, 胡相明, 刘京涛. 贝壳堤地区微生物分布特征及其与植被分布的关系[J]. 水土保持通报, 2012, 32(2): 267–270. |