2. 河北农业大学,保定 071000
2. Agricultural University of Hebei Province, Baoding 071000
麻山药属薯蓣科多年生草质藤本植物,根茎营养丰富,兼有食、药功能,具有健脾、补肺、益精等功效。现代研究表明,麻山药中的多糖具有降低血糖、提高及调节免疫、防止高血脂、调整胃肠、防止衰老的功能,尿囊素有抗刺激物、麻醉镇静、促进上皮生长、消炎抑菌等作用[1]。但随着种植面积的扩大和不平衡施肥现象日益严重,土壤状况持续下降,土壤微生物环境遭到破坏,病虫害时有发生,重茬现象严重,造成减产或绝收。河北保定蠡县麻山药已有3 000年种植历史[2],根茎腐病和糊头病是危害该地区生产的重要两种病害,前者在发病初期,形成深褐色的中部凹陷的长形病斑,表面常有不明显的淡褐色丝状霉,植株叶色不正,叶脉附近褪绿或叶缘坏死,发病严重时茎蔓的基部出现干缩,逐渐枯死[3];后者症状为块茎生长点前端表皮似火烧状,病部表皮变黑,生长点停止伸长,内部无明显变化,有时中部表皮也变黑,发病随连作逐年加重,一般连作地块发病率可达30%-70%[4],危害严重。
目前,生产上一般采用轮作和化学杀菌剂的方法减少病害的发生,但由于土传病害病原菌的寄主范围广,有时轮作难以奏效。而农药的使用不仅对人体健康有损害,也造成对环境的污染,长期使用后病原菌容易产生抗药性,增加防治难度,形成恶性循环。随着生物技术的发展,人们开始认识到施用微生物菌剂是改善土壤环境,从根本上解决病害的有效措施。而研究植物根际微生物菌群的变化是采用微生物技术防治植物病害的前提,土传病害的发生与土壤微生物区系和群落结构密切相关[5]。谭雪莲等[6]揭示马铃薯土壤微生物群体与土传病原菌的相互关系,认为土壤真菌显著促进镰刀菌,而镰刀菌抑制细菌、微生物量碳氮、蔗糖酶和脲酶活性,从而导致了病原菌数量增多,土壤微生物的生存环境恶化。杨瑒等[7]研究发现当施氮水平一定,土壤中微生物种群数量增加,细菌群落的多样性更复杂,放线菌的数量增加,真菌数量有所减少,改善了马铃薯生长发育的土壤环境,增强马铃薯植株的抗病性,从而降低马铃薯晚疫病的发生程度。群落多样性、均匀度和优势种群集中度是从不同角度衡量生物群落结构和稳定性的重要指标[8],随着高通量测序技术不断发展[9],研究者也更多的通过土壤微生物学特性来评价土壤的健康程度和质量。本研究对两种麻山药典型病害土壤根际微生物进行多样性分析,旨为缓解以及防治麻山药重茬病害发生提供参考。
1 材料与方法 1.1 材料本研究所选地块均为河北省蠡县发病严重地块,糊头地块的发病率在50%以上,根茎腐病的发病率为90%以上,农户放弃采收当年山药。土壤有机质含量6.9-7.51 g/kg、碱解氮27.88-29.05 mg/kg、速效磷6.62-7.08 mg/kg、速效钾61.25-65.88 mg/kg。测定方法参照中国科学院南京土壤研究所《土壤理化分析》[10]。
样品于2015年10月15日山药采收季采集,从两种病害发病严重的地块中分别选取3个有代表性的地块,在每一标准地内选取3个取样点,在离麻山药根基轴表面1-5 mm处,用抖落法获取其上粘附的土壤作为根际土壤[11],不同病害下3个土样混合并除去较大根系等杂物后作为该典型病害土壤的一个样品,每组3个平行。对照组选取无病害发生的地块作为取样点,取样方式一致。储存于密封牛皮纸袋中,保持低温运输,置-20℃冰箱冷冻备用。
1.2 方法 1.2.1 DNA提取与检测采用土壤基因组DNA提取试剂盒(离心柱型)对土壤总DNA进行提取及琼脂糖凝胶DNA回收试剂盒(普通离心柱型)进行初步纯化,经1%的琼脂糖凝胶电泳检测及微量核酸蛋白检测仪检测浓度后置于-20℃保存备用。
1.2.2 基因扩增PCR反应体系:DNA模板1 µL,10×Buffer 5 μL,2.5 mmol/L dNTPS 4 μL,Taq DNA聚合酶0.5 μL,上、下游引物各1.5 μL,无菌超纯水补充至50 μL。扩增程序:94℃预变性5 min,94℃变性50 s,50-60℃退火50 s(根据引物不同设计),72℃延伸1.5 min,30个循环,72℃延伸10 min。
1.2.3 高通量测序高通量测序文库的构建和基于Illumina MiSeq平台的测序由GENEWIZ公司(Suzhou,China)完成,并用Trimmomatic、Vsearch、Qiime、RDP Classifier等分析软件对测序结果进行微生物多样性的分析。
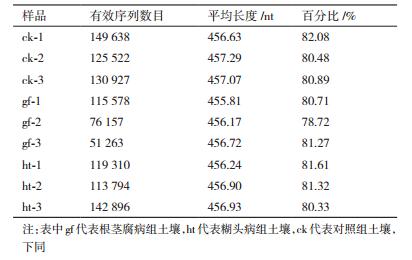
2 结果 2.1 细菌和真菌高通量测序数据特性对各样本测序数据进行数据量和测序质量的统计,得到原始数据,但由于高通量测序通常会出现一些突变等测序错误,需对测序结果优化处理,优化步骤及参数:将两条序列进行比对,根据比对的末端重叠区进行拼接,拼接时保证至少有20 bp的重叠区,去除拼接结果中含有N的序列; 去除引物和接头序列,去除两端质量值低于20的碱基,去除长度小于200 bp的序列; 将上面拼接过滤后的序列与数据库进行比对,去除其中的嵌合体序列(Chimera sequence),得到最终的有效数据。各样品过滤后细菌群落统计结果见表 1。
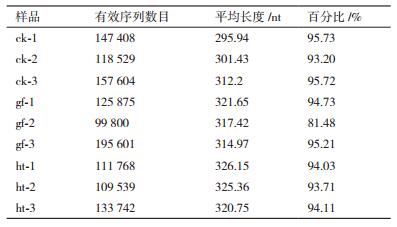
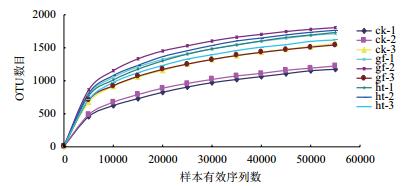
在生物多样性和群落调查中,稀释曲线(Rare-faction curve)被广泛用于判断样品量是否充分以及估计物种丰富度。从图 1和图 2可以看出,3组样品对应的稀释曲线均基本趋于平缓,说明取样基本合理,实际环境中细菌(或真菌)群落结构的置信度较高,能够比较真实的反映出样品的细菌(或真菌)群落。各样品过滤后真菌群落统计结果见表 2。

|
| 图 1 各土壤样品细菌稀释曲线 |
|
| 图 2 各土壤样品真菌稀释曲线 |
多样性指数能够有效的反映出土壤微生物结构的多样性,对97%相似水平的OTU进行分类学分析,由表 3和表 4可以看出,各处理组的细菌和真菌的Coverage指数都超过了90%,说明在该水平上的测序结果能够反映出所测样本中细菌的真实情况。由表 3中可以看出,糊头病组的Shannon指数较对照组高2.46%,两组之间有显著性差异(P < 0.05);根茎腐病组较对照组低0.21%,两组之间没有显著性差异。Chao指数是用Chao1算法估计样本中所含OTU数目的指数,Chao1在生态学中常用来估计物种总数,糊头病组的Chao1指数较对照组高3.56%,根茎腐病组较对照组低9.52%,不同处理组之间差异显著。
由表 4可以看出,不同土壤中真菌多样性指数区别较大。其中根茎腐病组的Shannon指数和糊头病组较对照组分别高16.45%和13.74%,两者之间差异不明显,但较对照组之间都有显著性差异。从Chao1来看,糊头病组较对照组高20.76%,根茎腐病组较对照组高16.36%。
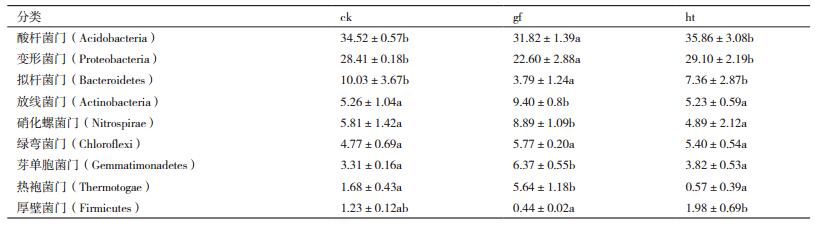
2.3 各处理细菌菌群分布为了得到OTU对应的物种分类信息,使用RDP classifier对97%相似水平的OTU代表序列进行分类学分析,并在各个水平统计每个样品的群落组成,如表 5所示,所有处理的土壤样品中检测到9个以上细菌门(相对丰度 > 1%),可见这9个门的细菌在本实验中所取的土壤细菌群落结构组成中占主要地位。
对比Silva数据库,各样品在门水平下Top30的物种分类图(图 3) 可以看出,不同处理的土壤中酸杆菌门(Acidobacteria)均为最优菌群,所占比例分别为34.52%、31.82%和35.86%,酸杆菌门(Acidobacteria)和变形菌门(Proteobacteria)两者之和所占的比例超过了60%,其他组分含量较低。对照组处理的优势菌群(所占比例超过5%)主要有酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和硝化螺菌门(Nitrospirae)。根茎腐病组的土壤中除了上述5种优势菌群外(拟杆菌门所占比例略有降低),绿弯菌门(Chloroflexi)、热袍菌门(Therm-otogae)和芽单胞菌门(Gemmatimonadetes)所占的比例均超过了5%,其中放线菌门(Actinobacteria)、热袍菌门(Thermotogae)、硝化螺菌门(Nitrospirae)和芽单胞菌门(Gemmatimonadetes)的比例均比对照组明显提高,分别高4.14、3.96、3.08和3.06个百分点,相对应的拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)的比例却显著降低,比对照组低6.24和5.81个百分点。表中可以看出糊头病组的土壤中优势菌群所占比例与对照组之间没有显著性差异。
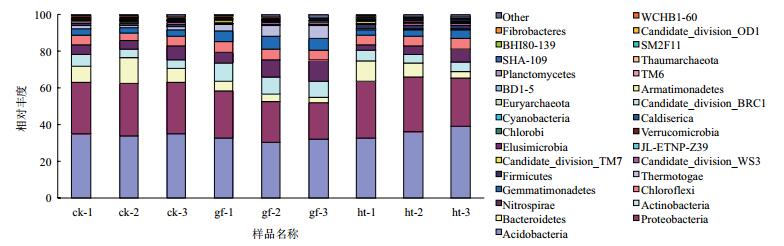
|
| 图 3 各样本在门水平前30的细菌物种分布图 |
样品聚类分析利用各样品序列间的进化信息来比较在特定的进化谱系中是否具有显著的微生物群落差异,使用非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)将样品进行聚类,结果如图 4所示,各处理组细菌组成可以分为两大类,图 4中对照第2组和第3组样品的细菌群落组成具有很高的相似性,糊头病第1组和第2组具有很高的相似性,并与糊头第3组和对照第1组的样品聚为一类,说明这6组样品的趋同性较高,而根茎腐病土壤则被单独聚为一类,其中第2组和第3组样品相似性更高,并与第1组样品聚为一类。由此可以得知,糊头病土壤的细菌群落组成与对照组之间相似性较高,说明糊头病相比根茎腐病,其对土壤中的细菌组成影响较小,导致细菌群落结构与对照组之间存在趋同性。
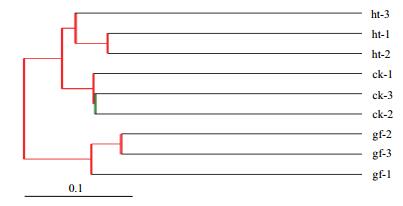
|
| 图 4 细菌群落结构UPGMA聚类图 图中每个分枝代表一个样本,内节点用不同颜色分出不同区间的bootstrap值。红色表示bootstrap介于75%-100%之间; 绿色表示bootstrap值介于25%-50%之间 |
各处理的土壤样品真菌测序结果与Silva数据库进行对比,由图 5可以看出,所有处理的土壤样品中检测到8个以上的真菌门,其中最优势的门是子囊菌门(Ascomycota),占真菌总量的50%以上(对照组中占90%以上),其他未知序列或者无法鉴别序列的真菌门的相对丰度也比较高,接合菌门(Zygomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)在根茎腐病和糊头病的土壤中相对丰度远远高于对照组,表明这几种真菌门可能与植株发生这两种病害有关,但仍需要进一步的实验证明。
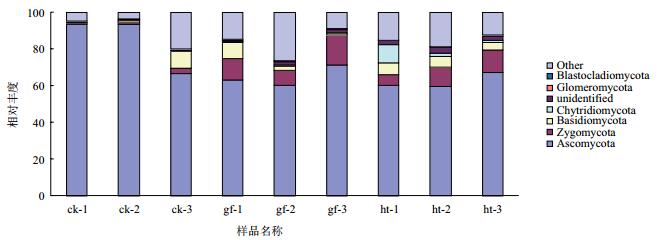
|
| 图 5 各样本在门水平前30的真菌物种分布图 |
图 6结果显示,不同处理土壤中真菌组成在属水平下分布和变化有区别,对照组中未分类和其他未知或者未检测到的真菌菌群之和比例最高,超过了90%,根茎腐病和糊头病土壤为50%左右。根茎腐病土壤中毛壳霉属(Chaetomium)和镰孢霉属(Fusarium)所占的比例显著高于其他两组,此外,小包脚菇属(Volvopluteus)和矛束霉属(Doratomyces)也仅在根茎腐病土壤中出现,其余两组中均没有。
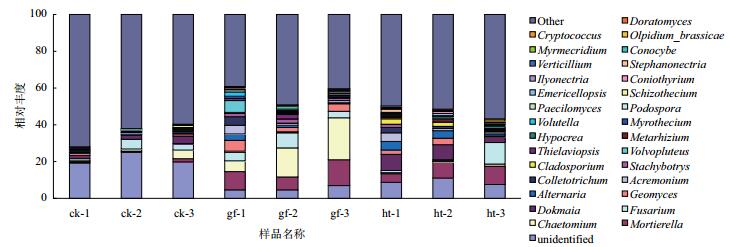
|
| 图 6 各样本在属水平前30的真菌物种分布图 |
本研究选取了糊头病和根茎腐病两种麻山药典型病害的土壤地作为研究对象,应用高通量测序技术对齐根际土壤细菌和真菌的群落结构多样性和种类进行了研究。
在本研究中,对群落结构的α-多样性指数进行分析,其中Shannon指数反映土壤中微生物的多样性,其值越高,说明群落多样性越高[12],Chao[13]指数是用chao1算法估计样本中所含OTU数目的指数,chao1在生态学中常用来估计物种总数,由Chao最早提出,其值越大表示样品中细菌含量越高。所以,不同处理组土壤中细菌多样性表现为糊头病的土壤 > 对照组 > 根茎腐病组,丰富度值表现为糊头病组 > 对照组 > 根茎腐病组; 而土壤中真菌多样性指数区别较大,多样性表现为根茎腐病的土壤 > 糊头病组 > 对照组,丰富度表现为糊头病组 > 根茎腐病组 > 对照组。目前关于麻山药糊头病病害机理研究甚微,有报道称其发生与植株中缺少钙元素有关,田间施用的钾肥(多数为硫酸钾)和氮肥(尿素类)与离子态的钙相结合沉淀,植物中能吸收到的钙元素就很少。本研究中糊头病土壤中细菌和真菌组成与对照组之间存在差异,说明病害发生与微生物组成也有关,但具体与哪种菌有关,需要进一步实验验证。麻山药根茎腐病属一种典型的真菌病害,此病可由腐霉、镰刀菌、疫霉等多种病原侵染引起,这与本研究中根茎腐病土壤中真菌多样性指数显著高于对照组的结果相一致,同样根茎腐病土壤中镰孢霉属所占的比例也显著高于其他两组。
随着人们对微生物在农业生产中重要作用的认识不断加深,用土壤微生物学特性来评价土壤的健康程度和质量逐渐被认可[14],用高通量手段测定的多样性数据可以作为评价土壤健康程度的一种指标,与传统的培养测数法相比,都是一种手段。土壤中某些特殊菌群组成反映在作物上可能对其生长造成很大的影响,相关研究表明,毛壳菌属是腐生子囊菌中数量最多和意义较大的类群之一,它作为生防菌在防治植物病害方面最为突出,早在1954年,Martin和Moore[15]发现,燕麦种子被球毛壳和螺卷毛壳侵染后,会使谷物、大麦等作物的幼苗免受镰刀菌的再侵染[16]。采用高通量测序研究了两种典型病害土壤的多样性,目前仅发现与对照(无病害)土壤相比存在一些特定菌,推测土壤发生病害可能与这些菌属有关,但需要进一步实验验证。镰孢霉属的真菌习惯上称为镰刀菌,其生态适应性强、分布广阔,营养方式既能寄生,又能腐生,在田间发生萎蔫、根腐、皮腐及穗腐,在产品运输贮藏中发生干腐、湿腐等病[17]。这与本研究中根茎腐病土壤中存在这些菌群,而对照组中没有的结果相一致,由此可以推测根茎腐病土壤中这些特殊菌群组成与其病害有关。
微生物数量可以作为土壤肥力和生态环境的一个指标,通常情况下,土壤中细菌数量越多,其肥力越高[18],对作物越有利,而土壤中真菌和放线菌数量越高,是土壤肥力下降的表现[19],不利于作物的生长。试验中两种病害试验田中真菌和放线菌的数量明显高于对照组,由此推测根茎腐病和糊头病害与土壤中真菌和放线菌的数量相关性高。群落多样性指数是从不同角度衡量生物群落和稳定性的重要指标,群落多样性参数值越大,其优势集中度就越小,群落结构越复杂,其应对环境变化能力或者对群落内部的种群波动的缓冲作用就越强,即反馈系统越强大,群落也就越稳定[20]。因此,在防治根茎腐病和糊头病害过程中,可以研发土壤菌剂调节剂,改变土壤微生物菌群的组成,使其通过细菌与细菌之间、真菌与真菌之间或细菌与真菌之间的相互作用,充分发挥拮抗菌的作用,达到抑制病原微生物的生长,提高抗病性,保持土壤生态平衡的目的。
4 结论本研究土壤中细菌多样性和丰度值均表现为糊头病组 > 对照组 > 根茎腐病组,而两种病害试验田土壤的真菌多样性和丰度均高于对照组,进一步证明了土壤中真菌数量与根茎腐病和糊头病发病有关。
| [1] | 贾海民, 鹿秀云, 陈丹, 等. 麻山药根腐病发生规律及其防治技术[J]. 北方园艺, 2011, 1(1): 159–160. |
| [2] | 周剑, 刘艳玲, 董冰, 等. 河北蠡县麻山药产业化发展中的问题及对策[J]. 江苏农业科学, 2010, 1(4): 444–445. |
| [3] | 郎德山, 马兴云, 李建永. 山药根茎腐病的发生原因及防治措施[J]. 长江蔬菜, 2014, 1(1): 50–51. |
| [4] | 刘景锁, 刘海河. 防治麻山药土传病害新技术—土壤熏蒸[J]. 长江蔬菜, 2016, 1(11): 56–57. DOI:10.3865/j.issn.1001-3547.2016.11.024 |
| [5] | Perez CA, Dill-Macky R, Kinkel L. Management of soil microbial communities to enhance populations of fusarium gram inearum antagonists in soil[J]. Plant and Soil, 2008, 302(1): 53–69. |
| [6] | 谭雪莲, 郭天文, 刘高远. 马铃薯连作土壤微生物特性与土传病原菌的相互关系[J]. 灌溉排水学报, 2016, 35(8): 30–35. |
| [7] | 杨瑒, 靳学慧, 周燕, 等. 施氮量对寒区盐碱地马铃薯生育期土壤数量和酶活性的影响[J]. 中国土壤与肥料, 2014, 1(3): 32–37. DOI:10.11838/sfsc.20140307 |
| [8] | Hunter PR, Gaston MA. Numerical index of the discriminatory ability of typing systems:an application of Simpsons index of diversity[J]. Journal of Clinical Microbiology, 1988, 26(11): 2465–2466. |
| [9] | Margulies M, Egholm M, Altman WE. Genome sequencing in microfabricated high-density picolitre reactors[J]. Nature, 2005, 1(437): 376–380. |
| [10] | 中国科学院南京土壤研究所. 土壤理化分析[M]. 上海: 上海科学技术出版社, 1978. |
| [11] | 汪其同, 朱婉芮, 刘梦玲, 等. 基于高通量测序的杨树人工林根际和非根际细菌群落结构比较[J]. 应用与环境生物学报, 2015, 21(5): 967–973. |
| [12] | 罗影. 不同种植模式对胡麻田土壤酶活性和土壤微生物群落及多样性的影响[D]. 兰州: 甘肃农业大学, 2016. |
| [13] | Kemp PF, Aller JY. Bacterial diversity in aquatic and other environments:what 16S rDNA libraries can tell us[J]. FEMS Microbiology Ecology, 2004, 47(1): 161–177. |
| [14] | 王淑玉, 李小龙, 李丽红, 等. 不同质地土壤烟铸根际微生物菌群变化分析[J]. 湖南农业科学, 2015, 1(3): 5–9. |
| [15] | Martin T, Moore MB. Isolate of Chaetomium that protect oats from Helm in thosporium victoriae[J]. Phytopathology, 1954, 44(1): 686–689. |
| [16] | 郭云忠, 孙广宇, 李振岐, 等. 毛壳属真菌的分类研究[J]. 西北林学院学报, 2005, 20(1): 132–135. |
| [17] | 阮华芳, 姜广正. 镰孢菌属真菌鉴定方法[J]. 内蒙古农业大学学报, 1984, 1(1): 59–68. |
| [18] | 蒋婧, 宋明华. 植物与土壤微生物在调控生态系统养分循环中的作用[J]. 植物生态学报, 2010, 34(8): 979–988. |
| [19] | 马云华, 等. 日光温室连作黄瓜根区微生物区系及酶活性的变化[J]. 应用生态学报, 2004, 15(6): 1005–1008. |
| [20] | 王超, 吴凡, 刘训理, 等. 不同肥力条件下烟草根际微生物的初步研究[J]. 中国烟草科学, 2005, 26(2): 12–14. |