2. 中国农业科学院甘蔗研究中心 农业部广西甘蔗生物技术与遗传改良重点实验室 广西农业科学院 广西甘蔗遗传改良重点实验室,南宁 530007
2. Sugarcane Research Center, Chinese Academy of Agricultural Sciences/Key Laboratory of Sugarcane Biotechnology and Genetic Improvement(Guangxi), Ministry of Agriculture/ Guangxi Academy of Agricultural Sciences/Guangxi Key Laboratory of Sugarcane Genetic Improvement, Nanning 530007
甘蔗是禾本科植物中最高大的作物之一,生长周期长,施肥量大。在甘蔗的各项农资投入中,化肥尤其是氮肥所占比重大,对甘蔗产量的影响也最大。生物固氮是地球生态系统固氮作用的最主要途径之一,每年的全球总固氮量中约60%以上来是自于生物固氮[1]。通过生物固氮作用固定的氮素能与有机物结合且不易流失,能被生物完全利用而不会对环境造成污染。因此研究生物固氮在改善生态平衡和促进农业可持续发展上具有重要意义。
Döbereiner实验室于1958年首次从热带甘蔗的根际分离到固氮细菌,证实了甘蔗存在生物固氮潜能[2]。内生固氮菌位于植物体内部,在植物组织内生活而不引起植物病症或者伤害,在植物组织内部建立联合固氮体系进行固氮作用。内生固氮菌存在最多的部位是根皮层细胞间、叶肉和叶薄壁组织、维管组织中的木质部,根(根毛)表皮细胞内也是内生固氮菌分布较多的部位[2, 3]。国内对甘蔗内生固氮菌的研究越来越多,邢永秀等[4]从甘蔗体内分离培养了一批内生固氮菌; 魏春燕等[5]用荧光蛋白标记法研究内生固氮菌的定殖规律; 杨仲荣等[6]用15N标记法测定甘蔗叶片生物固氮量; 林丽[7]和桂意云等[8]用乙炔还原法测定甘蔗不同器官的固氮酶活性。nifH基因是编码固氮酶铁蛋白的基因,是所有固氮微生物含有的最保守的功能基因,在进化上与16S RNA有较高的相关性[9-12]。研究表明可以直接检测nifH基因的多样性来检测植物内生固氮菌的多样性[11, 13]。Ando等[14]报道,在工艺成熟期的甘蔗体内存在Bradyrhizobium sp.、Klebsiella sp.和Serratia sp.等固氮微生物。Thaweenut等[15]在甘蔗移栽后的59 d和100 d,应用RT-PCR方法在甘蔗的根部和茎部都成功检测到nifH基因的表达。
虽然甘蔗生物固氮研究取得了很大进展,但是原位检测固氮基因表达的研究还较少,尤其是以大田甘蔗叶片为材料研究nifH序列多样性及固氮酶相对表达量的报道还未见有报道。本研究以大田甘蔗叶片为材料,用RT-PCR方法及Western blot技术分析氮肥对甘蔗内生固氮菌nifH的基因表达及相对表达量的影响,以期探明氮肥及甘蔗基因型对甘蔗内生固氮菌nifH表达的影响。
1 材料与方法 1.1 材料试验样品种植在广西大学农学院试验田,为第一年宿根蔗,上季新植蔗砍收的时间是2016年3月12日。试验的3个甘蔗品种分别为GXB9、ROC22和GT11。试验地土壤基本性质如下:土壤质地为赤红壤,pH6.83、有机质含量4.97 g/kg、全氮含量0.44 g/kg、全磷含量0.45 g/kg、全钾含量10.25 g/kg、水解性氮含量21.76 mg/kg、速效磷含量14.92 mg/kg、速效钾含量64 mg/kg[16]。大肠杆菌DH5α购与北京全式金生物公司,pMD18-T载体试剂盒及反转录试剂盒均购自TaKaRa宝生物工程有限公司,TRIzon总RNA提取试剂盒和nifH抗体购于Agrisera公司,其他抗体及EsTaqMix均购于康为世纪生物有限公司,引物合成及测序由上海生工完成。
1.2 方法 1.2.1 甘蔗样品处理及叶片采集施氮处理(N-),施用300 kg/ha的尿素(含N 46%,广西河池化工股份有限公司生产),同时施用适量钾肥和磷肥; 不施氮处理(W-),不施氮肥只施适量钾肥和磷肥。施肥时间是2016年4月20日。于2016年7月18日上午8点到11点采集试验材料。每个样品随机选取6张叶片(+1叶),用灭菌的剪刀减去叶片最下方和最上方部位,大概留2/3的叶片,先用蒸馏水冲洗一次,用75%的酒精擦拭一次,再用灭菌水冲洗两次,用灭菌的滤纸擦干,剪碎用锡箔纸包起来放入液氮里,-80℃保存,用于RNA和蛋白质的提取。
1.2.2 甘蔗叶片总RNA提取及反转录采用康为世纪TRIzon总RNA提取试剂盒(CW0580) 提取叶片总RNA,用0.8%的琼脂糖凝胶检测提取RNA的质量,用核酸浓度测定仪测定浓度。提取的RNA按照TaKaRa公司的PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(DRR820A)说明书反转录成cDNA,保存在-80℃。
1.2.3 甘蔗叶片总蛋白质的提取用酚抽提法提取甘蔗叶片总蛋白质,考马斯亮蓝法测定蛋白浓度[17]。取25 µg蛋白用12.5%的SDS-PAGE配体胶检测蛋白质,剩余的蛋白保存在-80℃,裂解的蛋白液体保存在-20℃。
1.2.4 nifH基因的PCR检测以cDNA为模板,用PolyF和PloyR引物[18]进行第一轮PCR扩增; 反应体系(25 µL)包含12.5 µL EsTaqMix(康为世纪,CW0939),9.5 µL灭菌水,10 µmol/L上下游引物各1 µL和1 µL cDNA模板; 反应程序为:94℃ 5 min,94℃ 45 s,55℃ 60 s,72℃ 60 s,30个循环,最后72℃延伸5 min。nifH-Rev(ACCCGCCTGATCCTGC-ACGCCAAGG)和nifH-For(ACGATGTAGATTTCC-TGGGCC TTGTT)[19]作为第二轮扩增引物,反应体系及反应程序同上。PCR产物用1.2%的琼脂糖凝胶电泳检测,正对照为本实验从ROC22中分离到的内生固氮菌DX120E。
1.2.5 nifH基因的克隆测序及序列比对将nifH的PCR反应产物进行PCR产物纯化,纯化产物连接到PMD-18T载体上,转进大肠杆菌中。通过蓝白斑筛选初筛,使用M13-47和M13-48引物检测阳性克隆。施氮和不施氮处理下3个甘蔗品种共6个样品,每个样品挑取10个阳性克隆送去测序(上海生工生物公司)。将测序结果用NCBI Blast比对检测是否为nifH基因,选取典型克隆用NTI软件对所得的nifH基因进行序列比对。
1.2.6 nifH进化树构建将测序结果于NCBI上进行Blast比对分析,获取相近典型菌株序列。然后利用Clustal X 1.83和Mega5.0中的邻接法(Neighbor-Joining)构建固氮微生物nifH基因的发育树,其中的遗传距离用Tamura_Nei公式计算,分支长度代表了分歧程度,各支上的数字是1 000次bootstrap重抽样分析的支持百分比。
1.2.7 nifH蛋白的Western blot检测取20 µg蛋白质,跑SDS-PAGE电泳将蛋白质分离,然后采用湿转的转模方法将蛋白质转移至硝酸纤维膜上(转膜条件40 V,90 min)。然后将膜放到含有5%脱脂牛奶的0.01 mol PBST中室温封闭2 h。将膜从封闭液中取出,用PBST清洗3次,每次5 min,然后转入10 ml含0.1%脱脂牛奶的PBST中,按1:1 000的比例加入10 µL的nifH铁蛋白一抗(Agrisera,AS01021A),放到摇床上轻摇,室温下孵育2 h。将敷完一抗的膜在PBST中清洗3次,每次5 min,然后转入含0.5%脱脂牛奶的PBST溶液中,按1:5 000比例加入二抗(康为世纪,CW0205),室温下封闭1.5 h。最后再用PBST清洗3次,每次5 min,将配置好的ECL显色液滴加到膜上,在成像仪系统下观察蛋白的表达。
1.2.8 氮肥对甘蔗叶片固氮酶铁蛋白相对表达量的影响用软件计算nifH蛋白与内参蛋白的灰度值大小,然后用nifH蛋白的灰度值比上其内参蛋白的灰度值,得到nifH蛋白的相对表达量。每个样品重复2次,取平均值。本试验用的内参蛋白为β-actin蛋白,内参蛋白的一抗是鼠抗β-actin的单克隆抗体(康为世纪,CW0264M),二抗是山羊抗鼠单克隆抗体(康为世纪,CW0102A)。
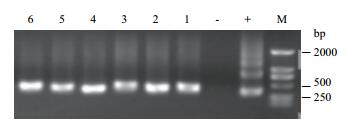
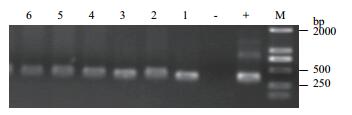
2 结果 2.1 甘蔗叶片内生固氮菌nifH基因表达的PCR检测本实验以甘蔗叶片的cDNA为模板,进行PCR检测,结果(图 1、图 2) 发现不施氮处理和施氮处理的各个甘蔗品种叶片样品中均可扩增出nifH条带,检测到nifH表达,证实自然生长状态下的甘蔗叶片中存在的内生固氮菌表达了nifH基因(目的片段的大小约314 bp是根据参考文献中前人扩增结果判断)。
|
| 图 1 不施氮处理甘蔗叶片nifH基因的PCR检测 M:DL2000 bp; +:DX120E总DNA;-:水; 1-2:W-GT11,3-4:W-ROC22,5-6:W-GXB9 |
|
| 图 2 施氮处理甘蔗叶片nifH基因的PCR检测 M:2000 bp; +:DX120E总DNA;-:水; 1-2:N-GT11,3-4:N-ROC22,5-6:N-GXB9 |
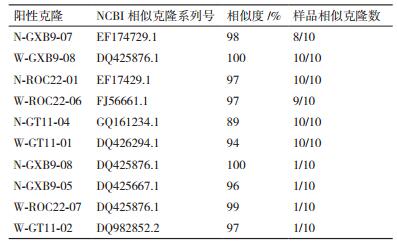
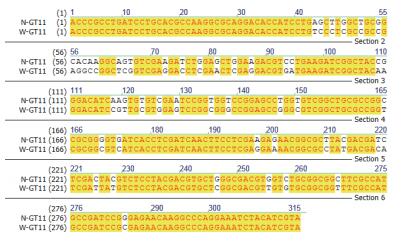
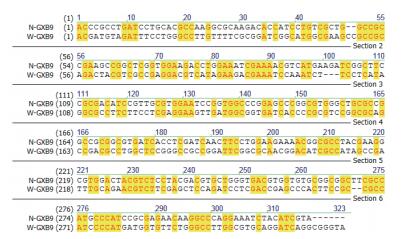
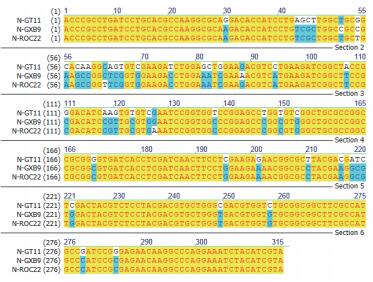
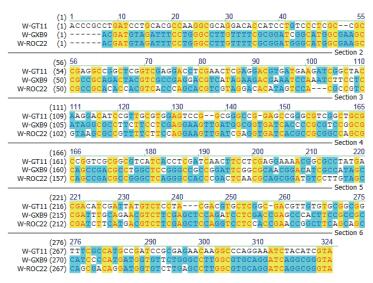
nifH基因克隆测序的结果在NCBI上进行Blast,结果显示,从同一个样品中得到的10个克隆nifH序列几乎完全相同,但不同样品间表现不一样(表 1)。对克隆出的nifH序列用NTI序列比对软件进行序列比对的结果(图 3-图 5) 发现:对于施氮和不施氮处理,从3个甘蔗品种叶片中克隆的nifH基因序列均存在差异,除了从GT11克隆的nifH基因序列差异相对较小外,另外两个品种克隆的nifH基因序列差异很大,施用氮肥改变了甘蔗叶片内生固氮菌的nifH序列部分碱基。同一个甘蔗品种施氮和不施氮处理下甘蔗叶片中存在的内生固氮菌种类有差别。在施氮条件下,3个甘蔗品种中克隆到的nifH序列几乎不存在差异(图 6);不施氮处理下从3个甘蔗品种中克隆到的nifH序列存在差异(图 7),说明施用氮肥可能减少了叶片中发生固氮作用的内生固氮菌的种类,甘蔗叶片中内生固氮菌存在的差异与品种有关。
|
| 图 3 GT11在施氮和不施氮处理的nifH序列比对 |

|
| 图 4 ROC22在施氮和不施氮处理的nifH序列比对 |
|
| 图 5 GXB9在施氮和不施氮处理的nifH序列比对 |
|
| 图 6 施氮处理不同甘蔗品种的nifH序列比对 |
|
| 图 7 不施氮处理不同甘蔗品种的nifH序列比对 |
nifH基因的系统进化关系表明(图 8),克隆出的内生固氮菌属于变形菌门固氮菌,可以分为两类。N-GXB9、N-ROC22、N-GT11和W-GT11聚为一类; 第二类包括W-GXB9和W-ROC22。N-G-XB9和N-ROC22与β-变形菌门的伯克氏菌目(Burkhol-deriales)亲缘性较近,而N-GT11与α-变形菌亚门亲缘性较近。对于不施氮处理的样品,W-GT11属于为未培养细菌,W-GXB9与r-变形菌门肠杆菌科固氮菌较近,W-GXB9与α-变形菌亚门的根瘤菌较近。

|
| 图 8 甘蔗叶片内生固氮菌nifH基因的系统发育树(临近法) |
提取叶片的总蛋白质,用nifH的多克隆抗体特异性地识别nifH铁蛋白的特性,Western blot检测甘蔗叶片中nifH基因的表达。结果(图 9) 显示,3个甘蔗品种的叶片部位都有nifH蛋白表达,证明了在大田中生长的甘蔗叶片中确实有固氮菌进行了固氮酶的表达,甘蔗叶片具有固氮能力。施氮处理的3个品种的叶片也检测到了固氮酶的表达(图 10)。

|
| 图 9 不施氮处理甘蔗叶片内生固氮菌nifH铁蛋白检测 +:DX120E总蛋白;-:E. coli总蛋白; 1:W-GT11;2:W-GXB9;3:W-ROC22 |

|
| 图 10 施氮处理甘蔗叶片内生固氮菌nifH铁蛋白检测 +:DX120E总蛋白;-:E.coli总蛋白; 1:N-GT11;2:N-GXB9;3:N-ROC22 |
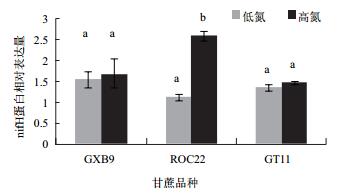
以施氮和不施氮处理3个甘蔗品种的叶片为材料,进行固氮酶nifH铁蛋白的相对表达量的检测,结果见图 11和图 12。3个甘蔗品种叶片中的固氮酶的相对表达量均为施氮条件下较高,说明施氮处理下叶片中内生固氮酶的含量可能更高。品种间相比较,ROC22叶片中的固氮酶相对表达量,对照与处理间达到了显著差异。

|
| 图 11 施氮和不施氮处理下3个甘蔗品种nifH蛋白的表达 1-6:施氮下各个品种nifH蛋白与内参蛋白的表达(1-2:N-GXB9;3-4:N-ROC22;5-6:N-GT11);7-12:不施氮下各个品种nifH蛋白与内参蛋白的表达(7-8:W-GXB9;9-10:W-ROC22;11-12:W-GT11) |
|
| 图 12 甘蔗叶片固氮酶nifH铁蛋白的相对表达量 不同小写字母表示差异性极显著(P < 0.01) |
本实验克隆到的nifH基因都属于变形菌门,从同一个样品中克隆的10个nifH基因序列差异较小,这可能和本试验采用巢式PCR进行扩增有关,同时也可能与实验样本数较少有关。Gaby和Buckley[20]对固氮酶nifH基因引物的综合评价认为:巢式PCR会大大降低引物的覆盖面,可能会大大降低对不同种类固氮菌nifH基因扩增的能力。也有研究报道,氮肥会抑制部分内生固氮菌在甘蔗体内的定殖,如G. diazotrophicus,但是对Herbaspirillum属的固氮菌定殖却没有关系[21]。Kirchhof等[22]研究发现固氮菌细菌数量在没有氮肥使用的情况下,要高于在使用氮肥种植条件下的数量。Yanni等[23]证实早期的氮肥用量对甘蔗固氮并没有太大的影响,甘蔗体内的G. diazotrophicus的分离频率随田间氮肥用量的增加而下降。氮肥和基因型都是影响内生固氮菌的因素,而究竟是氮肥对内生固氮菌的影响更大还是基因型对内生固氮菌的影响更大,不同研究有不同的观点。Sano等[24]认为植物与固氮菌的联合由植物基因型控制,并经驯化而得到加强; Coelho等[25, 26]研究表明氮肥是影响高粱根际固氮群落的决定性因素,而氮肥和基因型对高粱内生固氮菌同等重要。在本研究中,从nifH的序列比对可以看出,不同甘蔗品种中扩增到的nifH基因序列差异相对同一品种不同处理下的nifH基因序列差异较小,说明氮肥对于内生固氮菌的影响可能较品种对内生固氮菌的影响更为显著。在本研究中,从同一个甘蔗品种得到的nifH基因序列在施氮和不施氮条件下差异很大,从3个甘蔗品种叶片得到的nifH基因序列也存在较大差异,但在施氮肥条件下,3个甘蔗品种得到的nifH序列差异性降低。说明在本试验条件下,施用氮肥后,甘蔗叶片内的固氮菌nifH基因的表达受到抑制,没有进行表达或表达量减少,不施氮条件下有利于叶片内的固氮菌nifH基因的表达。本实验主要目的是采用PCR技术定性检测大田生长的甘蔗体内存在的固氮菌是否能进行nifH基因表达,但由于用于测序的克隆数偏少,可能也是造成叶片内存在的固氮菌nifH序列差异性降低的原因之一。本实验在个别样品中得到了另外一些nifH克隆,但是往往克隆数很少,并且不同样品间得到的nifH克隆序列相似,怀疑数据错误或污染,当然也有可能是从本样品中扩增出来的其他种类的固氮菌。
3.2 氮肥对甘蔗叶片内生固氮菌固氮酶表达量的影响内生固氮菌的繁殖代谢需要甘蔗提供一定的碳源及其他生长物质,在施氮条件下甘蔗代谢产物充足,就能为内生固氮菌提供足够的能源让其繁殖,合成固氮酶蛋白,提高它们的生物固氮能力。Roesch和Olivares[19]在研究基因型、氮肥和植物生长时期对玉米内生固氮菌的影响时指出:在施氮后植物生长的第一个生长阶段,约发芽后30 d,氮肥会显著地抑制内生固氮菌的数量,而在植物生长其他阶段氮肥和固氮菌数量并没有显著关系,氮肥会抑制某些种类的内生固氮菌的定殖,但是可能不影响内生固氮菌的数量。在本研究中,施氮条件下甘蔗叶片中内生固氮菌的种类减少,但是固氮酶的相对表达量却增高。生物固氮作用是耗能过程,一般认为能源是影响生物固氮的主要因素之一。施一定量的氮肥有助于甘蔗的生长,促进甘蔗的光合产物增加。虽然氮肥分解产物如氨对于一些内生固氮菌固氮酶活具有抑制作用,但氨对固氮酶活的抑制可能是短期的。Dommergues等[27]曾在水稻根部施用铵肥,虽然短期内抑制水稻根际的固氮活性,但当氨离子被水稻吸收后,促进了水稻生长和光合作用,从而提高了根际的联合固氮活性。在本研究中采样时间大约是施氮后90 d,这时候土壤中的无机氮化物大多被甘蔗吸收利用,应该对固氮酶的影响减少。
4 结论以大田生长的甘蔗叶片为材料,用RT-PCR和Western blot方法证明了内生固氮菌nifH基因的表达。施氮肥处理抑制或降低了nifH基因表达的多样性,但是却增加了nifH蛋白的相对表达量,且不同品种间存在差异。
| [1] | 洪国藩, 宋鸿遇. 固氮之光[M]. 湖南: 湖南科学科技出版社, 1998: 128-143. |
| [2] | Mohanta S, Sharma GD, Deb B. Diversity of endophytic diazotrophs in non-leguminous crops-A review. Assam University Journal of Science & Technology:Biological and Environmental Sciences[J]. 2010, 6(1):109-122. |
| [3] | 路国兵, 张瑶, 冀宪领, 等. 植物内生细菌的侵染定殖规律研究进展[J]. 生物技术通报, 2007, 3: 88–92. DOI:10.3969/j.issn.1002-5464.2007.03.019 |
| [4] | 邢永秀. 甘蔗内生固氮细菌的分离、鉴定和生长特性[D]. 南宁: 广西大学, 2006. |
| [5] | 魏春燕, 邢永秀, 等. 绿色荧光蛋白基因标记的固氮菌DX120E在甘蔗植株内的定殖[J]. 作物学报, 2014, 40(6): 1132–1139. |
| [6] | 杨荣仲, 谭裕模, 桂意云, 等. 15N测定甘蔗生物固氮能力研究[J]. 安徽农业科学, 2008, 36(24): 10405–10406. DOI:10.3969/j.issn.0517-6611.2008.24.053 |
| [7] | 林丽, 张新成, 李杨瑞, 等. 甘蔗器官固氮酶活性及其对接种固氮菌的响应[J]. 西北植物学报, 2008, 28(12): 2472–2477. DOI:10.3321/j.issn:1000-4025.2008.12.018 |
| [8] | 桂意云, 刘昔辉, 杨荣仲, 等. 甘蔗不同部位的固氮酶活性检测[J]. 植物生理学通讯, 2007, 45(2): 291–294. |
| [9] | Huaak K, Lindastrm K, Young P. Three phylogenetic groups of nodA and nifH genes in Sinorhizobium and Me sorhizobium isolates from leguminous trees growing in African and Latin America[J]. Applied and Environmental Microbiology, 1998, 64(2): 419–426. |
| [10] | Hennecke H, Kaluza K, et al. Concurrent evolution of nitrogenase genes and 16S rRNA in Rhizobium species and other nitrogen fixing bacteria[J]. Arch Microbiol, 1985, 142: 342–348. DOI:10.1007/BF00491901 |
| [11] | Ueda T, Suga Y, et al. Remarkable N2-fixing bacteria diversity dete-cted in rice roots by molecular evolutionary analysis of nifH gene sequences[J]. Journal of Bacteriology, 1995, 177(5): 1414–1417. DOI:10.1128/jb.177.5.1414-1417.1995 |
| [12] | Yong JPW. Phylogenetic classification of nitrogen fixing organisms[M]//Stacey G, Burris RH, Evans HJ. Biological nitrogen fixation. New York:Chapman and Hall, 1992, 54(6):43-86. |
| [13] | Hennecke H, Kaluza K, et al. Concurrent evolution of nitroge-nase genes and 16S rRNA in Rhizobium species and other nitrogen fixing bacteria[J]. Archives of Microbiology, 1985, 142(4): 342–348. DOI:10.1007/BF00491901 |
| [14] | Ando S, Goto M, Meunchang S. Detection of nifH Sequences in Sugarcane(Saccharurn offcinarurn L.)and Pineapple(Ananas cornosus[L.]Merr.)[J]. Soil Science and Plant Nutrition, 2005, 51(2): 303–308. DOI:10.1111/j.1747-0765.2005.tb00034.x |
| [15] | Thaweenut N, Hachisuka Y, Ando S, et al. Two seasons' study on nifH gene expression and nitrogen fixation by diazotrophic endophytes in sugarcane(Saccharum spp. hybrids):expression of nifH genes similar to those of rhizobia[J]. Plant and Soil, 2011, 338: 435–449. DOI:10.1007/s11104-010-0557-1 |
| [16] | 蒋媛. 施氮水平对不同甘蔗品种氮素积累利用及产量品质的影响[D]. 南宁: 广西大学, 2016. |
| [17] | 郭晋隆, 叶冰莹, 黄庆煌, 等. 甘蔗叶片总蛋白提取及双向电泳条件的改进[J]. 生物技术通报, 2008, 5(35): 112–115. |
| [18] | Poly F, Monrozier LJ, Bally R. Improvement in the RFLP procedure for studying the diversity of nifH genes in communities of nitrogen fixers in soil[J]. Research in Microbiology, 2001, 152: 95–103. DOI:10.1016/S0923-2508(00)01172-4 |
| [19] | Roesch LFW, Olivares FL. Characterization of diazotrophic bacteria associated with maize:effect of plant genotype, ontogeny and nitrogen-supply[J]. World Journal of Microbiology & Biotechnology, 2006, 22: 967–974. |
| [20] | Gaby JC, Buckley DH. A Comprehensive Evaluation of PCR Primers to Amplify the nifH Gene of Nitrogenase[J]. PLoS ONE, 2012, 7(7): 142–149. |
| [21] | Muthukumarasamy R, Revathi G, et al. Influence of N-fertilization on the isolation of Acetobacter diazotrophicus and Herbaspirillum spp. from Indian sugarcane varieties[J]. Biology and Fertility of Soils, 1999, 29: 157–167. DOI:10.1007/s003740050539 |
| [22] | Kirchhof G, Eckert B, Stoffels M, et al. Herbaspirillum frisingense sp. nov., a new nitrogen-fxing bacterial species that occurs in C4 -fibre plants[J]. Int J Syst Evol Microbiol, 2001, 51: 157–168. DOI:10.1099/00207713-51-1-157 |
| [23] | Yanni YG, El-Fattah FKA. Towards integrated biofertilization management with free living and associative dinitrogen fixers for enhancing rice performance in the Nile delta[J]. Symbiosis, 1999, 27: 319–331. |
| [24] | Sano Y, Fujii T, et al. Nitrogen fixation in the rhizosphere of cultiva-ted and wild rice strains[J]. Crop Science, 1981, 21: 758–760. DOI:10.2135/cropsci1981.0011183X002100050032x |
| [25] | Coelho MRR, de Vos M, Carneiro NP, et al. Diversity of nifH gene pools in the rhizosphere of two cultivars of sorghum(Sorghum bicolor)treated with contrasting levels of nitrogen fertilizer[J]. FEMS Microbiol Lett, 2008, 279: 15–22. DOI:10.1111/fml.2008.279.issue-1 |
| [26] | Coelho MRR, Marriel IE, Jenkins SN. Molecular detection and quantification of nifH gene sequences in the rhizosphere of sorghum(Sorghum bicolor)sown with two levels of nitrogen fertilizer[J]. Applied Soil Ecology, 2009, 42: 48–53. DOI:10.1016/j.apsoil.2009.01.010 |
| [27] | Dommergues Y, Balandreau J, Rinaudo G, et al. Non-symbiotic nitrogen fixation in the rhizospheres of rice, maize and different tropical grasses[J]. Soil Biology & Biochemistry, 1973, 5(1): 83–89. |