稻瘟病菌 (Magnaporthe oryzae) 是对水稻产量造成严重损失的三大病原菌之一,由于其良好的分子操作性,目前已经成为经典的模式生物[1]。在自然界中,稻瘟病菌主要依靠分生孢子完成其侵染循环。分生孢子接触到水稻叶片后2 h萌发形成芽管,8 h后芽管顶端逐渐膨大形成附着胞,附着胞分化出侵入钉并穿透寄主的表皮细胞,随后扩展形成侵入菌丝并造成叶部局部病斑[2]。在合适的温湿度条件下,发病部位可产生大量的分生孢子,通过气流传播从而完成整个病害循环过程。
活细胞不停地进行新陈代谢活动,就必须不断地与周围环境进行物质交换,而离子通道就是物质交换的窗口。永久性打开这些孔是致命的,所以通道通常处于关闭状态。一旦感受外界刺激,构象发生变化就能开启,此过程称为门控。根据门控机制的不同,可以将离子通道分为3类,电压门控性,配体门控性和机械门控性。其中,机械门控性又称机械敏感性离子通道 (Mechanosensitive channel),这是一类通过感受细胞膜张力的变化来实现胞内外机械信号转导的通道。机械敏感性离子通道几乎存在所有生物里,根据其结构不同可以分为小电导率机械敏感性离子通道 (MscS),压电离子通道 (Piezo) 家族,瞬时受体电位离子通道 (TRP) 家族,退化蛋白/上皮钠离子通道 (DEG/NaC) 和双孔钾离子通道 (K2P) 等[3, 4]。
大肠杆菌 (Escherichia coli) 有两条主要的机械敏感性离子通道,即MscS (小电导率机械敏感性离子通道) 和MscL (大电导率机械敏感性离子通道),它们通过释放渗透物质比如离子和一些小分子有机物等参与渗透调节[5]。它们由膨压导致的膜张力变化直接激活,起着“渗透安全阀”的作用[6]。拟南芥 (Arabidopsis thaliana) 有10条MscS-like (MSL) 通道[7]。其中,MSL1参与维持线粒体非生物胁迫下的氧化还原状态[8],MSL2和MSL3参与维持叶绿体的形状大小[9],MSL8参与花粉粒的萌发过程[10],定位在根部质膜的MSL9和MSL10可能与低渗胁迫信号的传导有关[11],MSL10的N端的磷酸化诱导细胞凋亡[12]。此外,衣藻 (Chlamydomonas reinhardtii) 的Msc1参与叶绿体的定位[13]。在裂殖酵母 (Schizosaccharomyces pombe) 里,定位在内质网的Msy1起低渗冲击作用[14]。目前,真菌里还报道一些重要的Ca2+透过机械敏感性离子通道。例如,在鉴定酿酒酵母 (Saccharomyces cerevisiae) 质膜上一条与动物同源的电压门控Ca2+通道Cch1时,发现一条机械敏感性离子通道Mid1与其组成高亲和的Ca2+吸收体系[15]。缺失Mid1通道导致细胞在低钙条件下接触α因子死亡,因而得其名[16]。此离子通道的功能在不同真菌里有一定差异。在粗糙脉胞菌 (Neurospora crassa) 里,不影响其交配但影响菌丝生长速率等[17],在赤霉菌 (Gibberella zeae) 里影响子囊的饱和度等[18]。在某些致病真菌里,Mid1影响其致病力强弱[19, 20]。另外,酿酒酵母 (S. cerevisiae) 液泡里发现一条重要的机械敏感性通道Yvc1[21]。Yvc1影响白色念珠菌 (Candida albicans) 的致病力[22],但不影响玉米炭疽菌 (Colletotrichum graminico) 的致病力[23]。一些机械敏感性离子通道还参与生物的向触性过程。如在白色念珠菌 (C. albicans) 里,Mid1被认为与菌丝的向触性有关[24]。用拟南芥 (A. thaliana) 的cDNA去互补缺失Mid1的酿酒酵母,发现拟南芥有一条Ca2+过机械敏感性离子通道MCA1,该突变体不能穿透硬的琼脂块,表明其参与拟南芥的接触感应[25]。
据统计,全球每年因稻瘟病造成的水稻产量损失高达10%-30%[26]。稻瘟病防治已经成为一项关系国计民生的研究课题。离子通道是细胞内外物质交换的渠道,对生物体具有至关重要的生理作用。因此,本研究中对稻瘟菌的机械敏感性离子通道进行了鉴定和功能分析。
1 材料与方法 1.1 材料 1.1.1 供试菌株稻瘟病菌野生型菌株Guy11由本实验室保存,MoMSC1基因沉默转化子由本研究获得。所有菌株在CM培养基 (酵母提取物6 g/L,水解酪蛋白6 g/L,蔗糖10 g/L,琼脂15 g/L) 或燕麦培养基 (燕麦30 g/L,琼脂15 g/L) 上于28℃光照培养。菌株长期保存采用滤纸片法。
1.1.2 实验试剂本实验所用载体pSilent1为南京农业大学张正光教授实验室惠赠。PCR引物合成及测序由北京华大基因公司完成,DNA Marker购自北京全式金公司,各种DNA聚合酶及dNTP购自Takara公司,常用限制性内切酶及T4 DNA连接酶购自Fermentas公司,大肠杆菌感受态Trans-T1购自北京全式金公司,质粒提取试剂盒购自OMEGA公司,PCR纯化试剂盒、RNA反转录试剂盒、gDNA removal试剂盒购自Promega公司,各种抗生素 (潮霉素,卡那霉素,氨苄霉素) 购自Roche公司,其他化学试剂皆购自鼎国公司。
1.2 方法 1.2.1 生物信息学分析运用裂殖酵母小电导率机械敏感性离子通道Msy1,酿酒酵母的2条Ca2+透过机械敏感性离子通道Mid1和Yvc1的氨基酸序列在稻瘟病菌全基因组数据库中 (http://www.broad.mit.edu/annotation/genome/magnaporthe_grisea/Home.html) 进行Blast-P,搜索到其同源蛋白MGG_08304、MGG_12128、MGG_09828分别命名为MoMsc1、MoMid1、MoYvc1。将氨基酸序列与NCBI公布的所有生物体全基因组序列进行比对,搜索到其它物种同系物。在SmartServer (http://smart.emblheidelberg.de/) 以及CDD (http://www.ncbi.nlm.nih.gov/cdd/) 对这些蛋白进行结构域预测,利用MEGA将比对结果进行聚类分析产生系统发育树,用Clustalx软件进行多重序列比对,用SOSUI signal软件预测基因的信号肽,用EXPASy Proteomics Server预测蛋白质的亲水性和跨膜结构,用SOPMA软件预测基因的二级结构。
1.2.2 载体构建及转化子的鉴定根据基因沉默原理,在pSilent1载体的内含子两端插入从野生型菌株Guy11上扩增出来的416 bp的特异性正向片段 (F1/R1) 和反向片段 (F2/R2)[27]。从载体上产生的双链RNA会被体内自身的Dicer酶切出约20 bp的siRNA,形成RISC复合体,介导目标基因的mRNA降解,从而达到基因沉默的目的。
从菌落边缘打孔0.5 mm的菌丝块接种于完全培养基CM,在28℃黑暗培养7 d后观察菌落形态,分别添加渗透压调节剂0.5 mol/L NaCl和1.0 mol/L sorbitol,其中NaCl代表盐胁迫,sorbitol作为保持渗透压稳定剂;分别添加细胞壁紊乱剂200 μg/mL CR (Congo red) 和200 μg/mL CFW (Calcofluor white),其中CR能够特异性地结合细胞壁中的β-葡聚糖,CFW可以特异性结合真菌细胞壁的主要成分几丁质,最后测量菌落直径并拍照。以野生型菌株Guy11为对照,每个菌株设3个重复,试验重复3次。
1.2.4 生物学表型测定分别统计野生型Guy11、MoMSC1基因沉默转化子在燕麦平板10 d黑暗条件培养和随后2 d诱导产孢后的分生孢子产量。将孢子悬浮液的浓度调节至1×104个/mL,分别吸取野生型和突变体的孢子液20 μL滴于载玻片上,置于28℃黑暗保湿培养,24 h后观察附着胞形成率。每个菌株设3个重复,实验重复3次。
1.2.5 致病性分析选取生长14 d对野生型菌株Guy11敏感的水稻品种幼苗 (CO39),收集野生型Guy11、MoMSC1基因沉默转化子菌株的分生孢子,将孢子浓度调节至5×104个/mL,用喷雾器将孢子悬浮液均匀喷洒至水稻叶片上,先置于28℃黑暗培养24 h,随后置于28℃,12 h黑暗/光照交替培养,7 d后观察发病情况和拍照。实验重复3次。
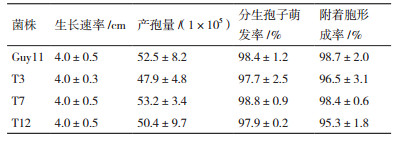
2 结果 2.1 稻瘟菌机械敏感性离子通道的鉴定根据裂殖酵母小电导率机械敏感性离子通道Msy1,酿酒酵母的2条Ca2+透过机械敏感性离子通道Mid1和Yvc1的氨基酸序列在稻瘟病菌基因组数据库进行Blast-P,搜索到其同源蛋白MGG_08304、MGG_12128、MGG_ 09828分别命名为MoMsc1、MoMid1和MoYvc1,与Msy1、Mid1和Yvc1蛋白的氨基酸等同性 (保守性) 分别为42%、36%和41%。结构域预测表明,MoMsc1有5个预测的跨膜域,MoMsc1及其同源蛋白均含有1个保守的Ca2+结合域EF-hand,该结构位于第4-5个跨膜域之间,并且为真菌里的MscS家族所特有,说明它们可能参与细胞内钙离子的转运等过程 (图 1-A);MoMid1带有1个N端信号肽,没有预测的跨膜域,可能为质膜定位的GPI锚定蛋白 (图 1-B);MoYvc1有8个预测的跨膜域,该家族属于保守的TRP通道 (图 1-C)。用MEGA对这些蛋白及其同源物进行进化树分析发现,它们在真菌里均为非常保守的蛋白。MoMsc1蛋白同源物及其数据库登录号分别为Magnaporthe oryzae(MGG_08304),Colletotrichum graminicola(GLRG_09371),Neurospora crassa(XP_961167),Schizosaccharomyces pombe(NP_587894),Aspergillus nidulans(XP_680840),Botrytis cinerea(G2YNJ4),Crytococcus neoformans(XP_776457);MoMid1蛋白同源物及其登录号分别为Magnaporthe oryzae(MGG_12128),Aspergillus fumigatus(XP_754048.1),Gibberella zeae(XP_387594.1),Claviceps purpurea(CAU66903.1),Saccharomyces cerevisiae(EGA81234.1),Candida albicans(XP_710952.1),Aspergillus nidulans(XP_682111.1),Crytococcus neoformans(XP_56917.1);MoYvc1蛋白同源物及其数据库登录号分别为Magnaporthe oryzae(MGG_09828),Saccharomyces cerevisiae(Q12324),Aspergillus fumigatus(A0A0J5PXM8),Candida albicans(Q5A2J7),Colletotrichum graminico(GLRG_09114),Aspergillus nidulans(A0A124BVQ3),Ustilaginoidea virens(A0A063BWY5)。
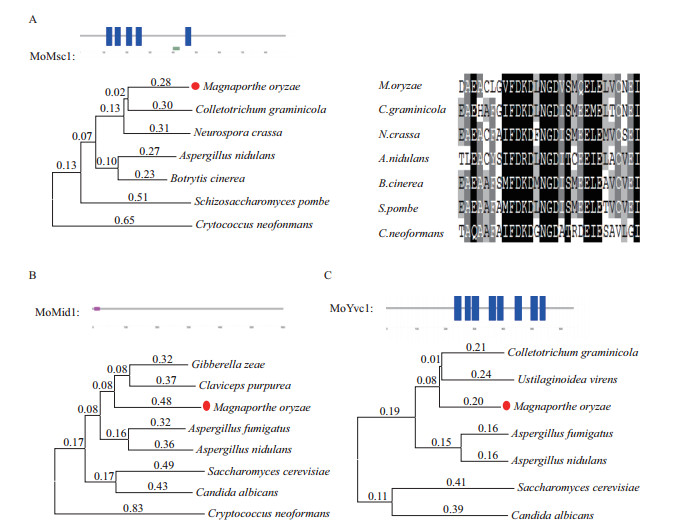
|
| 图 1 稻瘟菌机械敏感性离子通道蛋白Msc1,Mid1和Yvc1的结构域预测、多重序列比对和系统进化树分析 A:左上为MoMsc1蛋白的结构域预测,左下为各物种Msc1蛋白的进化树分析,右下为各物种Msc1蛋白的多重序列比对;B:上为MoMid1蛋白的结构域预测,下为各物种Mid1蛋白的进化树分析;C:上为MoYvc1蛋白的结构域预测,下为各物种Yvc1蛋白的进化树分析 |
对上述3条机械敏感性离子通道进行了基因敲除,然而多次实验未取得任何一个基因的敲除突变体,预示了这3个基因可能为稻瘟病菌生长必需基因。为了研究其功能,我们对其中的小电导率机械敏感性离子通道MoMSC1基因进行了RNAi,挑选一批具有潮霉素抗性的转化子,以转化子的cDNA基因组为模板,以β-tubulin (MGG_00604) 进行对照,利用引物Msc1-F/Msc1-R进行RT-PCR验证,32个PCR循环后可见其表达量差异情况,从中获得3个表达量较低的MoMSC1基因沉默转化子T3、T7、T12(图 2-A)。
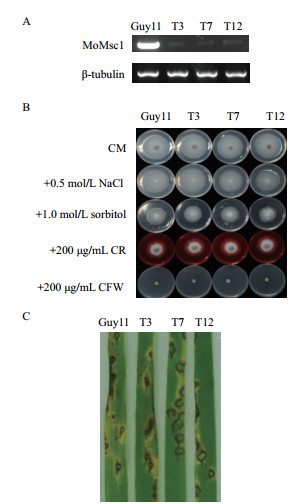
|
| 图 2 稻瘟菌小电导率机械敏感性离子通道蛋白MoMsc1的功能分析 A:RT-PCR验证MoMSC1转化子的基因沉默效果;B:菌丝在正常和胁迫条件下生长分析;C:MoMSC1基因沉默转化子的致病性分析 |
菌丝在正常和胁迫环境下生长分析结果显示,3个MoMSC1基因沉默转化子和野生型菌株在这几类培养基上的菌落形态均无明显变化 (图 2-B),表明MoMSC1基因可能不参与调控稻瘟病菌的生长及细胞应对盐胁迫、渗透胁迫和维持细胞壁的稳定性过程。此外,因为RNAi没法完全沉默该基因的表达,也有可能少量的MoMsc1蛋白的表达足以维持其生物学功能。
将野生型Guy11和MoMSC1基因沉默转化子分别接种到燕麦培养基上诱导产孢。结果发现,两者的产孢量没有显著差异。为了阐明MoMSC1基因是否参与调控稻瘟病菌的分生孢子萌发和附着胞形成过程,将野生型Guy11和MoMSC1基因沉默转化子的孢子悬浮液的浓度调节至1×104个/mL,分别吸取野生型和突变体的孢子20 μL滴于载玻片上,置于28℃黑暗保湿培养,24 h后统计分生孢子萌发率和附着胞形成率。统计分析发现 (表 2)MoMSC1基因沉默突变体与野生型比较无显著性差异。上述结果表明,MoMSC1基因不参与稻瘟菌发育过程调控。综上所述,小电导率机械敏感性离子通道MoMSC1基因沉默不影响调控稻瘟菌的生长发育过程。
最后,将野生型菌株Guy11、MoMSC1基因沉默转化子的分生孢子 (浓度为5×104个/mL) 分别喷雾接种到水稻幼苗上,7 d后观察结果发现,3个MoMSC1基因沉默转化子的致病能力与野生型比较无明显差异,两者在水稻叶片上均能形成典型的稻瘟病病斑 (图 2-C)。这些结果表明,小电导率机械敏感性离子通道MoMSC1基因沉默不影响稻瘟菌的致病过程。
3 讨论近年来,动植物里陆续发现了大量具有重要生理意义的机械敏感性离子通道,但在丝状真菌里相关报道还非常少。例如,TRPV4广泛表达于多种动物组织中,不仅可被温度变化及酸性pH激活,同时也可被低渗环境下脂肪酸所介导的细胞肿胀间接激活,被认为是重要的渗透压感受器,丧失该基因的小鼠 (Mus musculus) 表现出饮水减少趋势及高渗状态,对压迫尾部及酸刺激引起的疼痛敏感性显著降低[26]。另外,发现存在于动物的Piezo类通道也具有极其重要的生理意义,敲除果蝇 (Drosophila melanogaster) 的Piezo1后,机械性的伤害感受也同时消失,表明其参与有害刺激所致的生理反应[27]。为此,有必要对丝状真菌里机械敏感性离子通道进行深入研究,探讨其对真菌的生理意义。
MscS家族的进化可能是从大肠杆菌开始的,通过以其TM3为骨架来添加不同序列进而影响其生理特性[28]。因此,不同生物的MscS通道的生理功能差异较大。稻瘟菌是一种丝状真菌,属于多细胞真核生物,具有复杂的渗透调节体系,如其Hog信号途径可以响应多种环境下的渗透胁迫[29]。机械敏感性离子通道也被认为可能参与生物的向触性过程。在稻瘟菌里,G蛋白偶联受体Pth11被认为参与稻瘟菌的附着胞分化过程[30],其通过调节细胞内的cAMP水平参与向触性[31]。但该离子通道只是部分参与附着胞的分化,因此可能存在其他重叠的信号途径也参与稻瘟菌的向触性过程。众所周知,Ca2+和cAMP都是细胞内重要的第二信使。因此,对定位在质膜上的Ca2+透过机械敏感性离子通道的深入研究或许有助于解释这个问题。
4 结论本文通过生物信息学鉴定了目前存在稻瘟病菌里的3条机械敏感性离子通道蛋白MoMsc1(MGG_08304),MoMid1(MGG_12128) 和MoYvc1(MGG_09828)。其中,MoMsc1有5个预测的跨膜域,含有1个位于第4-5个跨膜域之间保守的Ca2+结合域EF-hand,并且为真菌里的MscS家族所特有,说明它们可能参与细胞内钙离子的转运等过程;MoMid1带有1个N端信号肽,没有预测的跨膜域,可能为质膜定位的GPI锚定蛋白;MoYvc1属于TRP家族,存在8个预测的跨膜域。本实验还对稻瘟病菌的小电导率机械敏感性离子通道基因MoMSC1(MGG_08304) 进行了功能分析,该基因沉默并未影响稻瘟菌的生长发育、高盐和高渗透压胁迫及其致病力。
| [1] | Ebbole DJ. Magnaporthe as a model for understanding host-pathogen interactions[J]. Annual Review of Phytopathology, 2007, 45 (1): 437–456. DOI:10.1146/annurev.phyto.45.062806.094346 |
| [2] | Wilson RA, Talbot NJ. Under pressure: investigating the biology of plant infection by Magnaporthe oryzae[J]. Nature Reviews Microbiology, 2009, 7 (3): 185–195. DOI:10.1038/nrmicro2032 |
| [3] | Sackin H. Mechanosensitive channels[J]. Annual Review of Physiology, 1995, 57 (1): 333–353. DOI:10.1146/annurev.ph.57.030195.002001 |
| [4] | Martinac B. Mechanosensitive ion channels: molecules of mechanotransduction[J]. J Cell Sci, 2004, 117 (12): 2449–2460. DOI:10.1242/jcs.01232 |
| [5] | Bass RB, Strop P, Barclay M, et al. Crystal structure of Escherichia coli MscS, a voltage-modulated and mechanosensitive channel[J]. Science, 2002, 298 (5598): 1582–1587. DOI:10.1126/science.1077945 |
| [6] | Booth IR, Paul B. The MscS and MscL families of mechanosensitive channels act as microbial emergency release valves[J]. Journal of Bacteriology, 2012, 194 (18): 4802–4809. DOI:10.1128/JB.00576-12 |
| [7] | Haswell ES. MscS-like proteins in plants[J]. Current Topics in Membranes, 2007, 58 (6): 329–359. |
| [8] | Lee CP, Maksaev G, Jensen GS, et al. MSL1 is a mechanosensitive ion channel that dissipates mitochondrial membrane potential and maintains redox homeostasis in mitochondria during abiotic stress[J]. Plant Journal, 2016, 88 (5): 809–825. DOI:10.1111/tpj.2016.88.issue-5 |
| [9] | Haswell ES, Meyerowitz EM. MscS-like proteins control plastid size and ahape in Arabidopsis thaliana[J]. Current Biology, 2006, 16 (1): 1–11. DOI:10.1016/j.cub.2005.11.044 |
| [10] | Hamilton ES, Jensen GS, Maksaev G, et al. Mechanosensitive channel MSL8 regulates osmotic forces during pollen hydration and germination[J]. Science, 2015, 350 (6259): 438–441. DOI:10.1126/science.aac6014 |
| [11] | Haswell ES, Peyronnet R, Barbier-Brygoo H, et al. Two MscS homologs provide mechanosensitive channel activities in the Arabidopsis root[J]. Current Biology, 2008, 18 (10): 730–734. DOI:10.1016/j.cub.2008.04.039 |
| [12] | Veley KM, Grigory M, Frick EM, et al. Arabidopsis MSL10 has a regulated cell death signaling activity that is separable from its mechanosensitive ion channel activity[J]. Plant Cell, 2014, 26 (7): 3115–3131. DOI:10.1105/tpc.114.128082 |
| [13] | Yoshitaka N, Kenta F, Masahiro S, et al. Molecular and electrophysiological characterization of a mechanosensitive channel expressed in the chloroplasts of Chlamydomonas[J]. Proc Natl Acad Sci USA, 2007, 104 (14): 5883–5888. DOI:10.1073/pnas.0609996104 |
| [14] | Nakayama Y, Yoshimura K, Iida H. Organellar mechanosensitive channels in fission yeast regulate the hypoosmotic shock response[J]. Nature Communications, 2012, 3 (8): 2543–2544. |
| [15] | Peiter E, Fischer MK, Roberts SK, et al. The Saccharomyces cerevisiae Ca2+ channel Cch1pMid1p is essential for tolerance to cold stress and iron toxicity[J]. Febs Letters, 2005, 579 (25): 5697–5703. DOI:10.1016/j.febslet.2005.09.058 |
| [16] | Paidhungat M, Garrett S. A homolog of mammalian, voltage-gated calcium channels mediates yeast pheromone-stimulated Ca2+ uptake and exacerbates the cdc1(Ts) growth defect[J]. Molecular & Cellular Biology, 1997, 17 (11): 6339–6347. |
| [17] | Lew RR, Abbas Z, Anderca MI, et al. Phenotype of a mechanosensitive channel mutant, mid-1, in a filamentous fungus, Neurospora crassa[J]. Eukaryotic Cell, 2008, 7 (4): 647–655. DOI:10.1128/EC.00411-07 |
| [18] | Cavinder B, Hamam A, Lew RR, et al. Mid1, a mechanosensitive calcium ion channel, affects growth, development, and ascospore discharge in the filamentous fungus Gibberella zeae[J]. Eukaryotic Cell, 2011, 10 (6): 832–841. DOI:10.1128/EC.00235-10 |
| [19] | Bormann J, Tudzynski P. Deletion of Mid1, a putative stretch-activated calcium channel in Claviceps purpurea, affects vegetative growth, cell wall synthesis and virulence[J]. Microbiology, 2009, 155 (Pt 12): 3922–3933. |
| [20] | de Castro PA, Chiaratto J, Winkelstr?ter LK, et al. The involvement of the Mid1/Cch1/Yvc1 calcium channels in Aspergillus fumigatus virulence[J]. PLoS One, 2014, 9 (9): e103957. |
| [21] | Palmer CP, Zhou XL, Lin J, et al. A TRP homolog in Saccharomyces cerevisiae forms an intracellular Ca (2+)-permeable channel in the yeast vacuolar membrane[J]. Proceedings of the National Academy of Sciences, 2001, 98 (14): 7801–7805. DOI:10.1073/pnas.141036198 |
| [22] | Yu Q, Fan W, Qiang Z, et al. A novel role of the vacuolar calcium channel Yvc1 in stress response, morphogenesis and pathogenicity of Candida albicans[J]. International Journal of Medical Microbiology, 2013, 304 (3): 339–350. |
| [23] | Lange M, Weihmann F, Schliebner I, et al. The transient receptor potential (TRP) channel family in Colletotrichum graminicola: a molecular and physiological analysis[J]. PLoS One, 2016, 11 (6): e0158561. DOI:10.1371/journal.pone.0158561 |
| [24] | Watts HJ, Véry AA, Perera TH, et al. Thigmotropism and stretch-activated channels in the pathogenic fungus Candida albicans[J]. Microbiology, 1998, 144 ((Pt 3)(3)): 689–695. |
| [25] | Yuko N, Takeshi K, Kazuo S, et al. Arabidopsis plasma membrane protein crucial for Ca2+ influx and touch sensing in roots[J]. Proc Natl Acad Sci USA, 2007, 104 (104): 3639–3644. |
| [26] | Valent B, Chumley FG. Molecular genetic analysis of the rice blast fungus, Magnaporthe grisea[J]. Annual Review of Phytopathology, 1991, 29 (29): 443–467. |
| [27] | Nakayashiki H, Hanada S, Nguyen BQ, et al. RNA silencing as a tool for exploring gene function in ascomycete fungi[J]. Fungal Genetics & Biology, 2005, 42 (4): 275–283. |
| [28] | Liedtke W, Friedman JM. Abnormal osmotic regulation in trpv4-/-mice[J]. Proceedings of the National Academy of Sciences, 2003, 100 (23): 13698–13703. DOI:10.1073/pnas.1735416100 |
| [29] | Sung EK, Bertrand C, Abhishek C, et al. The role of Drosophila Piezo in mechanical nociception[J]. Nature, 2012, 483 (7388): 209–212. DOI:10.1038/nature10801 |
| [30] | Booth IR, Miller S, Müller A, et al. The evolution of bacterial mechanosensitive channels[J]. Cell Calcium, 2014, 57 (3): 140–150. |
| [31] | Jacob S, Foster AJ, Yemelin A, et al. High osmolarity glycerol (HOG) signalling in Magnaporthe oryzae: Identification of MoYPD1, and its role in osmoregulation, fungicide action, and pathogenicity[J]. Fungal Biology, 2015, 119 (7): 580–594. DOI:10.1016/j.funbio.2015.03.003 |
| [32] | Dezwaan TM, Carroll AM, Valent B, et al. Magnaporthe grisea pth11p is a novel plasma membrane protein that mediates appressorium differentiation in response to inductive substrate cues[J]. Plant Cell, 1999, 11 (10): 2013–2030. DOI:10.1105/tpc.11.10.2013 |
| [33] | Liu H, Suresh A, Willard FS, et al. Rgs1 regulates multiple Galpha subunits in Magnaporthe pathogenesis, asexual growth and thigmotropism[J]. Embo Journal, 2007, 26 (3): 690–700. DOI:10.1038/sj.emboj.7601536 |