地球早期生命和逆境条件下的现世生物似乎依赖焦磷酸 (PPi) 而不是腺苷三磷酸 (ATP) 作为主要能源来维持生存。其中,由PPi驱动的膜整合焦磷酸酶 (PPase) 可能作为主要的H+、Na+泵产生跨膜电化学离子梯度,推动ATP生成、物质运输以及其它相关的生物学过程[1-3]。根据被转运离子 (Na+、H+或两者) 的特异性,膜PPase可分为3个同源亚家族Na+-PPase、H+-PPase、Na+,H+-PPase。系统发生分析显示H+-PPase和Na+,H+-PPase是由其共同前身Na+-PPase独立进化形成[1]。所有膜PPase都形成一个同源二聚体功能形式,并在膜拓扑结构 (16-17个跨膜α螺旋) 和关键氨基酸残基上具有高度的保守性[1, 4]。另外,根据某个特定位置的氨基酸残基是Ala或Lys,膜PPase还可分为K+依赖型或K+非依赖型[5]。
具有H+泵活性的膜H+-PPase广泛存在于包括古生菌、真细菌、植物和原生动物在内的生物三界中,发现最早和研究得最多,特别是近十几年来在构建抗逆生物尤其是植物方面的应用已十分瞩目[3, 6, 7]。过表达同源或异源H+-PPase的各种转基因植物在诸多逆境条件 (如高盐、干旱、氮磷钾营养亏缺、重金属污染等) 下都表现出增强的抗性或耐受性[8-13]。相比较,其它两个亚家族PPase (Na+-PPase和Na+,H+-PPase) 最近几年才仅在原核生物 (主要是一些高盐、缺氧等极端环境下的古生菌和细菌,难以分离培养) 中发现[14, 15],而且宏基因组分析显示人肠道许多厌氧微生物中含有Na+,H+-PPase和/或Na+-PPase基因 (其中一些已得到鉴定)[15],这不仅深度暗示出它们对原始生物体应对早期地化环境 (当世还有遗存) 的重要性,同时也反映出H+-PPase对现世植物适应逆境的关键作用。对它们的生化研究表明这两者都具有Na+泵活性,Na+,H+-PPase和低Na+条件下的Na+-PPase还具有H+泵活性[15, 16]。不过,目前还没有任何关于它们用于提高植物抗逆性的研究报道。
本研究选定甲基戊糖梭菌的膜整合PPase (CmPP,推测是Na+,H+-PPase亚家族成员)[15],通过PCR直接从人肠道宏基因组中克隆其基因,并对其转基因烟草进行抗旱分析,以检验它在植物中的抗逆作用。
1 材料与方法 1.1 材料大肠杆菌菌株DH5α、农杆菌菌株LBA4404以及载体pET32a (+)、pBI121均为本实验室保存。限制性内切酶 (Nde Ⅰ、Sac Ⅰ、Nco Ⅰ、EcoR Ⅴ和Sma Ⅰ)、T4 DNA连接酶、DreamTaq和Pfu DNA聚合酶购自Thermo Scientific公司;粪便基因组、质粒和植物基因组DNA提取试剂盒以及DNA凝胶纯化试剂盒购自北京Tiangen公司;PCR mix、DNA分子量标准为北京Transgene公司产品;其它生化试剂均为国产分析纯。引物 (表 1) 合成和DNA测序均由北京华大基因公司完成。
根据NCBI GenBank中已有的甲基戊糖梭菌菌株DSM 5476重叠群 (contig C_methylpentosum-1.0.1_Cont6.6) 序列 (登录号ACEC01000124),设计两对引物 (CmPP-Fw/CmPP-Rv、CmPP-5Nd/CmPP-3Sc),从人肠道中扩增和克隆甲基戊糖梭菌膜整合焦磷酸酶基因CmPP。参照Tiangen公司的粪便基因组DNA提取试剂盒说明书提取新鲜粪便的宏基因组DNA。取1 μL作模板,使用引物CmPP-Fw和CmPP-Rv和DreamTaq DNA聚合酶进行第一轮PCR,程序为:95℃ 5 min;(94℃ 30 s,50℃ 30 s,72℃ 2 min)×30;72℃ 10 min。然后,直接取0.5 μL第一轮PCR产物作模板,使用引物CmPP-5Nd和CmPP-3Sc和DreamTaq DNA聚合酶进行第二轮PCR,程序为:95℃ 5 min;(94℃ 30 s,50℃ 30 s,72℃ 2.5 min)×1;(94℃ 30 s,58℃ 30 s,72℃ 2.5 min)×30;72℃ 10 min。CmPP PCR产物纯化后先用酶Nco Ⅰ和EcoR Ⅴ进行鉴定,然后用Nde Ⅰ和Sac Ⅰ双酶切,再与经同样双酶切的载体pET32a (+) 片段连接,构建成其大肠杆菌表达载体pET (CmPP)。重组克隆用CmPP基因本身上下游引物CmPP-5Nd、CmPP-3Sc通过菌落PCR鉴定,并使用载体上靶基因两侧的T7启动子通用引物和T7终止子下游引物Tt7Dw-Rv进行双向测序。
1.2.2 CmPP的生物信息学分析DNA和蛋白质序列分析采用Vector NTI 11.0软件。蛋白质跨膜拓扑结构预测采用在线程序TMHMM (http://www.cbs.dtu.dk/services/TMHMM)。DNA和蛋白质的序列比对在NC-BI网络服务器 (http://www.ncbi.nlm.nih.gov) 上进行。
1.2.3 CmPP的植物表达载体构建及其烟草遗传转化以质粒pET (CmPP) DNA为模板,利用高保真的Pfu DNA聚合酶和引物CmPP-5Sm、Tt7Dw-Rv将CmPP基因重新扩增出来。目的PCR片段经纯化后通过Sac Ⅰ酶切,然后与经Sma Ⅰ、Sac Ⅰ双酶切的载体pBI121大片段连接,构建成其植物表达载体pBI (CmPP)。重组克隆用载体上游引物35SPro-Fw和CmPP基因下游引物CmPP-3Sc通过菌落PCR鉴定。载体pBI (CmPP) 通过冻融法转化农杆菌LBA4404,转化菌落通过PCR鉴定 (使用引物35SPro-Fw、CmPP-3Sc)。然后,按照常规的农杆菌叶盘侵染法转化烟草。使用试剂盒提取CmPP转化再生烟草植株的基因组总DNA,然后以其为模板通过两对交叉引物 (35SPro-Fw/CmPP-mRv、CmPP-mFw/NosTer-Rv) 进行PCR鉴定,得到CmPP的阳性转基因烟草植株。
1.2.4 CmPP转基因烟草植株的抗旱性分析选取长势一致的烟草幼苗 (包括CmPP转基因株系和野生型),停止浇水5 d后,进行干旱处理:对照 (正常浇水)、中度干旱胁迫 (土壤含水量为其最大持水量的40%,即40% FWC)、重度干旱胁迫 (20% FWC),每天监测土壤含水量,并采用定量灌溉维持各干旱处理的持水量水平。每个处理设两个重复,植株生长30 d后取样测定以下指标:(1) 将处理苗洗净晾干后分开根、茎、叶,称取各部分重量即为鲜重 (FW),然后将各部分在115℃烘箱内杀青15 min后于70℃烘至恒重,称取各部分重量即为干重 (DW),并因此计算出各部分的干重比 (%)。(2) 参考王学奎[17]的方法测定处理苗的叶片总叶绿素含量 (mg·g-1 DW) 和根系活力 (mg·g-1·h-1 DW)。(3) 分别采用硫代巴比妥酸 (TBA) 法和电导仪法测定处理苗的叶片丙二醛 (MDA) 含量 (μmol·g-1 DW) 和电解质渗透率 (%)[17]。数据统计分析采用软件SPSS 11.5,作图采用软件SigmaPlot 12.0。
2 结果 2.1 CmPP的基因克隆以新鲜粪便中提取的人肠道宏基因组总DNA作为模板,经第一轮PCR扩增后,没有检测到预期大小 (约2.3 kb) 的目的PCR条带,但有非特异性较小片段。直接取第一轮PCR产物0.5 μL作模板进行第二轮PCR (巢式扩增),发现有明亮的、大小正确 (约2.1 kb) 的目的基因扩增产物CmPP。而且,CmPP的PCR片段纯化后分别用Nco Ⅰ和EcoR Ⅴ酶切鉴定,结果也与预期完全一致;接着将它通过Nde Ⅰ和Sac Ⅰ双酶切克隆到载体pET32a (+) 中,获得了其阳性重组载体pET (CmPP)。
2.2 CmPP的生物信息学分析对重组质粒pET (CmPP) 进行测序,结果 (图 1) 表明扩增到的CmPP基因含有一个完整的、长2 100 bp的开放阅读框 (ORF),编码一个699 aa的蛋白质 (理论分子量为72.3 kD,等电点为6.14)。与GenBank数据库已有对应序列 (登录号ACEC01000124) 进行比对分析,发现扩增的CmPP基因序列有13个碱基点突变 (绝大多数为T↕C、A→G),但仅造成2个非关键氨基酸的改变 (T365C→L122S、A880T→N294Y)。该基因的G+C含量为59.9 %,碱基分布较均衡。

|
| 图 1 CmPP基因的核苷酸序列及其推导的蛋白序列 阴影黑体字母:CmPP中发生突变的碱基;下划线:两处碱基突变导致两个非关键氨基酸改变 (T365C→L122S、A880T→N294Y);方框:第474位的、决定膜PPase K+依赖性的Ala残基 |
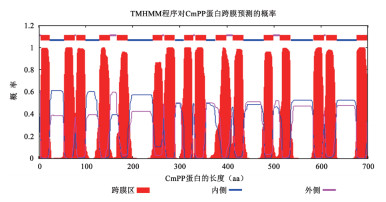
通过在线程序TMHMM对CmPP蛋白进行膜拓扑结构预测分析,发现CmPP是一个由16个跨膜α螺旋组成的膜蛋白,其N端没有信号肽序列,而且两个短末端凸出在外,但背向细胞质侧即外侧 (图 2),这与目前已经鉴定过的膜PPase的一致结构相符合[1, 4]。
|
| 图 2 在线程序TMHMM预测的CmPP蛋白膜拓扑结构 |
以CmPP蛋白序列为检索序列,对NCBI中非冗余蛋白质数据库Nr进行Blastp比对,发现跟CmPP亲缘关系最近的直系同源物是与甲基戊糖梭菌共存于人肠道的厌氧柔嫩梭菌 (Clostridium leptum) 的膜整合焦磷酸酶 (登录号ZP_02078667),它已被鉴定为Na+,H+-PPase[15]。由此推测,CmPP很可能属于Na+,H+-PPase亚家族成员。另外,CmPP蛋白中第474位 (图 1) 是对应于羧热产氢菌 (Carboxydothermus hydrogenoformans) H+-PPase第460位的Ala残基,说明CmPP是K+依赖型膜PPase[5]。
2.3 CmPP转基因烟草植株的获得CmPP基因通过引物对CmPP-5Sm/Tt7Dw-Rv从质粒pET (CmPP) 模板重新扩增出来后,经酶切克隆到植物载体pBI121中,构建成其植物表达载体pBI (CmPP)。由于上游引物CmPP-5Sm中引入了翻译增强元件—kozak序列,理论上应该可以使CmPP在其转基因植株中得到有效表达。
通过农杆菌叶盘侵染法,对植物载体pBI (CmPP) 进行了烟草转化,并获得了大量的再生烟草植株。通过基因组PCR对其中17株进行鉴定,发现两对引物 (35SPro-Fw/CmPPm-Rv、CmPPm-Fw/ NosTer-Rv) 的交叉鉴定结果完全一致:3号、7号、15号植株与野生型烟草一样都没有特异性扩增产物;而其他14株均有明亮的PCR主条带,且大小正确:引物对35SPro-Fw/CmPPm-Rv和CmPPm-Fw/ NosTer-Rv分别能扩增出约1.2 kb (图 3-A) 和1.6 kb (图 3-B) 的DNA条带。这表明17个CmPP转化再生植株中有14个为阳性转基因植株,CmPP农杆菌转化烟草的阳性率达到了82%以上。

|
| 图 3 CmPP转基因烟草植株的PCR鉴定 WT:野生型对照,1-17:17个CmPP转化再生植株;A:引物对35SPro-Fw/CmPPm-Rv;B:引物对CmPPm-Fw/NosTer-Rv;箭头表示目的PCR条带 |
干旱会破坏植物光合系统、造成细胞膜损伤和影响根吸收能力从而抑制植物的生长发育。本研究选取了9号、11号、12号这3个CmPP转基因烟草株系 (分别命名为CmPP-9、CmPP-11、CmPP-12),对其子一代植株进行了抗旱性分析,测定其多个相关生理指标,包括干重比、总叶绿素含量、根系活力、MDA含量和电解质渗漏率。
由图 4可以看出,3个CmPP转基因株系和野生型 (WT) 烟草的根、茎、叶干物质含量在正常浇水 (对照) 条件下各自差异很小,而在干旱胁迫条件下均下降,且随胁迫强度增加而愈加明显,但相同胁迫条件下转基因株系的下降程度显著低于野生型烟草。在中度干旱 (40% FWC) 胁迫条件下,3个转基因株系 (CmPP-9、CmPP-11、CmPP-12) 相比野生型烟草的根干重比依次高出79.3%、69.1%、70.4%,茎干重比依次高出27.4%、22.4%、16.6%,叶干重比依次高出79.3%、78.9%、70.4%;而在重度干旱 (20% FWC) 胁迫条件下,3个转基因株系与野生型烟草的根、茎、叶各部分干物质含量相比对照条件下普遍下降了一半以上,但前者仍然比后者的根干重比依次高出68.3%、67.3%、58.8%,茎干重比依次高出1.2倍、1倍、98.3%,叶干重比依次高出1倍、79.8%、77.8%。

|
| 图 4 CmPP转基因烟草和野生型烟草在干旱胁迫下的干物质含量比较 柱形图上的不同字母代表在P < 0.05水平上的差异显著 (Duncan test) |
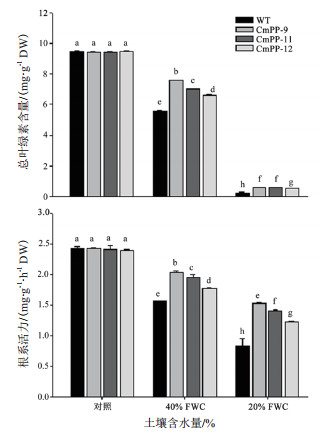
由图 5看出,3个CmPP转基因株系和野生型 (WT) 烟草的总叶绿素含量和根系活力在正常浇水 (对照) 条件下几无差异,而在干旱胁迫条件下均降低,且随胁迫强度增加而愈加严重,但相同胁迫条件下转基因株系的下降程度显著低于野生型烟草。在中度干旱 (40% FWC) 胁迫条件下,3个转基因株系 (CmPP-9、CmPP-11、CmPP-12) 相比野生型烟草的总叶绿素含量依次高出36.1%、26.2%、18.9%,根系活力依次高出29.3%、24.2%、12.1%;而在重度干旱 (20% FWC) 胁迫条件下,3个转基因株系与野生型烟草的总叶绿素含量和根系活力分别下降到不及对照条件下的10%和60%,但前者仍比后者的总叶绿素含量依次高出1.4倍、1.3倍、1.1倍,根系活力依次高出84.3%、68.7%、47.1%。
|
| 图 5 CmPP转基因烟草和野生型烟草在干旱胁迫下的总叶绿素含量和根系活力比较 柱形图上的不同字母代表在P < 0.05水平上的差异显著 (Duncan test) |
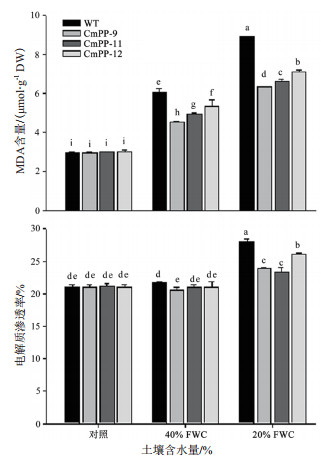
由图 6可以看出,3个CmPP转基因株系和野生型 (WT) 烟草的叶片MDA含量和电解质渗透率在正常浇水 (对照) 条件下没有明显差异,而在干旱胁迫条件下均升高,且随胁迫加剧而呈增加趋势,但相同胁迫条件下转基因株系的升高程度显著低于野生型烟草。在中度干旱 (40% FWC) 胁迫条件下,3个转基因株系 (CmPP-9、CmPP-11、CmPP-12) 相比野生型烟草的MDA含量分别低出25%、18.1%、11.5%,尽管两者的电解质渗透率接近;而在重度干旱 (20% FWC) 胁迫条件下,3个转基因株系与野生型烟草的叶片MDA含量和电解质渗透率分别已升高到对照条件下的2倍和1.2倍以上,但前者仍然比后者的MDA含量依次低出28.8%、25.7%、20.2%,电解质渗透率依次低出14.5%、16.8%、7%。
|
| 图 6 CmPP转基因烟草和野生型烟草在干旱胁迫下的MDA含量和电解质渗透率比较 柱形图上的不同字母代表在P < 0.05水平上的差异显著 (Duncan test) |
另外,3个CmPP转基因株系在中度和重度干旱胁迫条件下的生长均要好于野生型烟草,但随干旱程度加剧受抑制越明显;而对照 (正常浇水) 条件下两者的生长状况相似,且都好于干旱胁迫条件下 (结果未显示)。结合上面抗旱生理测定结果,可以推定CmPP能够显著提高其转基因烟草植株的抗旱能力。
3 讨论膜整合PPase与生物适应逆境密切相关,其一个进化分支形成的H+-PPase亚家族在提高植物诸多抗逆性方面 (如抗盐、干旱、磷氮钾营养缺乏、重金属污染等) 功效均十分突出[6-13];比较其另外两个亚家族Na+-PPase、Na+,H+-PPase由于发现较晚,研究得少,还没有用于提高植物抗逆性的报道。
当前,各种环境生物已广被用来挖掘新的抗逆基因[18-21],而人或其它动物的肠道宏基因组可能是获得Na+-PPase、Na+,H+-PPase基因的理想来源[15]。本研究选定源自甲基戊糖梭菌的膜整合PPase (CmPP),通过PCR直接从人肠道宏基因组中成功克隆到了其全长基因。生物信息学分析显示CmPP是一个具有16个跨膜α螺旋结构并属于K+依赖型的Na+,H+-PPase亚家族成员,具备膜PPase的保守结构特性和Na+-转运PPase共有对K+的依赖特性[1, 4]。但是,可能由于人肠道微生物的多样性和不均一性[22, 23],扩增CmPP基因绝对需要两轮巢式PCR才能成功,这与我们先前从水体宏基因组中扩增一蓝藻基因类似[20]。另外,由于人类宏基因组具有大陆和民族特异性,并受饮食、药物等摄入因子的影响[22],因此本研究扩增到的CmPP基因与GenBank中的对应核苷酸序列 (登录号ACEC01000124) 有一定程度的差异 (但只有2个非关键氨基酸的改变) 是可以理解的。
还有,CmPP基因的G+C含量为59.9%,碱基分布较均衡,不像许多其他类似的膜PPase基因含有高比例AT碱基和容易出现真核基因的聚腺苷化信号。这样,不仅有利于基因扩增,而且也适合于对高等植物的转基因研究。事实上,本研究获得的CmPP转基因烟草具有显著提高的抗旱性,应该是CmPP基因导入表达发挥了作用。
干旱是影响农业生产的重要逆境因子,目前已通过遗传、分子和生化等研究手段鉴定出许多关键基因,功能涉及到胁迫应答转录调节、RNA转录后修饰和蛋白翻译后修饰、渗透保护剂代谢、抗氧化系统、分子伴侣等方面,调控植物在形态和生理水平上对干旱的应答以及抗旱性形成[24, 25]。在这些基因相关的植物抗旱遗传工程研究中,H+-PPase占据重要一席[6-13],目前公认由其介导的植物抗旱性与其酶活性调节液泡渗透功能以及促进生长素极性运输和根系发育有关[7]。生化研究表明已鉴定的Na+,H+-PPase和低Na+条件下的Na+-PPase都具有H+泵活性[15, 16],而属于Na+,H+-PPase家族的CmPP理应具有H+泵活性和与H+-PPase相似的功效。因此,本研究中CmPP基因导入促进烟草抗旱性的提高是合乎预期的。而且,我们发现CmPP也能显著增强其转基因烟草的抗盐性,具备H+-PPase的同样特性[6, 8, 10],这部分结果将在另文报道。我们计划下一步检验CmPP转基因烟草是否具有提高的抗营养 (氮、磷或钾) 贫瘠性。总之,本研究中得到的CmPP基因可为植物尤其是农作物抗逆基因工程研究提供一个新的功能基因选择。
4 结论本研究通过PCR直接从人肠道宏基因组中扩增得到甲基戊糖梭菌膜整合焦磷酸酶基因CmPP。生物信息学分析显示该基因含有一个完整的ORF,推导蛋白CmPP (699 aa) 是一个具有由16个α螺旋组成的跨膜结构、并且属于K+依赖型的Na+,H+-PPase亚家族成员;另外,通过对其转基因烟草植株的抗旱性分析验证了CmPP基因具备提高植物抗旱性的潜力。
| [1] | Baykov AA, Malinen AM, Luoto HH, et al. Pyrophosphate-fueled Na+ and H+ transport in prokaryotes[J]. Microbiol Mol Biol Rev, 2013, 77 (2): 267–276. DOI:10.1128/MMBR.00003-13 |
| [2] | Holm NG, Baltscheffsky H. Links between hydrothermal environments, pyrophosphate, Na+, and early evolution[J]. Orig Life Evol Biosph, 2011, 41 (5): 483–493. DOI:10.1007/s11084-011-9235-4 |
| [3] | Serrano A, Pérez-Casti?eira JR, Baltscheffsky M, et al. H+-PPases: yesterday, today and tomorrow[J]. IUBMB Life, 2007, 59 (2): 76–83. DOI:10.1080/15216540701258132 |
| [4] | Tsai JY, Kellosalo J, Sun YJ, et al. Proton/sodium pumping pyrophosphatases: the last of the primary ion pumps[J]. Curr Opin Struct Biol, 2014, 27 : 38–47. DOI:10.1016/j.sbi.2014.03.007 |
| [5] | Belogurov GA, Lahti R. A lysine substitute for K+. A460K mutation eliminates K+ dependence in H+-pyrophosphatase of Carboxydothermus hydrogenoformans[J]. J Biol Chem, 2002, 277 (51): 49651–49654. DOI:10.1074/jbc.M210341200 |
| [6] | Gaxiola RA, Sanchez CA, Paez-Valencia J, et al. Genetic manipulation of a "vacuolar" H+-PPase: from salt tolerance to yield enhancement under phosphorus-deficient soils[J]. Plant Physiol, 2012, 159 (1): 3–11. DOI:10.1104/pp.112.195701 |
| [7] | Schilling RK, Tester M, Marschner P, et al. AVP1: one protein, many roles[J]. Trends Plant Sci, 2017, 22 (2): 154–162. DOI:10.1016/j.tplants.2016.11.012 |
| [8] | Pasapula V, Shen G, Kuppu S, et al. Expression of an Arabidopsis vacuolar H+-pyrophosphatase gene (AVP1) in cotton improves drought-and salt tolerance and increases fibre yield in the field conditions[J]. Plant Biotechnol, 2011, 9 (1): 88–99. DOI:10.1111/pbi.2010.9.issue-1 |
| [9] | Wei A, He C, Li B, et al. The pyramid of transgenes TsVP and BetA effectively enhances the drought tolerance of maize plants[J]. Plant Biotechnol, 2011, 9 (2): 216–229. DOI:10.1111/pbi.2010.9.issue-2 |
| [10] | Bao AK, Wang SM, Wu GQ, et al. Overexpression of the Arabidopsis H+-PPase enhanced resistance to salt and drought stress in transgenic alfalfa (Medicago sativa L.)[J]. Plant Sci, 2009, 176 (2): 232–240. DOI:10.1016/j.plantsci.2008.10.009 |
| [11] | Yang H, Knapp J, Koirala P, et al. Enhanced phosphorus nutrition in monocots and dicots over-expressing a phosphorus-responsive type Ⅰ H+-pyrophosphatase[J]. Plant Biotechnol, 2007, 5 (6): 735–745. DOI:10.1111/pbi.2007.5.issue-6 |
| [12] | Paez-Valencia J, Sanchez-Lares J, Marsh E, et al. Enhanced proton translocating pyrophosphatase activity improves nitrogen use efficiency in Romaine lettuce[J]. Plant Physiol, 2013, 161 (3): 1557–1569. DOI:10.1104/pp.112.212852 |
| [13] | Khoudi H, Maatar Y, Gouiaa S, et al. Transgenic tobacco plants expressing ectopically wheat H+-pyrophosphatase (H+-PPase) gene TaVP1 show enhanced accumulation and tolerance to cadmium[J]. J Plant Physiol, 2012, 169 (1): 98–103. DOI:10.1016/j.jplph.2011.07.016 |
| [14] | Luoto HH, Belogurov GA, Baykov AA, et al. Na+-translocating membrane pyrophosphatases are widespread in the microbial world and evolutionarily precede H+-translocating pyrophosphatases[J]. J Biol Chem, 2011, 24 : 21633–21642. |
| [15] | Luoto HH, Baykov AA, Lahti R, et al. Membrane-integral pyrophosphatase subfamily capable of translocating both Na+ and H+[J]. Proc Natl Acad Sci USA, 2013, 110 (4): 1255–1260. DOI:10.1073/pnas.1217816110 |
| [16] | Luoto HH, Nordbo E, Baykov AA, et al. Membrane Na+-pyrophosphatases can transport protons at low sodium concentrat-ions[J]. J Biol Chem, 2013, 49 : 35489–35499. |
| [17] | 王学奎. 植物生理生化实验原理和技术[M]. 第2版. 北京: 高等教育出版社, 2006. |
| [18] | Guazzaroni ME, Morgante V, Mirete S, et al. Novel acid resistance genes from the metagenome of the Tinto River, an extremely acidic environment[J]. Environ Microbiol, 2013, 15 (4): 1088–1102. DOI:10.1111/emi.2013.15.issue-4 |
| [19] | Kapardar RK, Ranjan R, Grover A, et al. Identification and characterization of genes conferring salt tolerance to Escherichia coli from pond water metagenome[J]. Bioresour Technol, 2010, 101 (11): 3917–3924. DOI:10.1016/j.biortech.2010.01.017 |
| [20] | 刘畅, 罗著, 张梦如, 等. 蓝藻橙色类胡萝卜素蛋白的基因克隆及在大肠杆菌中的异源表达和功能分析[J]. 生物技术通报, 2016, 32(7): 138–145. |
| [21] | Culligan EP, Marchesi JR, Hill C, et al. Mining the human gut microbiome for novel stress resistance genes[J]. Gut Microbes, 2012, 3 (4): 394–397. DOI:10.4161/gmic.20984 |
| [22] | Arumugam M, Raes J, Pelletier E, et al. Enterotypes of the human gut microbiome[J]. Nature, 2011, 473 (7346): 174–180. DOI:10.1038/nature09944 |
| [23] | Gill SR, Pop M, Deboy RT, et al. Metagenomic analysis of the human distal gut microbiome[J]. Science, 2006, 312 (5778): 1355–1359. DOI:10.1126/science.1124234 |
| [24] | Hu H, Xiong L. Genetic engineering and breeding of drought-resistant crops[J]. Annu Rev Plant Biol, 2014, 65 : 715–741. DOI:10.1146/annurev-arplant-050213-040000 |
| [25] | Yang S, Vanderbeld B, Wan J, et al. Narrowing down the targets: towards successful genetic engineering of drought-tolerant crops[J]. Mol Plant, 2010, 3 (3): 469–490. DOI:10.1093/mp/ssq016 |