药用植物长春花(Catharanthus roseus)为夹竹桃科(Apocynaceae)植物,是长春花属(Catharanthus)的一种多年生草本植物。长春花中的单萜吲哚生物碱文朵灵和长春质碱作为抗肿瘤药物具有重要的临床应用价值[1]。但由于植物体内含量只有千分之几[2],因此如何提高长春花中次生代谢产物的含量一直备受关注。植物激素能够显著促进次生代谢产物的积累[3, 4],并且研究表明,茉莉酸(Jasmonic acid,JA)作为信号分子能够促进长春花中的次生代谢产物文朵灵和长春质碱的合成[5, 6]。而JA需要在茉莉酸-异亮氨酸(JA-Ile)合成酶(JAR1) 的作用下形成JA与异亮氨酸聚合物[7],进而通过与下游受体蛋白作用实现JA信号的级联放大[8],而长春花中的JAR1基因以及功能研究尚无报道。因此,本文利用分子克隆手段、瞬时表达技术将长春花中JAR1基因通过构建重组质粒,经农杆菌介导转化长春花叶片,并分析其对长春花中文朵灵和长春质碱合成途径关键酶基因的转录水平以及代谢产物的积累的影响,以期通过调控JA信号通路进而实现促进长春花中文朵灵和长春质碱的生物合成。
1 材料与方法 1.1 材料 1.1.1 菌种与植物材料根瘤农杆菌GV3101与长春花种子为本实验室保藏;植物激素JA、长春质碱和文朵灵的标准品均购买于阿拉丁;pGM-T载体购自天根生化科技有限公司;农杆菌GV3101购自上海迈其生物科技有限公司;RNA提取所需的TRNzol Reagent试剂,降解RNA中的DNA试剂RNase free DNase Ⅰ,反转录所需的TIAN Script M-MLV反转录酶,PCR所需要的Taq DNA Polymerase DNA聚合酶,普通琼脂糖凝胶DNA回收试剂盒均来自天根生化科技有限公司;限制性内切酶购自宝生物;琼脂糖凝胶来自美国Promega公司。其他分析纯试剂来自国产。
1.1.2引物序列见表 1。
选取新鲜的长春花叶片组织与2粒经过DEPC水处理的氧化锆珠子放入2 mL离心管后经高通量组织研磨仪进行组织破碎。破碎后的长春花叶片经TRIzol法提取总RNA。并以此RNA为模板,经DNaseⅠ处理后反转录合成cDNA备用。
1.2.2 JAR1基因扩增以及重组质粒构建根据与拟南芥中同源序列比对,在长春花转录组数据库中获取长春花JAR1基因序列。并依据此序列设计引物(表 1),利用巢式PCR方法扩增JAR1基因。胶回收纯化目的基因,加A尾后连接至pGM-T载体中并转化大肠杆菌感受态细胞,经蓝白斑筛选及PCR鉴定阳性克隆。选择阳性克隆扩大培养提取质粒,然后利用Kpn Ⅰ与Sac Ⅰ进行双酶切,酶切所得的基因目的片段与同样经Kpn Ⅰ与Sac Ⅰ双酶切的双元载体pBIGD连接,转化大肠杆菌感受态细胞,获得表达载体pBIGD-JAR1。阳性克隆经PCR、酶切鉴定后测序。
1.2.3 农杆菌转化与鉴定将活化好的农杆菌GV3101挑取单菌落在50 mL的LB培养基中过夜培养。过夜培养的菌体冰上预冷后离心去上清,菌体中加入1 mL预冷的20 mmol/L CaCl2及50 μL DMSO轻轻混匀,悬浮菌体。冰上分装后,分别将取2 μL质粒pBIGD、pBIGD-JAR1加入并混匀,在液氮中冷冻5 min后,置于37℃培养箱内5 min。再加入1 mL新鲜LB培养基,180 r/min,30℃培养2 h。离心、去掉大部分上清,菌体混匀后涂到含抗生素的LB平板上,28℃倒置培养过夜。分别使用特定引物PCR鉴定阳性克隆。
1.2.4 农杆菌介导的瞬时转化挑选成功转化质粒的GV3101单菌落扩大培养,离心收集菌体,用10 mL缓冲液(MES 20 mmol/L,MgCl2 10 mmol/L,Acetosyringone 200 µmol/L,pH 5.6) 悬浮细胞,并在28℃下、180 r/min震荡3 h。然后通过注射方法侵染长春花茎尖分生组织。将处理过的植物放置于25℃恒温光照培养箱,光照条件为16 h光照/8 h黑暗,培养3-4周后收集农杆菌侵染部位上方叶片进行下一步的分析。
1.2.5 JAR1瞬时表达鉴定以及长春花合成途径关键酶基因的半定量RT-PCR分析农杆菌介导的瞬时转化处理后3周左右,即第三对新叶长出,选取新生长的3对叶片,左侧叶片用来提取总RNA检测关键酶基因的转录水平,右侧叶片用于分析次级代谢产物长春质碱和文朵灵。长春花中文朵灵与长春质碱合成途径如图 1所示。利用特定引物对JAR1以及文朵灵和长春质碱生物合成途径的关键酶基因CrDL7H、CrLAMT、CrTDC、CrG10H、CrSTR进行半定量RT-PCR,使用引物如表 1所示,并通过Image J软件进行定量分析。
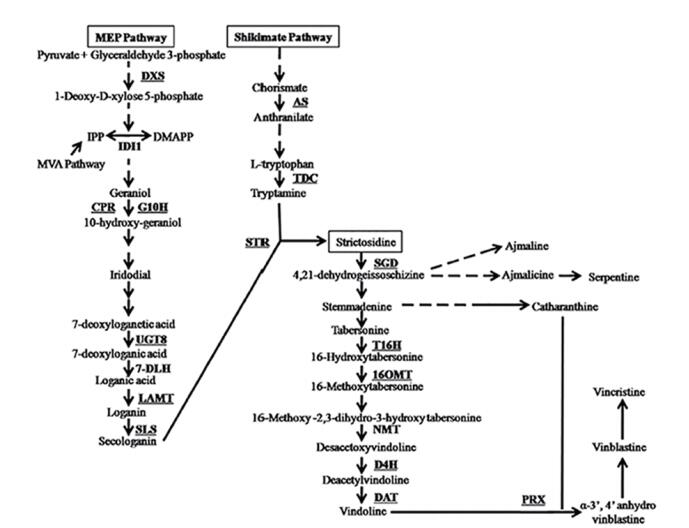
|
| 图 1 长春花中文朵灵与长春质碱合成途径[4] 1-脱氧-D-木酮糖-5-磷酸盐合酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS);异戊烯焦磷酸(isopentenyl pyrophosphate,IPP);二甲基烯丙基焦磷酸酯(Dimethylallyl pyrophosphate,DMAPP); 异戊烯基焦磷酸异构酶(Isopentenyl diphosphate isomerase 1,IDI1);细胞色素p450还原酶(Cytochrome P450 reductase,CPR);香叶醇-10-羟化酶(Geraniol 10-hydroxylase,G10H);UDP-糖葡糖基转移酶(8UDP-sugar glucosyltransferase 8,UGT8);7-脱氧马钱苷酸-7-羟化酶(7-deoxyloganic acid 7-hydroxylase,7-DLH);马钱苷酸甲基转移酶(Loganic acid O-methyltransferase,LAMT);断马钱子苷合酶(Secologanin synthase,SLS);邻氨基苯甲酸合酶(Anthranilate synthase,AS);色氨酸脱羧酶(Tryptophan decarboxylase,TDC);异胡豆苷合成酶(Strictosidine synthase,STR);异胡豆苷葡糖苷酶(Strictosidine glucosidase,SGD);水甘草碱16羟化酶(Tabersonine 16-hydroxylase,T16H);羟化水甘草碱O甲基转移酶(16-hydoxytabersonine-O-methyltransferase,16OMT);(N甲基转移酶)N-methyltransferase,NMT);脱乙酰氧基文朵灵-4-羟化酶(Desacetoxyvindoline-4-hydroxylase,D4H);脱乙酰氧基文朵灵-4-o-乙酰转移酶(Deacetylvindoline-4-O-acetyltransferase,DAT)£»液泡类的三型过氧化酶(Vacuolar class Ⅲ peroxidase,PRX) |
将收集的右侧叶片分别放到对应的2 mL离心管内,计算湿重。在每个离心管加入2粒氧化锆珠子并经高通量组织研磨仪进行组织破碎。通过甲醇浸泡与超声处理,离心收集上清。重复萃取3次,合并上清液。将收集的甲醇提取液经冷冻浓缩离心干燥至干粉。然后加入1 mL甲醇溶解(超声)。将甲醇溶液经0.22 μm滤膜过滤后,液相色谱分析文朵灵及长春质碱的含量。液相条件为C18色谱柱,流动相为乙腈(V):水(V)=30%:70%,检测波长310 nm(文朵灵)与280 nm(长春质碱),流速1 mL/min,进样量10 μL,柱温为30℃。根据标准曲线以及样品的峰面积计算文朵灵和长春质碱含量。
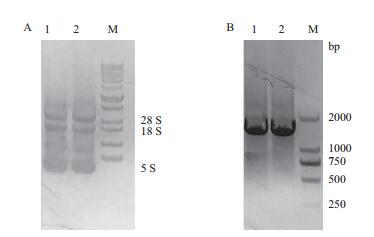
2 结果 2.1 长春花叶片总RNA提取与目的基因的扩增利用TRIzol法提取长春花叶片的总RNA(图 2-A),用于目的基因的扩增。RNA经DNase Ⅰ处理好反转录成cDNA,并以其为模板利用特异性引物扩增目的片段,如图 2-B中1和2所示,产生了片段大小为1 758 bp以及500-700 bp大小的非特异性条带,根据序列分析1 758 bp大小条带为JAR1基因。
|
| 图 2 长春花叶片总RNA(A)与JAR1的PCR扩增结果(B) A:1和2均为长春花叶片为材料提取的总RNA,M为DL5000 DNA分子量maker;B:1和2均为JAR1基因的PCR扩增产物,M为DL2000 DNA分子量maker |
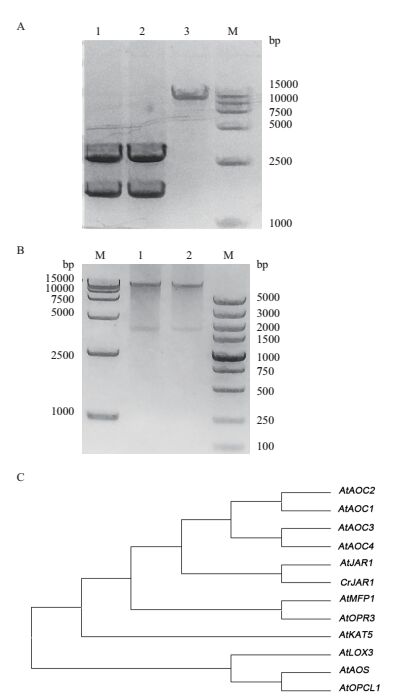
为了研究JAR1在植物体内的功能,我们选择了pBIGD植物双元载体构建重组质粒。首先将扩增的目的基因片段,加A尾后连接pGM-T载体上,转化并鉴定单克隆。如图 3-A,1、2均为pGMT-JAR1酶切(Kpn Ⅰ / Sac Ⅰ)的鉴定结果,获得了pGM-T载体与目的基因两个片段。将酶切获得的JAR1目的基因与同样经Kpn Ⅰ / Sac Ⅰ酶切的pBIGD载体(图 3-A,第三泳道)连接并转化大肠杆菌感受态细胞。提取质粒后酶切鉴定阳性克隆,如图 3-B中1和2所示,获得大小为1 758 bp左右JAR1基因,并将其送测序。经序列比对一致,表明重组质粒构建成功。序列比对结果如图 3-C所示,经核酸序列比对以及进化分析,发现CrJAR1与拟南芥中的JAR1即AtJAR1具有极高同源性。
|
| 图 3 pBIGD-JAR1重组质粒构建与进化树分析 A:1和2均为pGMT-JAR1的酶切(Kpn Ⅰ / Sac Ⅰ)结果;3为pBIGD酶切(Kpn Ⅰ / Sac Ⅰ)结果;M为DL15000 DNA maker;B:1和2为pBIGD-JAR1酶切(Kpn Ⅰ / Sac Ⅰ)结果;M为DL15000 DNA maker与DL5000 maker;C:CrJAR1测序结果与拟南芥中的JAR1基因、茉莉酸生物合成途径关键酶基因的序列比对以及进化树分析。AtAOC1(allene oxide cyclase 1,AT3G25760);AtAOC2(allene oxide cyclase 2,AT3G25770)、AtAOC3(allene oxide cyclase 3,AT3G25780);AtAOC4(allene oxide cyclase 4,AT1G13280);AtMFP1(multifunctional protein 1,AT3G16000);AtOPR3(oxophytodienoate reductase 3,AT2G06050);AtKAT5(3-ketoacyl-CoA thiolas,AT5G48880);AtLOX3(lipoxygenase,AT1G17420);AtAOS(allene oxide synthase,AT5G42650);AtOPCL1(OPC-8:CoA ligase 1,AT1G20510)为拟南芥中茉莉酸合成途径关键酶基因,AtJAR1(jasmonate-amido synthetase,AT2G46370)为拟南芥中JAR1基因,CrJAR1为长春花中的调取的JAR1基因的测序结果 |
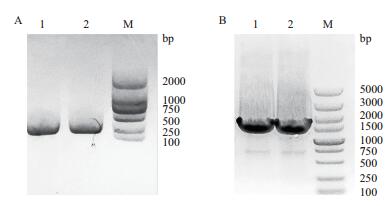
分别设置了空载体pBIGD作为对照组以及pBIGD-JAR1作为实验组,将两组质粒分别转入农杆菌GV3101中,转化结果分别利用PCR进行鉴定。如图 4-A所示,1、2泳道为pBIGD-JAR1,图 4-B的1、2泳道为pBIGD。结果表明,实验组和对照组质粒成功转入农杆菌GV3101中。
|
| 图 4 农杆菌转化的克隆PCR鉴定 A:1、2为pBIGD的PCR鉴定结果,M为DL2000 DNA maker;B:1、2为pBIGD-JAR1的PCR鉴定结果;M为DL5000 DNA maker |
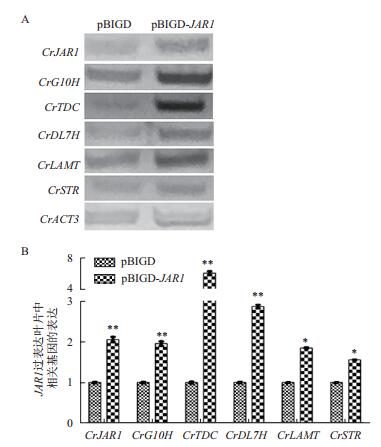
我们将实验组(pBIGD-JAR1)和对照组(pBIGD)农杆菌扩大培养后,侵染长春花茎尖分生组织,待植物长出新的3对叶片后,分别收集叶片。所收集的左右叶片分别用于RNA的提取以及次生代谢产物的提取。首先,为了分析农杆菌瞬时转化是否实现了JAR1过表达,我们提取了左侧叶片的总RNA,并利用半定量RT-PCR分析JAR1基因的表达水平。如图 5-A和5-B所示,与空载体相比,JAR1瞬时表达的叶片中,JAR1基因的转录水平确实显著提高,表明本实验成功实现了在长春花叶片中JAR1基因的过表达。同时,为了分析JAR1是否影响长春花中文朵灵和长春质碱合成途径关键酶基因的表达,检测了长春花中文朵灵和长春质碱合成途径以及关键酶基因CrDL7H、CrLAMT、CrTDC、CrG10H和CrSTR的转录水平,结果(图 5-A、图 5-B)显示,所选取基因的转录水平与空载体相比较均有很大程度的提高。
|
| 图 5 瞬时过表达JAR1基因叶片中的表达水平检测以及对长春花中文朵灵和长春质碱的合成途径关键酶基因转录水平的影响 A:半定量RT-PCR对瞬时过表达JAR1基因长春花叶片中的表达水平检测以及对中文朵灵和长春质碱的合成途径关键酶基因转录水平的影响;B:利用Image J进行灰度值的定量分析。CrG10H:geraniol 10-hydroxylase;CrLAMT:马钱苷酸甲基转移酶(S-adenosyl-L -methionine:loganic acid methyltransferase);CrSTR:异胡豆苷合成酶(strictosidine synthase);CrTDC:色氨酸脱羧酶(tryptophan decarboxylase);CrDL7H:7-脱氧马钱苷酸-7-羟化酶(7-deoxyloganic acid 7-hydroxylase);CrACT3为内参,实验中我们选取对照组和实验组各3个重复生物学样本进行分析,* P<0.05,** P<0.01 |
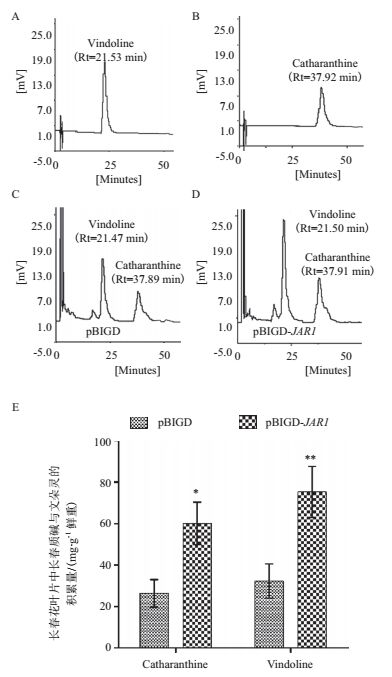
为了分析JAR1过表达是否能够促进长春花中文朵灵和长春质碱合成的积累,将与左侧叶片相对应的右侧叶片利用甲醇提取生物碱,并利用高效液相检测了瞬时表达JAR1长春花叶片中两种次生代谢物的含量。结果如图 6所示,同空载体对照相比,长春质碱与文朵灵的含量都有显著提高。推测JAR1的过表达,提高了共轭物JA-Ile的合成,进而诱发了JA信号转导途径,诱导长春花中单萜吲哚生物碱生物合成途径酶基因的表达,最终促进了次生代谢产物文朵灵和长春质碱积累。
|
| 图 6 JAR1过表达对长春花中文朵灵和长春质碱积累的影响 A、B:分别为文朵灵与长春质碱标准品(200 mg/L)HPLC检测;C、D:分别为实验组与对照组样品中两者组分的HPLC检测;E JAR1过表达长春花叶片中文朵灵和长春质碱积累量(* P<0.05,** P<0.01) |
植物体内激素对次生代谢的调节报道较多集中在受体下游的信号转导途径[9],而对于其上游的信号途径的开关关注较少。众所周知,JA对许多药用植物次生代谢产物的积累都具有一定促进作用。JA行使功能通常以Me-JA和JA-Ile[7]的形式来实现的。研究发现,JAR1是一种茉莉酸-异亮氨酸(JA-Ile)合成酶,被认为是拟南芥中JA信号转导所必须的[8]。合成的JA-Ile与受体蛋白结合,进而启动JA应答反应。
目前长春花JAR1及其功能尚无报道,我们根据拟南芥JAR1基因序列与长春花转录组数据库比对获得长春花JAR1基因序列,并设计特异性引物,扩增目的基因,经测序及与拟南芥JAR1序列比对,同源性高达82%。将长春花JAR1基因进一步克隆至植物双元表达载体pBIGD中,并利用农杆菌GV3101介导侵染长春花茎尖分生组织。经半定量RT-PCR分析,瞬时转化的长春花叶片中JAR1基因的转录水平有明显的提高。
长春花中单萜吲哚生物碱的合成途径已经基本明确,其中有两条重要的途径:分别为吲哚途径(Indole pathway)和类萜途径(Monoterpenoid pathaway)。在吲哚途径中,经多步酶促反应产生色胺(Trytamine),其中最重要的反应为L-色氨酸在色氨酸脱羧酶(Tryptophan decar-boxylase,TDC)催化作用下由色氨酸(Tryptophan)生成色胺(Trytamine)。在类萜途径中经由牻牛儿醇10-羟化酶(Geraniol 10-hydroxylase,G10H),7-脱氧马钱苷酸-7-羟化酶DL7H(7-deoxyloganic acid 7-hydroxylase)、马钱苷酸甲基转移酶(LAMT:loganic acid O-methyltransferase)等酶催化产生裂环马钱子苷(Secologanin)[10]。然后,色胺与裂环马钱子苷在异胡豆苷合成酶(Strictosi-dinesynthase,STR)的催化下偶合生成长春花所有单萜吲哚生物碱的共同前体物质异胡豆苷(Stritosidine),进而生成文朵灵、长春质碱、长春碱和长春新碱等生物碱类化合物[11, 12]。实验中我们选取了长春花中文朵灵和长春质碱的合成途径关键酶基因CrDL7H、CrLAMT、CrTDC、CrG10H以及CrSTR用来分析JAR1过表达对这些关键基因转录水平的影响。同时,利用高效液相检测长春质碱和文朵灵的积累情况。结果证明,JAR1基因在长春花中的过表达能够显著提高合成途径中CrTDC、CrG10H、CrDL7H等基因的转录水平,进而大幅度地促进了长春花中文朵灵和长春质碱的积累。
4 结论成功克隆了长春花JAR1基因,并成功利用农杆菌介导实现JAR1在长春花叶片中的过表达。利用半定量RT-PCR和高效液相色谱分析JAR1对长春花中单萜吲哚生物碱合成途径酶基因表达的影响以及对文朵灵和长春质碱积累的影响。结果表明,JAR1基因在长春花中的过表达,能够显著提高合成途径中关键酶基因CrTDC、CrG10H、CrDL7H、CrSTR和CrLAMT的表达,促进文朵灵和长春质碱的积累。
| [1] | Nejat N, Valdiani A, Cahill D, et al. Ornamental exterior versus therapeutic interior of Madagascar periwinkle(Catharanthus roseus):the two faces of a versatile herb[J]. Scientific World Journal, 2015 : 982412. |
| [2] | 邢世海, 王荃, 潘琪芳, 等. 长春花萜类吲哚生物碱的生物合成途径[J]. 西北植物学报, 2012, 32(9): 1917–1927. |
| [3] | Zhu X, Zeng X, Sun C, Chen S. Biosynthetic pathway of terpenoid indole alkaloids in Catharanthus roseus[J]. Frontiers of Medicine, 2014, 8 (3): 285–293. DOI:10.1007/s11684-014-0350-2 |
| [4] | Pandey SS, Singh S, Babu CS, et al. Fungal endophytes of Catharanthus roseus enhance vindoline content by modulating structural and regulatory genes related to terpenoid indole alkaloid biosynthesis[J]. Scientific Reports, 2016, 6 : 26583. DOI:10.1038/srep26583 |
| [5] | Goldhaber-Pasillas GD, Mustafa NR, Verpoorte R. Jasmonic acid effect on the fatty acid and terpenoid indole alkaloid accumulation in cell suspension cultures of Catharanthus roseus[J]. Molecules, 2014, 19 : 10242–10260. DOI:10.3390/molecules190710242 |
| [6] | He L, Yang L, Tan R, et al. Enhancement of vindoline production in suspension culture of the Catharanthus roseus cell line C20hi by light and methyl jasmonate elicitation[J]. Anal Sci, 2011, 27 (12): 1243–1248. DOI:10.2116/analsci.27.1243 |
| [7] | Staswick PE, Tiryaki I. The oxylipin signal jasmonic acid is activated by an enzyme that conjugates it to isoleucine in Arabidopsis[J]. The Plant Cell, 2004, 16 (8): 2117–2127. DOI:10.1105/tpc.104.023549 |
| [8] | Mosblech A, Thurow C, Gatz C, et al. Jasmonic acid perception by COI1 involves inositol polyphosphates in Arabidopsis thaliana[J]. The Plant Journal, 2011, 65 (6): 949–957. DOI:10.1111/tpj.2011.65.issue-6 |
| [9] | Pan Q, Wang Q, Yuan F, et al. Overexpression of ORCA3 and G10H in Catharanthus roseus plants regulated alkaloid biosynthesis and metabolism revealed by NMR-metabolomics[J]. PLoS One, 2012, 7 (8): e43038. DOI:10.1371/journal.pone.0043038 |
| [10] | Salim V, Yu F, Altarejos J, et al. Virus-induced gene silencing identifies Catharanthus roseus 7-deoxyloganic acid-7-hydroxylase, a step in iridoid and monoterpene indole alkaloid biosynthesis[J]. The Plant Journal, 2013, 76 : 754–765. DOI:10.1111/tpj.12330 |
| [11] | Verma M, Ghangal R, Sharma R, et al. Transcriptome analysis of Catharanthus roseus for gene discovery and expression profiling[J]. PLoS One, 2014, 9 (7): e103583. DOI:10.1371/journal.pone.0103583 |
| [12] | Miettinen K, Dong L, Navrot N, et al. The seco-iridoid pathway from Catharanthus roseus[J]. Nat Commun, 2014, 5 : 3606. |





