2. 浙江海洋大学海洋科学与技术学院,舟山 316022;
3. 四川农业大学动物科技学院,雅安 625014
2. Marine Science and Technology College, Zhejiang Ocean University, Zhoushan 316022;
3. College of Animal Science and Technology, Sichuan Agricultural University, Ya'an 625014
大西洋鲑(Salmo salar),属于鲑科(salmoni-dae)、鲑属(Salmo),20世纪60年代在挪威人工养殖成功,目前已经成为世界性的养殖鱼类,主要以海水网箱的形式养殖生产商品鱼[1]。国内大西洋鲑养殖产量较低,但以其为原料制作的三文鱼刺身、烟熏三文鱼及其它加工产品等很受消费者欢迎,在我国水产品市场上称为“挪威三文鱼”,销售价格较高。
虹鳟(Oncorhynchus mykiss),属于鲑科(Salm-onidae)、大马哈鱼属(Oncorhynchus),自19世纪起在美国开始淡水养殖,我国曾从朝鲜、美国、日本等国多次引种,目前在20多个省市区都有人工养殖,是国内养殖范围较广的冷水鱼类[1]。目前市场上存在部分不法经营者使用虹鳟来冒充大西洋鲑[2, 3],向虹鳟饲料中添加色素,使原本为白色、青色的虹鳟肉呈现出类似大西洋鲑的橘红色泽和纹理,伪称进口的“挪威三文鱼”高价销售,严重侵害消费者权益。因此,迫切需要建立快速准确的检测手段,用于大西洋鲑和虹鳟的物种鉴定。
随着分子生物学技术的发展,以聚合酶链式反应(Polymerase chain reaction,PCR)为基础的DNA分析成为目前物种鉴定方法的主流。例如,DNA条形码技术[4-6]和荧光定量PCR[7-9]等。但DNA条形码技术需要对PCR扩增产物进行测序,成本高且耗时较长;荧光定量PCR对设备和操作水平的要求较高。本研究致力于开发用于大西洋鲑和虹鳟物种鉴定的新型检测方法,将PCR反应与电化学生物传感检测技术[10-12]结合起来,通过物种特异性DNA片段的扩增和产物循环伏安信号检测,实现准确、灵敏、快捷、清洁无污染的水产品物种鉴定。
1 材料与方法 1.1 材料大西洋鲑、虹鳟成鱼:采自山东东方海洋科技股份有限公司、通威三文鱼有限公司、北京卧佛山庄养殖有限公司;冰鲜三文鱼刺身:购自北京岳各庄水产品市场;冷冻和加工三文鱼产品:购自京东商城;海洋动物基因组DNA提取试剂盒:天根生化科技有限公司;Taq DNA聚合酶、dNTP:美国Thermo Fisher公司;RNA酶A、Al2O3、纳米金(粒径30 nm,柠檬酸钠还原氯金酸法制备)溶液、殖-硫辛酸、EDC/NHS羧基活化液、亲和素:美国Sigma-Aldrich公司;所有引物均由上海生工公司合成;实验使用去离子水;化学试剂均为分析纯。
1.2 方法 1.2.1 生物信息学分析大西洋鲑和虹鳟基因组数据检索在NCBI(www.ncbi.nlm.nih.gov)的基因和核酸数据库中进行,序列相似性比对使用NCBI在线BLAST工具和CLC Genomics Workbench软件完成,引物设计使用Primer 3软件完成。
1.2.2 电极表面修饰使用Al2O3粉末抛光金圆盘电极(直径3 mm),分别用乙醇和去离子水在超声条件下清洗电极表面各10 min,在0.5 mol/L硫酸中进行循环伏安扫描,初始电位-200 mV,折回电位+1 500 mV,扫描速率100 mV/s,至循环伏安图不再变化为止。浸入纳米金溶液,+1.55 V电位下沉积15 min,静置5 min,去离子水清洗。
电极表面浸入含10 mmol/L α-硫辛酸的乙醇溶液活化20 min,移入浓度为100 g/L的EDC/NHS混合液活化羧基,向电极表面滴加0.2 g/L的亲和素50 μL,偶联30 min,去离子水洗脱未结合亲和素。保存于4℃,pH 7.0磷酸缓冲液中。
1.2.3 基因组DNA提取与扩增取成鱼鳍条,或加工水产品待测样品约100 mg,使用海洋动物基因组DNA提取试剂盒,按照说明书步骤提取基因组DNA,溶于灭菌去离子水,RNA酶A处理去除RNA污染。使用NanoVue plus紫外分光光度计(美国GE)测定浓度,并调整DNA浓度在100 ng/μL左右。
定制合成引物序列如表 1所示。以2.0 μL基因组DNA为模板,使用Applied Biosystems Veriti 96孔PCR仪(美国Thermo Fisher)分别扩增大西洋鲑特异性引物、虹鳟特异性引物和鲑鳟通用引物,PCR反应程序为:(1)94℃,1 min;(2)94℃,30 s;(3)60℃,30 s;(4)72℃,90 s,返回步骤(2),25个循环;(5)72℃,10 min;(6)4℃至反应终止。
取20 μL PCR扩增产物,无需纯化,分别滴加在修饰有生物素的金电极表面,37℃温育30 min。将DNA修饰电极浸入pH 7.0 Tris-EDTA缓冲液,洗脱5 min,换新的缓冲液重复洗脱2次。
采用三电极测试系统,以DNA修饰电极为工作电极,铂丝(直径1 mm)为对电极,Ag/AgCl为参比电极,20 mL pH 7.0磷酸缓冲溶液为支持电解质,使用283A电化学工作站(美国EG & G)测定循环伏安曲线,初始电位设为0 mV,折回电位设为+ 600 mV,扫描速度设为50 mV/s,记录3个循环中的第3个。
1.2.5 琼脂糖凝胶电泳对照基因组DNA提取与扩增步骤与1.4相同,PCR反应程序中步骤(4) 改为35个循环。使用含0.5 μg/mL溴化乙锭的1.5%琼脂糖凝胶,在PowerPac电泳仪(美国BIO-RAD)上电泳检测PCR扩增产物,90 V,30 min。
2 结果 2.1 物种特异性序列的筛查和引物设计在NCBI基因数据库中检索获得大西洋鲑(Gene ID:100195613) 和虹鳟(Gene ID:100329203) 肌红蛋白(Myoglobin,mb)基因信息,将其与全基因组测序数据比对获得相应基因组序列,其中大西洋鲑mb基因位于序列Accession NO:AGKD04001111.1的46 021-54 000碱基(base pair,bp)位置,共计7 980 bp,虹鳟mb基因位于序列Accession NO:FR908943.1的1-8 040碱基位置,共计8 040 bp。
序列相似性比对结果显示,两条序列中长度为9 736 bp的区域为同源性序列,同源区序列一致性(identity)为82.9%,缺失(Gap)比例为10.0%,其中存在3个序列差异较大的区域:在虹鳟2 134-2 286 bp区间,两个物种序列长度相似,但序列一致性仅为37.1%;在虹鳟3 832-3 807 bp区间,大西洋鲑存在72 bp缺失;在虹鳟5 536-5 537 bp区间,大西洋鲑存在108 bp插入。因此,物种特异性引物主要在这3段差异序列区设计,大西洋鲑和虹鳟通用引物则在序列保守区设计,引物序列和修饰信息见表 1,引物的位置和序列保守性见图 1-图 3。

|
| 图 1 大西洋鲑特异性引物的基因组位置比对图 序列右侧数字表示该序列在两个物种肌红蛋白基因上的位置,箭头指示引物方向(5'-3')(下同) |

|
| 图 2 虹鳟特异性引物的基因组位置比对图 |

|
| 图 3 鲑鳟通用引物的基因组位置比对图 |
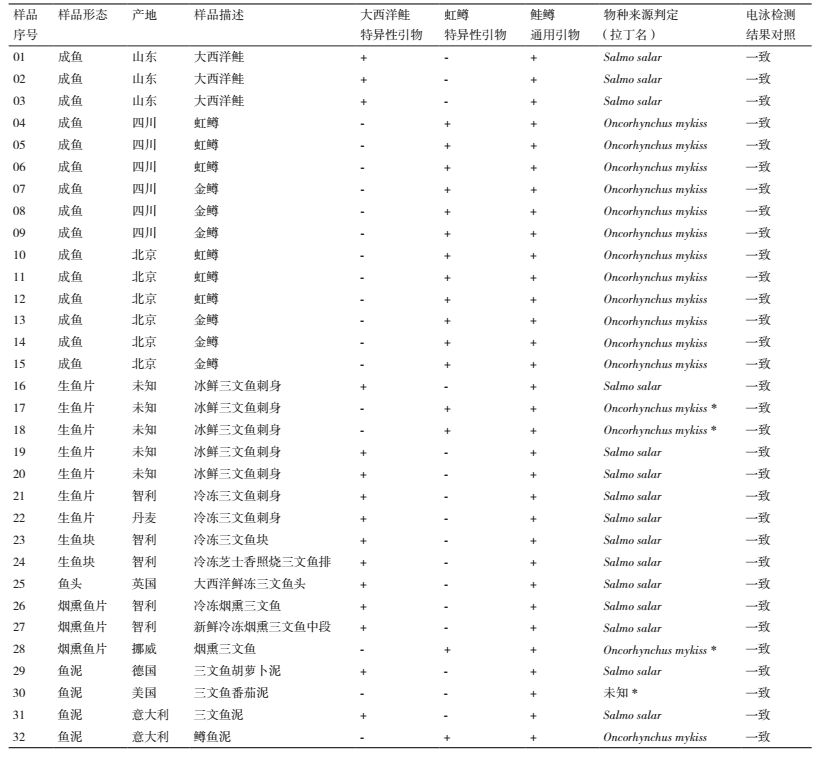
本研究设计的用于鉴别大西洋鲑和虹鳟的电化学生物传感检测流程如图 4所示:(1) 首先对待测样品进行DNA提取,后续PCR反应对模板DNA质量要求不高,因而使用各种常规DNA提取方法如酚-氯仿抽提法、盐析法及各种市售试剂盒均可;(2) 接下来分别使用3对引物对样品DNA进行PCR扩增,上游引物带有锚定分子生物素标记,下游引物带有电化学指示剂二茂铁标记,若样品中包含目标基因组序列,即可扩增得到双端带有标记的DNA片段,大西洋鲑特异性引物的扩增长度为1 726 bp,虹鳟为1 627 bp,鲑鳟通用引物的扩增长度为428 bp;(3) 然后将各组PCR扩增产物分别加至修饰有亲和素的金电极表面,由亲和素充当锚定受体,将带有生物素标记的DNA分子稳固结合在电极表面,而未结合的引物、模板等通过洗脱反应移除;(4) 最后,通过检测DNA扩增片段另一端标记的二茂铁分子的电化学信号,判断特定PCR扩增产物是否存在,鉴别待测样品的所属物种。
|
| 图 4 用于鉴别大西洋鲑和虹鳟的电化学生物传感检测流程示意图 |
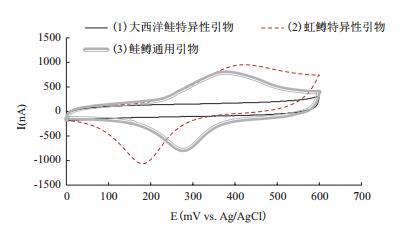
大西洋鲑样品检测结果如图 5所示。曲线(1) 和(3) 均呈现明显的氧化还原峰,表明大西洋鲑特异性引物和鲑鳟通用引物成功扩增,样本中含有大西洋鲑基因组DNA;而曲线(3) 无氧化还原峰,显示虹鳟特异性引物未能扩增,样本中不含虹鳟基因组DNA。

|
| 图 5 大西洋鲑样品检测的循环伏安信号 (1)表示大西洋鲑特异性引物扩增产物检测信号:(2)表示虹鳟特异性引物扩增产物检测信号;(3)表示鲑鳟通用引物扩增产物检测信号。测试以pH 7.0磷酸缓冲液为支持电解质,扫描速度50 mV/s,室温 |
虹鳟样品检测结果如图 6所示,曲线(2) 和(3) 出现氧化还原峰,而曲线(1) 维持未反应的平滑状态,结果符合预期,样本中含有虹鳟基因组DNA,未检出大西洋鲑基因组DNA。
|
| 图 6 虹鳟样品检测的循环伏安信号 (1)表示大西洋鲑特异性引物扩增产物检测信号:(2)表示虹鳟特异性引物扩增产物检测信号;(3)表示鲑鳟通用引物扩增产物检测信号。测试以pH 7.0磷酸缓冲液为支持电解质,扫描速度50 mV/s,室温 |
应用本研究开发的电化学生物传感方法,对32个实际样品进行电化学检测,并使用琼脂糖凝胶电泳对PCR扩增产物进行对照检测,结果见表 2。所有样品的电化学检测结果与电泳检测结果均一致。在15例采自不同养殖种群、不同品种的成鱼样品中,检测结果与形态学判定结果均一致。
目前的物种DNA鉴定技术,扩增对象以线粒体DNA为主[4-9],如细胞色素C氧化酶Ⅰ(Cytochrome oxidase subunit Ⅰ,COⅠ)、细胞色素B(Cytochrome b,Cyt b)、D-loop控制区等。线粒体DNA具有母系遗传特征,无法反映父母双亲的遗传背景,在用于人工育成品种的遗传分析时往往导致混乱。而在水产养殖业中,杂交育种是使用较为广泛的育种技术,鲑鳟杂交研究由来已久[13, 14],且有部分品种已推广养殖,如斑点鳟鲑[15]等。为避免鉴定线粒体基因对杂交品种的误判,本研究选择核基因mb作为物种鉴定的靶序列,PCR扩增结果同时包含待测样本父母本的基因信息。
mb基因编码产物是生物体内的氧贮存和转运蛋白[16, 17]。作为具有重要生理功能且在基因组内仅有唯一拷贝的基因,在物种内,mb基因结构和序列都具有较高的保守性[18, 19],在该基因区设计引物,可使物种内变异导致的PCR扩增假阴性概率显著降低。在两物种基因序列的高度差异区设计鉴别引物,则大大提高了引物的特异性,避免引物区仅有少量碱基差异,在扩增中发生碱基错配而导致假阳性扩增。
除两对物种特异性引物外,本研究还设计了一对鲑鳟通用引物,在大西洋鲑和虹鳟基因组中都能有效扩增,用作实际样本检测中的对照,指示所有实验流程正常。若通用引物检测无信号,提示应排查试剂和实验操作问题。
本研究设计使用电化学检测方法检测PCR扩增产物。与常规的DNA检测手段相比,电化学检测不像聚丙烯酰胺凝胶法、琼脂糖凝胶法等电泳方法涉及有毒有害试剂操作,既保护了检测人员的健康,也避免了潜在的环境污染风险;又不像荧光标记检测需要避光,降低了检测操作的繁琐性,因而在DNA分析中呈现出广泛的应用前景,如第三代测序Oxford Nanopore即采取纳米孔电信号检测取代荧光检测来实现单分子测序[20]。此外,电化学检测装置成本较低,易于小型化、微阵列化,在实时、现场检测中,电化学检测更具有明显的优势[10-12, 21]。
通过在上下游引物5'端分别标记生物素和二茂铁,使扩增成功的PCR产物同时带有两种标记分子,生物素标记使PCR产物被修饰有亲和素的电极表面所捕获,二茂铁标记则在电极表面产生可检测的电化学信号。二茂铁的电化学信号检测[21-23]使用循环伏安法、差分脉冲伏安法、交流阻抗法等均可实现,本研究使用循环伏安法。
比较图 5和图 6中的各条循环伏安曲线,发现相同鲑鳟通用引物在大西洋鲑和虹鳟中各自扩增的产物对应曲线形状基本相同,即图 5和图 6中的曲线(3),而不同引物扩增产物对应的循环伏安曲线形状存在一定差异。鲑鳟通用引物扩增序列在大西洋鲑和虹鳟参考基因组中仅存在24个碱基差异,产物的长度和碱基组成都高度相似,它们的循环伏安曲线基本重叠,表明在测试体系中,二茂铁标记产物的电化学行为稳定,检测结果重复性较高。而两种物种特异性引物扩增产物的循环伏安曲线与前述曲线相比,氧化峰和还原峰的位置均出现了一定程度的偏移,氧化还原峰电位差明显增大,可能是因为,较长的DNA片段阻碍了远端标记的二茂铁分子到电极表面之间的电子转移;氧化还原峰电流值也有所增大,可能是因为PCR反应扩增效率不同所导致的。以上发现提示我们,在今后的传感器设计中,可以通过不同长度和碱基组成的PCR扩增产物设计,实现不同产物的电化学信号区分,从而合并反应体系,在同一管内进行多重PCR反应,使用同一支电极对多重PCR产物进行检测,进一步简化检测流程,降低检测成本。
使用本研究开发的电化学生物传感检测方法,对32个实际样品进行了物种鉴别。在15例采自不同养殖种群、不同品种的成鱼样品中,检测结果与形态学判定结果均一致,表明本方法用于物种鉴别的准确率较高。
在17例市售鱼类加工制品检测中,有3例样品检测结果与标称不一致,包括产地未知的冰鲜三文鱼刺身2例,标称产地为挪威的烟熏三文鱼1例,可能为虹鳟冒充大西洋鲑。另有标称产地为美国的三文鱼泥1例,大西洋鲑和虹鳟特异性引物检测均显示阴性,而鲑鳟通用引物检测呈阳性,提示含有其它鲑鳟鱼类成分,考虑到市场上“三文鱼”名称使用较为混乱,银鲑(Oncorhynchus kisutch)、红鲑(Oncorhynchus nerka)、大鳞大马哈鱼(Oncorhynchus tshawytscha)等原产于太平洋的鲑科物种经常被称为“太平洋三文鱼”,推测该产品中的三文鱼成分可能属于此类。以上结果提示,市售大西洋鲑产品确实存在少量冒充或误标物种来源的问题,为保障消费者权益,在水产品质量安全监管中有必要开展物种鉴定检测。
4 结论本研究利用大西洋鲑和虹鳟mb基因的基因组序列相似性比对结果,设计了物种特异性引物,建立了基于PCR扩增反应的电化学生物传感体系,通过在上下游引物5'端分别标记生物素和二茂铁分子,实现扩增产物在电极表面的锚定和循环伏安信号检测,成功构建了用于鉴别大西洋鲑和虹鳟的电化学生物传感检测方法。本方法能够用于成鱼、苗种、鱼卵、鱼肉及其加工制品的物种鉴定,并能够从混有其他物种DNA的样品如鱼泥中成功检测鱼肉DNA的物种来源,在水产品质量检测中具有良好的应用前景。
| [1] | 孙大江, 王炳谦. 鲑科鱼类及其养殖状况[J]. 水产学杂志, 2010, 23(2): 56–63. |
| [2] | 刘乐平. 如何放心享用三文鱼杭州三文鱼消售状况调查侧记[N]. 中国渔业报, 2011-2-28(008). |
| [3] | 区君君. 生食三文鱼先学辨真假虹鳟鱼可冒充三文鱼卖[N]. 新快报, 2012-10-12(F05). |
| [4] | Rasmussen RS, Morrissey MT, Hebert PD. DNA barcoding of commercially important salmon and trout species(Oncorhynchus and Salmo)from North America[J]. Journal of Agricultural and Food Chemistry, 2009, 57 (18): 8379–8385. DOI:10.1021/jf901618z |
| [5] | Bhattacharya M, Sharma AR, Patra BC, et al. DNA barcoding to fishes:current status and future directions[J]. Mitochondrial DNA A DNA Mapp Seq Anal, 2016, 27 (4): 2744–2752. |
| [6] | 王爽, 李永波, 马超峰, 等. DNA条形码COI序列在常见肉类鉴别中的应用研究[J]. 现代食品科技, 2016, 32(1): 188–193. |
| [7] | Herrero B, Vieites JM, Montserrat E. Authentication of Atlantic salmon(Salmo salar)using real time PCR[J]. Food Chemistry, 2011, 127 (3): 1268–1272. DOI:10.1016/j.foodchem.2011.01.070 |
| [8] | 郭云霞, 张舒亚, 谌鸿超, 等. SYBR Green实时荧光PCR检测食品中鲨鱼源性成分真实性方法的建立[J]. 食品与生物技术学报, 2012, 31(12): 1300–1306. DOI:10.3969/j.issn.1673-1689.2012.12.011 |
| [9] | 李新光, 赵峰, 马丽萍, 等. 基于SYBR-Green熔解曲线快速鉴别挪威三文鱼及其制品的方法[J]. 中国食品学报, 2014, 14(3): 170–176. |
| [10] | Emil P, Martin B. Electrochemistry of nucleic acids[J]. Chemistry Review, 2012, 112 (6): 3427–3481. DOI:10.1021/cr200303p |
| [11] | Kimmel DW, LeBlanc G, Meschievitz ME, et al. Electrochemical sensors and biosensors[J]. Anal Chemi, 2012, 84 (2): 685–707. DOI:10.1021/ac202878q |
| [12] | 刘刚, 万莹, 邹子英, 等. 脱氧核糖核酸分子设计在电化学生物传感器中的应用[J]. 分析化学, 2011, 39(7): 953–962. |
| [13] | Chevassus B. Hybridization in salmonids:Results and perspecti-ves[J]. Aquaculture, 1979, 17 (2): 113–128. DOI:10.1016/0044-8486(79)90047-4 |
| [14] | 徐绍刚, 杨晓飞, 田照辉, 等. 硬头鳟与溪红点鲑杂交三倍体育种技术的初步研究[J]. 动物学杂志, 2016, 51(5): 887–894. |
| [15] | 申照亮. 山东推广斑点鳟鲑引种与养殖产业开发[N]. 中国高新技术产业导报, 2011-5-30(B08). |
| [16] | Vinogradov SN, Moens L. Diversity of globin function:enzymatic, transport, storage, and sensing[J]. The Journal of Biological Chemistry, 2008, 283 (14): 2773–2777. |
| [17] | Rezende EL. Better oxygen delivery[J]. Science, 2013, 340 (6138): 1293–1294. DOI:10.1126/science.1240631 |
| [18] | Hoffmann FG, Opazo JC, Storz JF. Whole-genome duplications spurred the functional diversification of the globin gene superfamily in vertebrates[J]. Mol Biol Evol, 2012, 29 (1): 303–312. DOI:10.1093/molbev/msr207 |
| [19] | Zhao Z, Xu P, Cao D, et al. Duplication and differentiation of common carp(Cyprinus carpio)myoglobin genes revealed by BAC analysis[J]. Gene, 2014, 548 (2): 210–216. DOI:10.1016/j.gene.2014.07.034 |
| [20] | Brown CG, Clarke J. Nanopore development at Oxford Nanopore[J]. Nature Biotechnology, 2016, 34 (8): 810–811. DOI:10.1038/nbt.3622 |
| [21] | Sassolas A, Leca-Bouvier BD, Blum LJ. DNA biosensors and microarrays[J]. Chemistry Review, 2008, 108 (1): 109–139. DOI:10.1021/cr0684467 |
| [22] | Fan C, Plaxco KW, Heeger AJ. Electrochemical interrogation of conformational changes as a reagentless method for the sequence-specific detection of DNA[J]. Proc Natl Acad Sci USA, 2003, 100 (16): 9134–9137. DOI:10.1073/pnas.1633515100 |
| [23] | Saleem M, Yu H, Wang L, et al. Review on synthesis of ferrocene-based redox polymers and derivatives and their application in glu-cose sensing[J]. Analytica Chimica Acta, 2015, 876 (23): 9–25. |