2. 中国农业科学院饲料研究所,北京 100081;
3. 北京林业大学生物科学与生物技术学院,北京 100083
2. Key Laboratory for Feed Biotechnology of the Ministry of Agriculture, Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081;
3. College of Biological Sciences and Biotechnology, Beijing Forestry University, Beijing 100083
α-半乳糖苷酶又称蜜二糖酶,可特异性水解底物中的α-1,6-半乳糖苷键,释放出末端的半乳糖残基。底物包括分支多糖(如半乳甘露聚糖)、半乳糖寡糖(如棉子糖、蜜二糖和水苏糖)和半乳糖脂[1]。按照氨基酸序列一级结构的相似性和疏水基团可以把糖苷水解酶分成133个家族,其中α-半乳糖苷酶被划分到4、27、32、36、57、97和110这7个不同的糖苷水解酶家族中[2],其中对27家族和36家族α-半乳糖苷酶的研究比较深入,大多数真菌来源的α-半乳糖苷酶都属于27家族。
α-半乳糖苷酶可以广泛的应用在饲料、食品、化学、造纸和医疗等行业[3-5],它们可以增加通用血型,提高糖结晶产量[6],改善纸浆漂白[7],增强动物饲料的营养价值[8],从豆浆中除去棉子糖[9],治疗法布里疾病[10]可提高瓜尔豆胶的流变性[8, 11]。目前α-半乳糖苷酶工业化产品主要是通过动植物提取和筛选微生物菌株发酵获得,然而这些传统的方法存在着酶活低、热稳定性差、生产效率不高等弊端,大大影响了α-半乳糖苷酶在工业生产及其他领域的应用[12]。随着基因组测序技术的迅速发展,许多来源于微生物的α-半乳糖苷酶序列得以明确[13, 14],因此利用现代基因工程手段来提高酶的产量和简化提取条件成为研究的热点。到目前为止,已经有多个不同来源的α-半乳糖苷酶基因被克隆并在大肠杆菌表达系统和酵母表达系统进行了异源表达。本研究从嗜热子囊菌(Thermoascus crustaceus)JCM12803中克隆得到一个新的α-半乳糖苷酶基因tcgal27A,构建了高效表达的毕赤酵母基因工程菌株,并对其酶学性质进行系统的研究,以期获得工业应用的性质优良的α-半乳糖苷酶。
1 材料与方法 1.1 材料Thermoascus crustaceus JCM12803购自日本微生物保藏中心;毕赤酵母(Pichia pastoris)GS115和质粒pPIC9为本实验室保存;大肠杆菌(Escherichia co-li)Trans1-T1和质粒pEASY-T3购自Transgen公司。
产酶培养基:15 g/L豆粕,15 g/L麦麸,15 g/L玉米芯以及5 g/L的NaCl,1 g/L KH2PO4,5 g/L(NH4)2SO4,0.5 g/L MgSO4.7H2O,0.01 g/L FeSO4.7H2O,以及0.2 g/L CaCl2挑取1环丝状真菌接种于产酶培养基中,37℃、180 r/min振荡培养2-3 d。
对硝基苯酚-α-D-半乳糖苷(4-nitrophenyl α-D-galactopyranoside,pNPG)、蜜二糖、棉子糖、水苏糖购买自Sigma公司;质粒小提中量试剂盒购买自北京天根生化科技有限公司;SV Total RNA Isolation kit购买自Promega公司;DNA胶回收试剂盒购买自OMEGA公司;EasyScript First-Strand cDNA Synthesis Super MIX和FastPfu DNA聚合酶购买自北京全式金生物技术有限公司;Taq酶和限制性内切酶购买自TaKaRa公司;T4 DNA连接酶购买自New England Biolabs公司。
1.2 方法 1.2.1 半乳糖苷酶基因tcgal27A的克隆提取T. crustaceus JCM12803的总RNA,反转成cDNA,以cDNA为模板设计引物12803GH27-1-F和12803GH27-1-R进行PCR扩增,得到T. crustaceus JCM12803来源的半乳糖苷酶cDNA序列。用软件预测信号肽序列,根据预测结果,设计去除信号肽序列并带有酶切位点的引物TCGal27A-F/TCGal27A-R引物由北京睿博兴科生物技术有限公司合成。
利用含有酶切位点的引物TCGal27A-F/TCGal27A-R,以pEASY-T3/tcgal27A质粒为模板,进行PCR扩增。扩增的条件为:95℃ 5 min;94℃ 30 s,57℃退火30 s,72℃延伸2 min,扩增35个循环;72℃延伸10 min。扩增后产物进行琼脂糖凝胶电泳,回收后进行双酶切(SnaBⅠ/NotⅠ),目的片段连接pPIC9转化入TransI-T1中并进行阳性克隆的筛选。
1.2.3 重组酶TCGal27A在毕赤酵母中的表达与纯化将含有TCGal27A的pPIC9的质粒进行线性化(DraⅠ)并电转入GS115感受态细胞中,进行阳性克隆子的筛选,阳性克隆子活性的检测方法参照[15]。将酶活高的菌株进行摇瓶培养,从MD平板上挑取酶活较高的转化子接种于400 mL BMGY液体培养基中,30℃、260 r/min摇床振荡培养2 d后更换培养基为200 mL含有0.5%甲醇的BMMY液体培养基诱导培养2 d,为补偿甲醇的损失,每隔12 h补加一次甲醇溶液,使甲醇浓度维持在0.5%左右,12 000 r/min离心10 min收集酶液,首先用10 kD的膜包除掉小分子的杂质初步浓缩粗酶液,其次,用7 kD透析袋进行脱盐处理。将收集的盐浓度低的酶液加入平衡好的HiTrap Q XL阴离子柱,用0.1 mol浓度的NaCl进行梯度洗脱,流速为2.0 mL/min,且分步收集洗脱下来的酶液。并对各个管中洗脱液的半乳糖苷酶活性进行测定。收集对应管中的酶液,并进行浓缩。将收集的酶液进行N-糖基化的脱糖基处理,重组酶经Endo H在37℃下处理2 h后进行SDS-PAGE电泳检测。
1.2.4 酶活力测定依据底物的不同α-半乳糖苷酶的酶活力测定方法有如下3种,见表 2。
一个酶活单位(U)定义:在最适反应条件下,每分钟分解pNPG生成1 μmol的pNP所需要的酶量。
1.2.5 蛋白质含量的测定在干净的酶标条中加入20 µL适当稀释的待测样品,然后加入200 µL考马斯亮蓝G-250试剂,混匀37℃显色10 min后,测定595 nm波长处吸光值(OD595)。根据测得的吸光值和标准曲线,计算出待测样品的蛋白质含量(mg/mL)。
1.2.6 重组酶TCGal27A酶学性质的研究 1.2.6.1 α-半乳糖苷酶最适pH和最适温度的测定α-半乳糖苷酶的最适pH值是在以下pH条件下(2.0-10.0) 进行测定的。所用缓冲液为:pH 2.0的甘氨酸-盐酸缓冲液,pH 3.0-8.0的Na2HPO4-柠檬酸缓冲液,pH 8.0-9.0的Tris-HCl缓冲液,以及pH 9.0-10.0的Gly-NaOH缓冲液。并用对应pH的缓冲液将酶液稀释适当的倍数,65℃下准确保温5 min,以测定其酶活力。根据测定结果绘制最适pH曲线。α-半乳糖苷酶的最适温度是用最适pH 4.5的0.2 mol/L的McIlvaine缓冲液及不同温度(40-80℃)下进行准确保温5 min测定其酶活力,根据测定结果绘制最适温度曲线。
1.2.6.2 α-半乳糖苷酶pH稳定性和温度稳定性的测定将酶液在不同pH的缓冲液(2.0-8.0) 下于37℃下处理1 h,在重组酶TCGal27A的最适反应条件(65℃、pH 4.5) 下测定其残余酶活力,以未保温的酶液的酶活力作为对照(100%)计算,绘制重组酶TCGal27A的pH稳定曲线。将稀释一定倍数的α-半乳糖苷酶在50℃、60℃和70℃下分别保温处理2、5、10、20、30、60 min后,测定其残余酶活力,以未保温的酶液的酶活力作为对照(100%)计算,绘制重组酶TCGal27A的热稳定曲线。
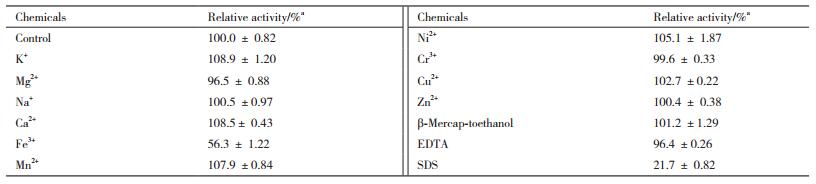
1.2.6.3 金属离子和相关化学试剂对酶活的影响在α-半乳糖苷酶酶促反应体系中加入各种不同的金属离子及化学试剂(Na+,K+,Ca2+,Ni2+,Cu2+,Mg2+,Mn2+,Zn2+,Fe3+,Cr3+,β-巯基乙醇,EDTA和SDS),分别使这些离子和化学试剂的终浓度达至5 mmol/L。在该酶的最适反应条件(65℃、pH 4.5) 下测定生成的总还原糖的量,计算酶活力,以未用以上试剂处理的酶液作为对照。
1.2.6.4 α-半乳糖苷酶比活力的测定比活力单位的定义为:每毫克酶蛋白所具有的酶活力单位数。通过pNPG法测TCGal27A酶液的酶活力单位,再通过考马斯亮蓝法测定蛋白含量,由此计算得到TCGal27A的比活力。
1.2.6.5 α-半乳糖苷酶酶促反应初速度Vmax和Km的测定在最适条件下以不同浓度的pNPG(0.2、0.25、0.3、0.5、1.0、2.0、4.0、6.0、8.0 mg/mL)为底物,加入纯化后适当稀释的重组酶进行反应,反应结束后加入1.5 mL 1 mol/L的Na2CO3溶液终止反应,测定吸光度值OD405,以1/[s]为横坐标,1/v为纵坐标绘制曲线,得出该酶在以pNPG为底物时的Km和Vmax值。
1.2.6.6 α-半乳糖苷酶底物特异性的测定pNP糖苷类底物的酶活力测定方法参照1.2.4;棉子糖和水苏糖酶活力测定采用DNS法(Miller,1959),参照1.2.4;蜜二糖底物酶活力测定采用GOD-POD法,参照1.2.4;LBG、魔芋粉和瓜尔豆胶酶活力测定:900 μL的0.5%底物,加入100 μL稀释适当倍数的酶液进行反应,在最适条件下水浴10 min,最后加入1.5 mL DNS进行终止反应,煮沸5 min,冷却,测定OD540下的吸光值。
2 结果 2.1 α-半乳糖苷酶基因tcgal27A的克隆T. crustaceus JCM12803由上海锐翌生物科技有限公司进行全基因组测序。通过测序的结果设计引物,提取T. crustaceus JCM12803的总RNA进行RT-PCR,通过特异性引物获得该基因的cDNA,cDNA连接T3载体后测序。测序正确后进行质粒提取,用含有酶切位点的特异性引物进行PCR,进行双酶切(SnaBⅠ/NotⅠ),目的片段连接pPIC9转化入TransI-T1中并进行阳性克隆的筛选。
2.2 基因序列分析来源于T. crustaceus JCM12803的α-半乳糖苷酶基因tcgal27A全长为1,918 bp,含有4个内含子。cDNA全长1,419 bp,编码472个氨基酸和一个终止密码子。用软件SignalP预测的tcgal27A N端含有24个氨基酸为其可能的信号肽。Vector分析tcgal27A不含有SnaBⅠ,NotⅠ和DraⅠ等三个酶切位点,tcgal27A所编码的成熟蛋白等电点为4.8,理论分子量为49.4 kD。BlastP分析结果显示tcgal27A推导的氨基酸序列与Rasamsonia emersonii CBS 393.64来源的27家族半乳糖苷酶最相似,相似度为74%。
2.3 真核表达载体pPIC9/tcgal27A的构建用分别含有SnaBⅠ和NotⅠ的引物扩增得到不含信号肽的α-半乳糖苷酶cDNA序列(tcgal27A),以正确的阅读方式克隆到表达载体pPIC9上,获得重组表达质粒(pPIC9/ tcgal27A)。
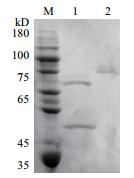
2.4 重组酶TCGal27A的表达纯化与SDS-PAGE分析重组表达载体pPIC9/tcgal27A经过小管诱导培养,筛选出高酶活的菌株,并在摇床水平上甲醇诱导48 h。通过酶活力测定和SDS-PAGE初步确定了TCGal27A在毕赤酵母中成功表达。将摇瓶表达的TCGal27A粗酶液用10 kD膜包浓缩,7 kD的透析袋透析脱盐后,通过HiTrap Q XL阴离子凝胶层析进一步纯化,收集洗脱峰并进一步浓缩,得到酶活力为24.9 U/ml比活力336.5 U/mg的α-半乳糖苷酶。纯化后的TCGal27A经过SDS-PAGE鉴定为电泳纯的单一条带,分子质量大约为48.1 kD(第2泳道),第1泳道为endo-H处理后的,可以看出明显的糖基化修饰。
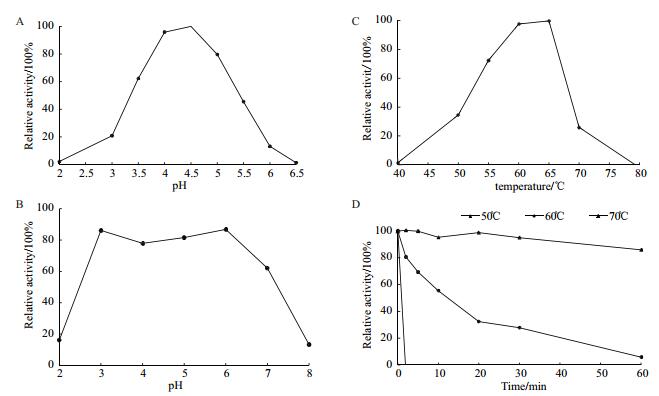
2.5 重组酶TCGal27A酶学性质测定 2.5.1 pH和温度对TCGal27A的影响TCGal27A的最适作用pH、pH稳定性、最适作用温度及热稳定性实验结果见图 2。
|
| 图 1 重组酶TCGal27A的SDS-PAGE分析 |
|
| 图 2 TCGal27A的酶学性质 A:pH对重组酶TCGal27A活性的影响;B:重组酶TCGal27A pH稳定性;C:温度对重组酶TCGal27A活性的影响;D:重组酶TCGal27A温度稳定性 |
由图可知TCGal27A α-半乳糖苷酶的最适作用pH为4.5,在pH 3.5-5.0保持62.4%以上的相对酶活性,37℃下pH 3.0-7.0处理1 h后,TCGal27A能保持62.0%以上的酶活力;最适温度为65℃,在55-65℃范围内保持72.4%以上的相对酶活性,50℃处理1 h之后TCGal27A的酶活力还能保持86.0%。
2.5.2 不同金属离子及部分化学试剂对TCGal27A的影响金属离子及不同化学试剂对α-半乳糖苷酶活性的影响结果见表 4。
Fe3+对酶有一定的抑制作用;其他金属离子对酶活力没有明显的促进与抑制作用。SDS作为一种蛋白变性剂,对酶活力的有一定抑制作用,5 mmol的EDTA对酶活力的影响不大,相比于未处理的原酶液,酶活力有96.4%。
2.5.3 α-半乳糖苷酶TCGal27A动力学常数的测定按照双倒数作图法绘制曲线,分别求得α-半乳糖苷酶对pNPG的Km及Vmax值。根据所绘制的曲线,计算得到TCGal27A对pNPG底物的Km及Vmax值分别为1.6 mol/mL、536.8 μmoL/(min·mg)。
2.5.4 α-半乳糖苷酶TCGal27A比活性的测定取纯化后的TCGal27A酶液通过pNPG法测得其酶活力为25.0 U/mL,考马斯亮蓝法测得蛋白含量为52.9 μg/mL,经计算得α-半乳糖苷酶TCGal27A的比活为336.5 U/mg。
2.5.5 α-半乳糖苷酶的底物特异性该α-半乳糖苷酶可以降解蜜二糖、棉子糖和水苏糖,也可降解多糖类的角豆胶、魔芋粉、瓜尔豆胶。比活力由高到低依次为,蜜二糖(14.4 U/mg) > 棉子糖(9.1 U/mg) > 角豆胶(3.6 U/mg) > 魔芋粉(1.6 U/mg) > 瓜尔豆胶(1.3 U/mg) > 水苏糖(0.7 U/mg)
3 讨论目前,工业上用的α-半乳糖苷酶主要来源于丝状真菌,如曲霉属,木霉属和青霉属[16],由于它们多为细胞外表达,且pH稳定性和热稳定性较好,所以多用于工业生产[17]。由于野生菌的发酵表达水平低下,因此为了降低工业生产成本,目前已构建了许多不同异源宿主的重组菌株,例如,人类的α-半乳糖苷酶已在大肠杆菌和嗜冷假交替单胞菌(Pseudoalteromonas haloplanktis)进行了异源表达[18]。尽管真核生物的α-半乳糖苷酶基因可以大肠杆菌中得到复制,但其蛋白质产物往往均是无活性的包涵体。虽然利用嗜冷表达系统中可以产活性蛋白,但是产率低下,而且低温生产制造过程成本过高。酿酒酵母[19]和巴斯德毕赤酵母[20]等酵母表达系统则具有活性好、表达量高等优点,从而有利于真核生物α-半乳糖苷酶的生产。例如,来自Bispora sp. MEY-1、Penicillium sp. F63、Rhizomucor miehei等的α-半乳糖苷酶基因都已在酵母中实现了有效的胞外表达,在甲醇诱导96 h后,利用pNPG法测的酶活分别为1.5 U/mL[21],111 U/mL和240 U/mL[22]。
在本研究中,首次克隆鉴定了T. crustaceus JCM12803中的α-半乳糖苷酶TCGal27A,并利用毕赤酵母表达系统对其进行了重组表达,TCGal27A具有高比活(336.5 U/mg)。真菌和酵母来源的α-半乳糖苷酶与细菌来源的α-半乳糖苷酶在酶学性质方面相差较大,真菌来源α-半乳糖苷酶的最适pH一般在4.5-5.5,和大多数真菌来源的α-半乳糖苷酶一样,TCGal27A的最适作用pH为4.5。不过,相对于其它真菌半乳糖苷酶而言,TCGal27A有着较高的作用温度和最适反应温度,最适温度为65℃,在50℃处理1 h仍保持86.0%以上的酶活。虽然上述来自Bispora sp. MEY-1、Penicillium sp. F63、Rhizomucor miehei的半乳糖苷酶均实现了高效表达,但最适温度分别为55℃、40℃、55℃,且在65℃仅剩较低的相对酶活。而TCGal27A能在65℃保持336.5 U/mg的比活,说明TCGal27A是一种新的酸性,耐热的α-半乳糖苷酶。
豆类饼粕饲料中含有一些单胃动物不能进行消化的α-半乳糖苷的多聚糖和低聚糖的抗营养因子。其中低聚糖主要是游离的水苏糖、棉子糖等,较高浓度的此类游离水溶性低聚糖会造成食糜度增高,不利于动物的消化和营养物质的吸收。但是如果在饲料中加入α-半乳糖苷酶、蛋白酶和果胶酶就能有效地提高豆粕蛋白能量利用率并且改善消化,酶在加工应用过程中要先经受原料混合、加工高温制粒后才在动物胃肠道溶解发生作用,所以酶制剂的温度和稳定性倍受关注[23]。TCGal27A的最适温度为65℃,在饲料的低温65℃制粒过程中可以保持良好的酶活力,因此本研究中的耐高温TCGal27A即可添加到饲料中实现此应用。
4 结论本研究成功从嗜热真菌T. crustaceus JCM12803克隆到一个α-半乳糖苷酶基因,与R. emersonii CBS 393.64来源的α-半乳糖苷酶序列一致性很高,相似性74%,具有一定的新颖性。通过毕赤酵母系统对该酶进行了异源表达,该酶具有良好的酶学性质,TCGal27A具有高比活(336.5 U/mg)及宽泛的底物特异性。TCGal27A最适pH为4.5,在pH为3.5-5.0基本保持62.4%以上的相对酶活性,其最适温度为65℃,在50℃处理1 h仍保持86.0%以上的酶活。本研究中的耐高温TCGal27A可添加到饲料中,在消化和提高豆粕蛋白能量利用率方面有良好的潜在应用价值。
| [1] | Golotin VA, Balabanova LA, Noskova YA, et al. Optimization of cold-adapted alpha-galactosidase expression in Escherichia coli[J]. Protein Expression & Purification, 2016, 123 : 14–18. |
| [2] | Weignerová L, Simerská P, K?en V. α-Galactosidases and their applications in biotransformations[J]. Biocatalysis & Biotransformation, 2009, 27 (2): 79–89. |
| [3] | Gant er C, Böck A, et al. Production of thermostable recombinant alpha-galactosidase suitable for raffinose elimination from sugar beet syrup[J]. Journal of Biotechnology, 1988, 8 (4): 301–310. DOI:10.1016/0168-1656(88)90022-3 |
| [4] | Prashanth SJ, Mulimani VH. Soymilk oligosaccharide hydrolysis by Aspergillus oryzae, α-galactosidase immobilized in calcium alginate[J]. Process Biochemistry, 2005, 40 (3-4): 1199–1205. DOI:10.1016/j.procbio.2004.04.011 |
| [5] | Lenny LL, Hurst R, Goldstein J, et al. Transfusions to group O subjects of 2 units of red cells enzymatically converted from group B to group O[J]. Transfusion, 1994, 34 (3): 209–214. DOI:10.1046/j.1537-2995.1994.34394196617.x |
| [6] | Ganter C, Bo ck, A, et al. Production of thermostable, recombinant α-galactosidase suitable for raffinose elimination from sugar beet syrup[J]. Journal of Biotechnology, 1988, 8 (4): 301–310. DOI:10.1016/0168-1656(88)90022-3 |
| [7] | Clarke JH, Davidson K, Rixon JE, et al. A comparison of enzyme-aided bleaching of softwood paper pulp using combinations of xylanase, mannanase and α-galactosidase[J]. Applied Microbiology & Biotechnology, 2000, 53 (53): 661–667. |
| [8] | Ghazi S, Rooke JA, Galbraith H. Improvement of the nutritive value of soybean meal by protease and a-galactosidase treatment in broiler cockerels and broiler chicks[J]. British Poultry Science, 2003, 44 (3): 410–418. DOI:10.1080/00071660310001598283 |
| [9] | Cao Y, Yuan T, et al. Properties of a novel α-galactosidase from Streptomyces, sp. S27 and its potential for soybean processing[J]. Enzyme & Microbial Technology, 2010, 47 (7): 305–312. |
| [10] | Germain DP, Charrow J, Desnick RJ, et al. Ten-year outcome of enzyme replacement therapy with agalsidase beta in patients with Fabry disease[J]. Journal of Medical Genetics, 2015, 52 (5): 353–358. DOI:10.1136/jmedgenet-2014-102797 |
| [11] | Kurakake M, Okumura T, Morimoto Y, et al. Synthesis of galactosyl glycerol from guar gum by transglycosylation of α-galactosidase from Aspergillus sp. MK14[J]. Food Chemistry, 2015, 172 : 150–154. DOI:10.1016/j.foodchem.2014.09.038 |
| [12] | Carrera-Silva EA, Silvestroni A, Leblanc JG, et al. A Thermostable α-Galactosidase from Lactobacillus fermentum, CRL722:Genetic Characterization and Main Properties[J]. Current Microbiology, 2006, 53 (5): 374–378. DOI:10.1007/s00284-005-0442-y |
| [13] | Halstead JR, Fransen MP, Eberhart RY, et al. alpha-Galactosidase A from Pseudomonas fluorescens subsp. cellulosa:cloning, high level expression and its role in galactomannan hydrolysis[J]. Fems Microbiology Letters, 2000, 192 (2): 197–203. |
| [14] | Jindou S, Karita S, Fujino E, et al. alpha-Galactosidase Aga27A, an enzymatic component of the Clostridium josui cellulosome[J]. Journal of Bacteriology, 2002, 184 (2): 600–604. DOI:10.1128/JB.184.2.600-604.2002 |
| [15] | Luo HY, Wang K, Huang HQ, et al. Gene cloning, expression, and biochemical characterization of an alkali-tolerant β-mannanase from Humicola insolens, Y1[J]. Journal of Industrial Microbiology & Biotechnology, 2012, 39 (4): 547–555. |
| [16] | Manzanares P, de Graaff LH, Visser J. Characterization of galactosidases from Aspergillus niger:purification of a novel alpha-galactosidase activity[J]. Enzyme & Microbial Technology, 1998, 22 (5): 383–390. |
| [17] | Aleksieva P, Tchorbanov B, Nacheva L. High-Yield Production of Alpha-Galactosidase Excreted from Penicillium chrysogenum and Aspergillus niger[J]. Biotechnology & Biotechnological Equipment, 2010, 24 (1): 1620–1623. |
| [18] | Unzueta U, Accardi G, Mendoza R, et al. Strategies for the production of difficult-to-express full-length eukaryotic proteins using microbial cell factories:production of human alpha-galactosidase A[J]. Applied Microbiology and Biotechnology, 2015, 99 (14): 5863–5874. DOI:10.1007/s00253-014-6328-9 |
| [19] | Shibuya H, Nagasaki H, Kaneko S, et al. Cloning and high-level expression of alpha-galactosidase cDNA from Penicillium purpurogenum[J]. Applied & Environmental Microbiology, 1998, 64 (11): 4489–94. |
| [20] | Jindou S, Karita S, Fujino E, et al. alpha-Galactosidase Aga27A, an enzymatic component of the Clostridium josui cellulosome[J]. Journal of Bacteriology, 2002, 184 (2): 600–4. DOI:10.1128/JB.184.2.600-604.2002 |
| [21] | Wang H, Luo H, Li J, et al. An α-galactosidase from an acidophilic Bispora sp. MEY-1 strain acts synergistically with β-mannanase[J]. Bioresource Technology, 2010, 101 (21): 8376–82. DOI:10.1016/j.biortech.2010.06.045 |
| [22] | Chen Z, Yan Q, Jiang Z, et al. High-level[J]. Protein Expression & Purification, 2015, 110 : 107–114. |
| [23] | 王春林, 陆文清. 饲用α-半乳糖苷酶稳定性及酶学特性的研究[J]. 中国饲料, 2010(6): 14–16. |