近年来,受到资源短缺和环境污染的压力,二次纤维的应用已逐渐引起重视。造纸原料中,废纸浆所占比例逐渐增加,在我国已增到38%,由于废纸品种复杂,印刷油墨配方也各不相同,脱墨成为再生纸浆的一个难题[1, 2]。一般通过加碱、非离子表面活性剂、硅酸钠等处理来脱墨,由于对环境污染严重,效率也并不理想。同时,生活污水中50%-70%的磷来自含磷洗涤剂[3],这些磷酸盐随废水排入江河湖海,使水质富营养化,最终在近海产生赤潮,每年给我国造成的经济损失约100亿元人民币[4]。且传统含磷洗涤剂洗涤时间长,所需温度高,成本大,洗涤行业也因此急需环保、节能、高效的洗涤剂[5]。
低温酯酶在反应过程中可以节省掉加热所消耗的能量,具有低温高催化活性。造纸脱墨行业中,酯酶能对脂及甘油酸酯等胶粘物成份进行分解,在此作用下胶粘物尺寸变小或粘性降低,提高了油墨去除率、纸浆得率、白度等,同时降低了生产成本、化学品使用和环境污染[6-8]。在洗涤行业,低温酯酶能将来自皮脂或食品中的脂质污垢中含有的甘油三酯分解成甘油单酯和脂肪酸,即可把污垢去除。洗涤剂中加入低温酯酶后具有如下优点,其一,降低了织物洗涤温度,一方面可以避免高温环境对于织物的破坏作用[9-11],另一方面也可以减少洗涤过程中的能源消耗和CO2排放量。其二,减少了洗涤剂中表面活性剂的用量,能使排出的废水与环境更相容。其三,增加了节水、节能和环境保护效益。在洗涤过程中,通过酶的作用,可减少漂洗次数,降低洗涤温度,而酶本身又是极易被降解的物质。因此,加酶洗涤剂成为世界洗涤用品工业近十多年来争相发展的热门产品[12]。
本实验室从自主分离并保存的溶藻弧菌(Vibrio alginolyticus)7S-1菌株中,克隆到一个酯酶基因(命名为estZ),并实现该基因在大肠杆菌(Escherichia coli)中的功能性表达,同时初步测定酯酶EstZ的基础酶学性质。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒V. alginolyticus 7S-1菌株由本实验室分离、鉴定并保存,E. coli DH5α和E. coli BL21(DE3) 为本实验室保存的菌株。pSP72和pET28a为本实验室保存的质粒载体。
1.1.2 主要试剂Hind Ⅲ、Nde Ⅰ限制性内切酶和Alkaline Phosphatase,Calf Intestinal(CIAP)购自NEB公司,T4 DNA连接酶、Xho Ⅰ限制性内切酶、DNA Marker和蛋白质浓度测定试剂盒购自宝生物工程(大连)有限公司;细菌基因组提取试剂盒购自天根生化科技公司,质粒提取试剂盒和Cycle Pure试剂盒购自OMEGA公司;PCR扩增引物由生工生物工程(上海)股份有限公司合成。Pfu DNA Polymerase、卡那霉素购自生工生物工程(上海)股份有限公司。酯酶的系列底物:4-Nitrophenyl acetate(C2)、4-Nitrophenyl butyrate(C4;4-NPB)、4-Nitrophenyl hexanoate(C6)、4-Nitrophenyl caprylate(C8)、4-Nitrophenyl decanoate(C10)、4-Nitrophenyl dodecanoate(C12)、4-Nitrophenyl mgristate(C14)、4-Nitrophenyl palmitate(C16) 购自Sigma-Aldrich公司或百灵威科技有限公司,HisTrap FF Crude和HiTrap Desalting购自GE Healthcare公司,其他试剂均为市售分析纯。
1.2 方法 1.2.1 菌株7S-1酯酶基因的克隆提取菌株7S-1的基因组DNA,进行Hind Ⅲ部分酶切。将载体质粒pSP72使用Hind Ⅲ酶切并去磷酸化。将酶切后的基因组片段连接入pSP72,转化E. coli DH5α,克隆子在含有100 μg/mL氨苄西林和1%三丁酸甘油酯的LB平板上进行筛选,如果克隆子周边出现透明圈,挑取克隆子,提取质粒进行DNA测序。
1.2.2 酯酶基因estZ的验证以菌株7S-1基因组DNA为模板,以Orf3F(CCCAAGCTTGGCAAGTAGTGATGACTGATTC)和Orf3R(CCCAAGCTTAGGATTTACTGGGCTGATACGC)为引物,PCR扩增estZ基因及其上下游序列。PCR扩增程序为:95℃预变性5 min;95℃变性30 s,64℃退火30 s,72℃延伸2 min,35个循环;72℃ 10 min终止反应。将所得的扩增产物使用Hind Ⅲ酶切,连接入pSP72,转化E. coli DH5α,克隆子在含有100 μg/mL氨苄西林和1%三丁酸甘油酯的LB平板上进行筛选,观察克隆子周边是否出现透明圈。
1.2.3 estZ基因表达质粒的构建以菌株7S-1基因组DNA为模板,以Eorf3F-2(GGGGGGGCATATGAAAATCATCATCTTACATG)和Eorf3R(GATCTCGAGCTATCGACGGAAATAATCTGTG)为引物,PCR扩增estZ基因完整序列。PCR扩增程序为:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸2 min,35个循环;72℃ 10 min终止反应。将PCR扩增产物与表达载体pET28a经Nde Ⅰ和Xho Ⅰ双酶切、连接、转化E. coli DH5α,将获得的阳性克隆子提取质粒,送生工生物工程(上海)股份有限公司测序。无突变的重组质粒转化入E. coli BL21(DE3),挑取阳性克隆子,富集培养后保种备用。
1.2.4 estZ基因的诱导表达将E. coli BL21-28a-estZ接种含有卡那霉素的LB培养基,37℃培养过夜,1%转接含有卡那霉素的LB培养基,37℃培养至OD600=0.6,添加IPTG至终浓度0.4 mmol/L,18℃诱导培养22 h。5 000 r/min离心5 min收集菌体,PBS溶液悬浮菌体,同时加入0.3%溶菌酶。高压破碎细胞,4℃ 10 000 r/min离心20 min取上清液过滤。滤液取出2 mL,4℃保存备用。剩余滤液作为粗酶液,进行蛋白纯化。
1.2.5 重组酯酶EstZ的纯化及蛋白浓度测定将粗酶液样品使用HisTrap FF Crude亲和层析柱和HiTrap Desalting脱盐柱纯化蛋白,上样缓冲溶液为20 mmol/L Na2HPO4-NaH2PO4、5 mmol/L咪唑、500 mmol/L NaCl,pH7.4,洗脱液为20 mmol/L Na2HPO4-NaH2PO4、500 mmol/L咪唑、500 mmol/L NaCl,pH7.4。蛋白溶于50 mmol/L Tris-HCl(pH8.0) 缓冲液中,即为纯酶液,进行酶活测定和SDS-PAGE电泳检测。
1.2.6 酯酶酶活和比酶活的测定 1.2.6.1 4-硝基苯酚(4-NP)标准曲线的绘制将4-NP使用Tris-HCl(pH8.0) 缓冲液进行梯度稀释,配制不同浓度的溶液。在405 nm测定溶液吸光度,绘制标准曲线。
1.2.6.2 酯酶酶活的测定在0.98 mL 50 mmol/L Tris-HCl(pH8.0) 中加入0.1 mL 3 mg/mL 4-NPB,震荡混匀,25℃水浴5 min,加入20 μL稀释10倍的纯酶液,混匀,25℃水浴10 min,加入1.1 mL无水乙醇终止反应,在405 nm测定溶液吸光度,计算酯酶活力。在25℃、pH8.0的50 mmol/L Tris-HCl缓冲溶液中,每分钟释放1 μmol/L 4-硝基苯酚所需要的酶量定义为1个酶活单位(U)。
1.2.6.3 酯酶比酶活的测定采用Bradford Protein Assay Kit测定蛋白浓度,以牛血清白蛋白为标准蛋白[13]。同时测定酯酶酶活,计算酯酶的比酶活。
1.2.7 重组酯酶EstZ的酶学性质分析 1.2.7.1 最适温度在0℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃测定酯酶酶活,确定最适温度。
1.2.7.2 最适pH在pH4、5、5.8、7.1、8、9、9.6、10的不同缓冲体系中测定酯酶酶活,确定最适pH。
1.2.7.3 热稳定性将纯酶液分别在40℃、50℃处理10 min、20 min、30 min后测定酯酶酶活,确定热稳定性。
1.2.7.4 pH稳定性将纯酶液分别在不同pH的缓冲液中4℃处理5 h后测定酯酶酶活,确定pH稳定性。
1.2.7.5 最适底物分别以C2、C4、C6、C8、C10、C12、C14、C16为反应底物测定酯酶酶活,确定酶的最适底物。
1.2.7.6 有机溶剂影响在酶促反应体系中分别加入甲醇、乙醇、丙酮、乙腈、氯仿、甘油,终浓度为10%(V/V),测定酯酶酶活,以未加有机溶剂的样品作为对照。
1.2.7.7 表面活性剂影响在酶促反应体系中分别加入SDS、Tween60、Tween80、DMSO、PMSF、EDTA,终浓度为1%(V/V),测定酯酶酶活,以未加表面活性剂的样品作为对照。
1.2.7.8 金属离子影响在酶促反应体系中分别加入K+、Ca2+、Cu2+、Mg2+、Zn2+、Mn2+、CO2+、Ni2+、Na+,各金属离子的终浓度为10 mmol/L,测定酯酶酶活,以未加入金属离子的样品作为对照。
1.2.7.9 NaCl影响在含有0 mmol/L、20 mmol/L、40 mmol/L、60 mmol/L、80 mmol/L、100 mmol/L、500 mmol/L、600 mmol/L、700 mmol/L、800 mmol/L、900 mmol/L NaCl的酶促反应液中,测定酯酶酶活。
2 结果 2.1 酯酶基因estZ的生物信息学分析亚克隆实验发现,当重组质粒中含有estZ基因时,大肠杆菌重组子在含有1%三丁酸甘油酯的LB平板上生长,菌落周围出现透明圈。酯酶EstZ的编码基因全长615 bp,编码204个氨基酸,GC含量为32%,理论蛋白分子量为22.6 kD,pI为8.86。Blast分析表明酯酶EstZ与弧菌来源的钴啉醇酰胺腺苷转移酶同源性100%。
2.2 表达质粒pET28a-estZ验证将estZ基因连接入表达载体pET28a构建的重组质粒pET28a-estZ,经Nde Ⅰ和Xho Ⅰ双酶切后,得到约5.4 kb和615 bp的两个DNA片段,与预期大小相符(图 1-A),测序结果显示estZ基因正确无突变。
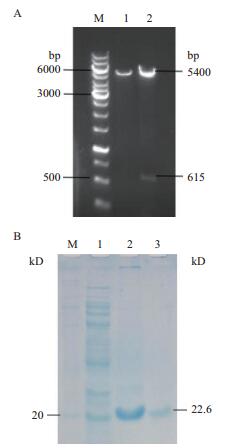
|
| 图 1 表达质粒pET28a-estZ酶切验证电泳图(A)和酯酶EstZ纯化样品的SDS-PAGE图(B) (A)M:DNA分子量标准;1:质粒pET28a被Nde Ⅰ和Xho Ⅰ酶切;2:重组质粒pET28a-estZ被Nde Ⅰ和Xho Ⅰ酶切;(B)M:蛋白分子量标准;1:诱导表达的重组菌菌体破碎全细胞;2:HisTrap FF Crude亲和层析后的酯酶EstZ;3:脱盐纯化后的酯酶EstZ |
粗酶液经过亲和层析和脱盐纯化后,获得酯酶EstZ纯酶液(图 1-B),回收率为25.23%(表 1),纯化倍数达17.26。纯化后的EstZ水解4-NPB的比酶活为5.42 U/μg(表 1)。
由图 2可以看出,酯酶EstZ的最适温度为25℃,在10℃-35℃之间有显著酶活,大于40℃后酶活急剧下降,在0℃时仍有35%的酶活,且EstZ热稳定性较差,在40℃保温10 min酶活下降为45%,50℃则酶活直接降为0,说明酯酶EstZ在温度升高的情况下,结构极易遭到破坏,因此是典型的低温酶,在低温催化方面具有一定的应用价值。酯酶EstZ的最适pH为9.0,在pH8-9.6之间可以保持较高酶活,属弱碱性酶,在酸性环境下表现出极弱的催化活性。在pH10缓冲液中处理5 h EstZ可以保持97%的酶活,说明该酶具有较好的碱耐受性。
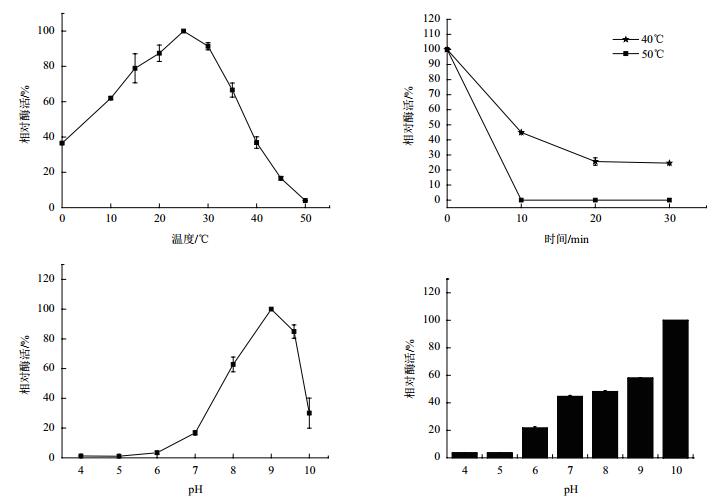
|
| 图 2 温度及pH对EstZ酶活的影响 |
由图 3可以看出,当C4(4-NPB)作为底物时,酶活力最高,表明EstZ为酯酶,而非脂肪酶,且EstZ具有较宽的底物谱,这在其它已知酯酶中并不常见[14]。甘油对酶活有激活作用,甲醇、乙醇、丙酮有不同程度的抑制作用,乙腈、氯仿则有明显的抑制作用,总的来看该酯酶有一定的抗有机溶剂能力,可应用于有机合成等方面。EDTA和SDS对酶有强烈的抑制作用。EstZ在Tween60、Tween80、DMSO、PMSF存在时可保持70%以上的酶活,说明这些常见的表面活性剂对该低温酯酶的酶活性影响不大,该酯酶在洗涤剂等行业具应用潜力。Na+对酶有较强的激活作用,相对酶活高达174%,其次为Mg2+,Ca2+、Mn2+、K+对酶有微弱的激活作用,Zn2+对酶活有轻微的抑制作用,Cu2+、Ni2+、CO2+有较强的抑制作用。
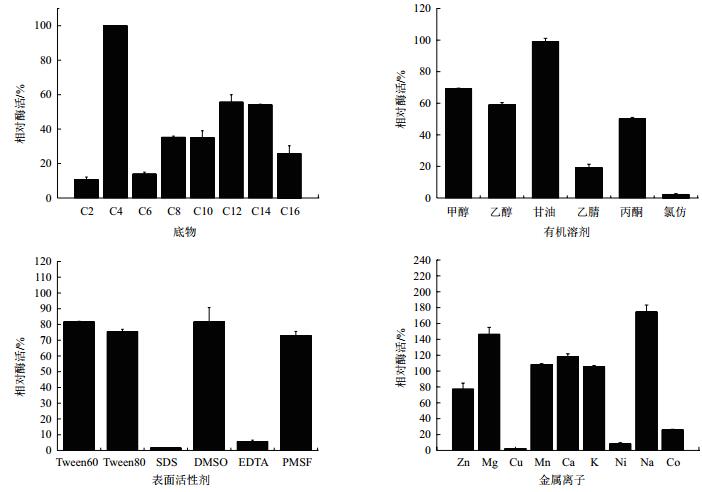
|
| 图 3 底物、有机溶剂、表面活性剂及金属离子对EstZ酶活的影响 |
由图 4可以看出,反应体系中加入20-500 mmol/L的NaCl可以增强酶的活性,在100 mmol/L NaCl溶液中活性达到最高,为160%。当浓度提高到900 mmol/L时,酶的活性被抑制,保持原来的30%。

|
| 图 4 酯酶EstZ的耐盐性 |
近年来,酯酶越来越广泛地应用于生物脱墨和洗涤行业,细菌或者真菌来源的各种各样的水解酶,例如,纤维素酶、淀粉酶、脂肪酶、木聚糖酶等均可应用于办公废纸的脱墨技术上[15-19]。汪顺才[20]将以纤维素酶、酯酶等组成的复合酶对纸浆进行脱墨,得到了较优的纸浆脱墨工艺条件;洗涤行业,有报道表明,在欧洲、美国和日本,90%的洗涤剂都含有酶[21]。但对于酯酶催化特点和理论机理的基础研究报道较少。
本研究克隆到溶藻弧菌7S-1的一种低温酯酶EstZ,并进行了异源表达和酶学性质的探究。该酯酶虽与弧菌来源的钴啉醇酰胺腺苷转移酶同源性100%,但是关于钴啉醇酰胺腺苷转移酶酶学性质的研究还未见相关报道。
酯酶EstZ最适温度为25℃,在0℃时依旧有35%的酶活,因此是明显的低温酶。洗涤行业,出于节能,日常洗衣正由传统的高温洗涤转向低温洗涤。低温酯酶在低温下具有较高的催化活性,可以克服中高温酶在低温条件下活性低的缺点。一般脱墨时浆料pH控制在9-11之间,为碱性脱墨,相比于中性脱墨,所得纸浆滤水性能好,物理强度高[22, 23]。该酯酶最适pH为9,且具有较好的耐碱性,可在纸浆脱墨时发挥它的最大酶活力。Na+、Mg2+对该酶有强烈的激活作用,且该酶对甲醇、乙醇、丙酮等有机溶剂及Tween60、Tween80、DMSO、PMSF具有一定的耐受性,因此具有较广泛的工业应用前景。
综上,estZ基因的异源表达和酶学性质的研究,有助于进一步揭示该酯酶的催化机制,拓展酯酶EstZ在生物脱墨和洗涤行业的应用。后续研究可采用定点突变技术以提高低温酯酶的活性,为该酶更好地实现工业化奠定理论基础。
4 结论本研究从溶藻弧菌7S-1中克隆到一种低温酯酶基因estZ,并进行了异源表达和基础酶学性质的探究。EstZ是典型的低温酶,对有机溶剂和表面活性剂具有一定耐受性,耐碱耐盐,有较好的工业应用前景。
| [1] | 胡宗渊. 我国造纸纤维原料问题探讨[J]. 纸和造纸, 2006, 25(S1): 1–3. |
| [2] | 胡学智. 酶制剂工业概况及其应用进展[J]. 工业微生物, 2003, 33(4): 32–41. |
| [3] | 娄金生, 谢水波, 何少华. 生物脱氮除磷原理与应用[M]. 长沙: 国防科技大学出版社, 2002. |
| [4] | 查青青, 于文. 我国织物洗涤剂行业现状及发展[J]. 日用化学品科学, 2010, 33(5): 4–8. |
| [5] | 陈乐仁, 王岩. 酶与中国洗涤剂工业的发展[J]. 日用化学品科学, 1999(S1): 169–172. |
| [6] | 陈嘉翔. 国际上对废纸回用时发生胶粘物问题的研究成果和目前的研究方向[J]. 造纸化学品, 2004, 16(1): 1–4. |
| [7] | 俞霁川, 付时雨, 曾细玲, 等. 脂肪酶和酯酶去除废纸浆中胶黏物效果的比较[J]. 中国造纸, 2012, 31(7): 6–10. DOI:10.11980/j.issn.0254-508X.2012.07.002 |
| [8] | Monte MC, Blanco A, Negro C, et al. Development of a methodology to predict sticky deposits due to the destabilisation of dissolved and colloidal material in papermaking—application to different systems[J]. Chemical Engineering Journal, 2004, 105 (1-2): 21–29. DOI:10.1016/j.cej.2004.07.013 |
| [9] | 陈贵元. 低温脂肪酶的分离纯化及其酶学性质研究[D]. 昆明: 昆明理工大学, 2007. |
| [10] | 和田恭尚. 酶在洗涤剂中的应用现状及展望[J]. 日用化学工业, 2005, 35(1): 30–35. |
| [11] | 董荣. 青霉脂肪酶在洗涤去污中的应用研究[J]. 日用化学工业, 1991(5): 1–5. |
| [12] | 王吉星, 王燕. 影响酶洗涤效果因素的探讨[J]. 日用化学品科学, 2007, 30(5): 27–31. |
| [13] | 甘淋, 李娟, 何涛, 等. 几种蛋白质含量测定方法的比较研究[J]. 泸州医学院学报, 2004, 27(6): 500–502. |
| [14] | 李正阳, 戎振, 王昭, 等. 来源于海洋细菌Altererythrobacter luteolus SW109~T的新型酯酶E29的克隆表达及其酶学性质[J]. 微生物学通报, 2016, 43(5): 1051–1059. |
| [15] | Fariha H, Aamer AS, Abdul H. Industrial applications of microbial lipases[J]. Enzyme and Microbial Technology, 2006 (39): 235–251. |
| [16] | Morbak AL, Zimmermann W. Deinking of mixed office paper, old newspaper and vegetable oil-based ink printed paper using cellulases, xylanases and lipases[J]. Progress in Paper Recycling, 1998, 7 : 14–21. |
| [17] | Spiridon I, Andrade AMD. Enzymatic deinking of old newspaper[J]. Progress in Paper Recycling, 2005, 14 (3): 14. |
| [18] | 张素风, 张美云, 赵锦良. 废纸酶法脱墨[J]. 中华纸业, 2006, 27(6): 42. |
| [19] | Zollner HK, Schroeder L, Leland R. Enzymic deinking of non-impact printed white office paper with α-amylase[J]. Tappi Journal, 1998, 81 : 166–170. |
| [20] | 汪顺才. 复合酶用于废纸浆脱墨[J]. 纸和造纸, 2007, 26(3): 66–68. |
| [21] | 雷秋芬, 于文. 中国衣用液体洗涤剂行业面临的机遇和挑战[J]. 日用化学品科学, 2008, 31(1): 8–10. |
| [22] | 李海明. 高性价比碱性脱墨剂制备和应用技术研究[D]. 天津: 天津科技大学, 2004. |
| [23] | 蔡文忠. 废纸弱碱性脱墨技术的开发应用与推广[D]. 济南: 齐鲁工业大学, 2014. |





