2. 中国农业科学院作物科学研究所,北京 100081
2. Institute of Crop Science, Chinese Academy of Agricultural Sciences, Beijing 100081
玉米是我国种植面积最大的作物,可以作为粮食、饲料、工业原料等。杂草对玉米生产危害严重,一般年份可使玉米减产10%-20%。利用转基因技术培育抗除草剂转基因玉米,可以利用除草剂有效控制田间杂草,减少农药使用量,降低生产成本,保护环境。随着转基因作物的迅猛发展,转基因作物的环境安全性及食用安全性评价备受关注,其中最受关注的是食用安全性问题。转基因作物中所表达的外源蛋白大部分是受体作物中所没有的蛋白质,有可能对人体产生包括致敏性在内的一些不良反应。因此,外源蛋白致敏性评价一直是转基因食用安全性评价的重要内容[1]。
虽然关于食物致敏的机制还不是十分清楚,但大部分食物蛋白质是通过胃肠道途径引发致敏反应[2-4]。从理论上讲,致敏蛋白在通过小肠吸收进入免疫系统前必须能够抵抗胃肠液消化降解,以完整又有免疫原性的蛋白或蛋白降解片段形式引起人体过敏反应[1, 5, 6]。体外模拟消化实验即是基于致敏蛋白耐消化这一特点发展出来的一种过敏评估方法,现已被许多国家以及一些国际组织规定为转基因作物中新表达外源蛋白致敏性评价的必选实验项目[7, 8]。在中国,农业部于2007年出台国家标准[9],详细规定了质量浓度为5 g/L和2 g/L的外源蛋白在体外模拟胃肠液中消化稳定性的检测方法。到目前为止,已有多种转基因作物的目标或标记基因的表达蛋白,如转Bt基因水稻的Cry1C蛋白[10]、2mEPSPS蛋白[11]、PAT蛋白[12]、PMI蛋白[13]、HPT蛋白[14]等都进行了体外模拟胃肠液消化稳定性实验,作为评估其可能致敏性依据之一。
AM79 EPSPS基因是从草甘膦高度污染的土壤中克隆的、具有我国自主知识产权的新型草甘膦抗性基因,对于发展我国的抗草甘膦转基因作物有重要的意义。一般来说,Ki/Km可以作为衡量草甘膦抗性的一个重要指标。酶促反应中,对草甘膦抑制常数Ki与底物PEP亲和能力Km的比值越大(Ki/Km),说明该基因草甘膦抗性越强。有研究表明,酶活测定显示AM79 EPSPS的Ki/Km值为10.6,略低于当前生产中应用比较广泛的CP4 EPSPS[15]。因此,在转基因玉米中过表达该基因能显著提高转基因玉米的草甘膦抗性,具有重要应用价值[16]。本研究将AM79 EPSPS基因构建到原核表达载体pET-30a中,诱导表达并纯化AM79 EPSPS蛋白,并参考中华人民共和国国家标准[9],通过体外模拟胃肠液消化稳定性实验以对其致敏性作出初步评价,为抗草甘膦基因玉米的食用安全性评估提供科学依据。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒克隆载体、细菌表达载体pET-30a,感受态细胞DE3、菌株由本实验室提供。
1.1.2 试剂抗生素氯霉素(Chl)和卡那霉素(Kan)均购自北京中科瑞泰生物科技有限公司,牛血清白蛋白(BSA)、牛β乳球蛋白B(BLG)、大豆胰蛋白酶抑制剂(STI)均购自美国的Sigma公司。
1.1.3 模拟胃消化液(SGF)称取0.2 g氯化钠(NaCl)和105 mg胃蛋白酶,加入70 mL重蒸馏水,加入730 µL盐酸,再用盐酸调pH至1.2,加水定容至100 mL。现配现用。
1.1.4 模拟肠消化液(SIF)称取0.7 g磷酸二氢钾(KH2PO4) 溶于25 mL重蒸馏水中,振荡使之完全溶解,加入19 mL 0.2 mol/L氢氧化钠溶液和40 mL重蒸馏水,加入1.0 g胰酶,用0.2 mol/L氢氧化钠溶液调pH至7.5,加重蒸馏水定容至100 mL。现用现配。
1.2 方法 1.2.1 载体构建利用上游引物5'-GCGGATCCATGTCACATTCTACCTCTAGGTCC-3'和下游引物5'-GCAAGCTTGATTATACTCCACATGTATTCCAAA-3'扩增AM79 EPSPS基因,在5'端和3'端分别添加BamH Ⅰ and Hind Ⅲ酶切位点。AM79 EPSPS用BamH Ⅰ和Hind Ⅲ进行酶切,连接到用相同内切酶进行酶切的pET-30a上,构建载体pET-AM79。将pET-AM79转到大肠杆菌菌株Transetta(DE3) 中,用于目的蛋白的表达纯化。
1.2.2 蛋白诱导表达挑取单菌落接种于10 mL LB液体培养基(含适宜抗生素)中,于37℃、200 r/min振荡培养过夜。次日,按1:100稀释加入到200 mL LB液体培养基中,37℃、200 r/min振荡培养至OD600为0.4-0.6,加入100 μL IPTG(1 mol/L)诱导剂,160 r/min,28℃摇床培养4-6 h或者于16℃摇床培养20-26 h,诱导目标蛋白表达。之后将菌液转移至离心瓶中,4℃、5 000 r/min离心5 min,弃上清液,收集菌体。
1.2.3 蛋白表达的可溶性分析将收集的菌体悬浮于25 mL的缓冲液15 mmol/L Tris-HCl(pH8.0) 中,加入溶菌酶,超声波破碎菌体至菌液澄清。12 000 r/min,4℃下离心15 min。取上清液和沉淀物分别进行电泳。在沉淀中加入40 µL 15 mmol/L Tris-HCl(pH8.0) 重悬并离心,取40 µL上清分别加入10 µL 5SDS上样缓冲液后煮沸5 min,12 000 r/min,室温离心10 min,进行电泳分析。
1.2.4 目的蛋白的纯化将收集的菌体悬浮于25 mL的缓冲液15 mmol/L Tris-HCl(pH8.0) 中,加入300 µL溶菌酶(2 mg/mL),超声波破碎菌体至菌液澄清。12 000 r/min,4℃下离心15 min,取上清,加入1 mL混匀的Ni-NTA树脂,冰上置于摇床振荡60 min,使目的蛋白充分结合到Ni-NTA树脂上并过柱纯化。用5倍镍柱体积的含15 mmol/L咪唑的缓冲液平衡事先用70%乙醇浸泡过的镍柱,4℃环境中操作,低速向柱子中加入混匀好的蛋白上清和树脂的混合物,收集流出液,标记为L15,再分别用含有30 mmol/L、100 mmol/L和250 mmol/L的咪唑洗脱液洗脱杂蛋白(其中250 mmol/L洗脱液每2 mL收集1管,按次序共收集4管),标记为L30,L100,L250-1,L250-2,L250-3,L250-4。
1.2.5 模拟胃液稳定性测定1.5 mL离心管中加入190 µL模拟胃液(SGF),37℃恒温水浴5 min。分别加入10 µL样品蛋白、模拟胃液空白对照、不稳定对照蛋白(5 mg/mL牛血清白蛋白)、稳定对照(5 mg/mL牛β-乳球蛋白B)。迅速漩涡振荡并置于37℃水浴,在每个反应时间点,迅速加入70 µL NaHCO3(0.2 mol/L)溶液,冰浴,加入70 µL 5×SDS蛋白上样缓冲液,沸水浴5 min,冷却至室温备用。蛋白反应时间和稳定对照牛β-乳球蛋白B反应时间均设置为0 s、15 s、2 min、30 min和60 min。不稳定对照牛血清白蛋白反应时间为0 s、15 s、2 min、30 min。胃蛋白酶对照组为只含胃蛋白酶的模拟胃液,试样蛋白对照为在不含胃蛋白酶的模拟胃缓冲液加入目的蛋白,其他步骤同上。
1.2.6 模拟肠液稳定性测定1.5 mL离心管中加入190 µL模拟肠消化液(SIF),37℃恒温水浴5 min。分别加入10 µL样品蛋白、模拟肠液空白对照、不稳定对照蛋白(2 mg/mL牛β-乳球蛋白B)、稳定对照(2 mg/mL大豆胰蛋白酶抑制剂),迅速漩涡振荡并快速置于37℃水浴,在每个反应时间点立即加入50 µL 5×SDS蛋白上样缓冲液,沸水浴5 min,冷却至室温进行SDS-PAGE检测。反应时间均设为0 s、15 s、2 min、30 min和60 min。胰蛋白酶对照组为只含胰蛋白酶的模拟肠液,试样蛋白对照为在不含胰蛋白酶的模拟肠缓冲液中加入目的蛋白,其他步骤同上。
1.2.7 SDS-PAGE分析取蛋白样品进行制样,100℃煮沸10 min,12 000 r/min离心10 min,取上清点样,5%浓缩胶,12%分离胶,80 V电泳20 min,120 V电泳60 min。电泳结束后取出凝胶,进行染色、脱色。
1.2.8 Western blot分析SDS-PAGE电泳完毕后,20 V电压条件先转膜48 min。转膜完毕,用PBST漂洗NC膜,之后加封闭液,80 r/min转速摇床上室温孵育1-3 h或者4℃过夜。加入用封闭液1:2 000倍稀释的AM79 EPSPS蛋白小鼠单克隆抗体,室温孵育1 h。倒掉杂交液,用PBST室温洗涤3次,每次5 min。再加入用封闭液1:8 000倍稀释的羊抗鼠二抗,室温孵育1 h,倒掉杂交液,用PBST室温洗涤3次,每次3 min。最后加入显色液室温下显色,用UVP观察结果。
2 结果 2.1 载体构建扩增AM79 EPSPS基因,在5'端和3'端分别添加BamH Ⅰ和Hind Ⅲ酶切位点。AM79 EPSPS用BamH Ⅰ和Hind Ⅲ进行酶切,连接到用相同内切酶进行酶切的pET-30a上,构建载体pET-AM79。将pET-AM79转到大肠杆菌菌株Transetta(DE3) 中,用于目的蛋白的表达纯化。
2.2 AM79蛋白诱导表达温度的确定以及可溶性分析为了探究不同温度条件对诱导目的蛋白可溶性的影响,实验设置了16℃和28℃两种温度,通过加入相同浓度的诱导剂IPTG(1mol/L)分别进行20-26 h和4-6 h诱导AM79 EPSPS蛋白,结果(图 1) 发现在两种温度条件下,蛋白表达量没有明显差别,且都是上清蛋白表达量明显低于沉淀蛋白表达量。
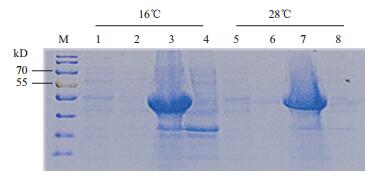
|
| 图 1 不同温度下AM79 EPSPS蛋白可溶性的SDS-PAGE检测 M:蛋白marker;1,3:分别为16℃下诱导载体pET-AM79上清和沉淀;2,4:分别为16℃诱导空载体pET-30a上清和沉淀;5,7:分别为28℃下诱导载体pET-AM79上清和沉淀;6,8:分别为28℃诱导空载体pET-30a上清和沉淀 |
首先对可溶性的AM79 EPSPS蛋白进行Ni-NTA亲和纯化,用不同浓度的咪唑洗脱收集流出液,经过SDS-PAGE检测发现在250 mmol/L咪唑浓度下洗脱的前2 mL的纯化蛋白浓度最高(图 2),考马斯亮蓝试剂盒定量后浓度最高为0.2 mg/mL。将250 mmol/L咪唑洗脱下来的蛋白用超滤离心管浓缩后再定量,以不同浓度的BSA标准蛋白作横坐标,OD595吸光值作纵坐标,绘制蛋白标准曲线(图 3)。利用标准曲线所生成的公式纯化目的蛋白定量,结果用250 mmol/L咪唑浓度下洗脱的L250-1 AM79 EPSPS蛋白浓度为5.05 mg/mL,符合国家标准要求模拟胃肠液消化蛋白的浓度。
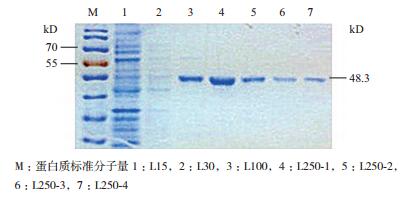
|
| 图 2 AM79 EPSPS蛋白的Ni-NTA亲和层析纯化结果 M:蛋白质标准分子量1:L15,2:L30,3:L100,4:L250-1,5:L250-2,6:L250-3,7:L250-4 |
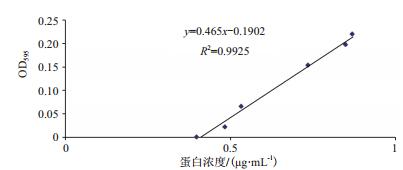
|
| 图 3 蛋白定量标准曲线 |
模拟胃液消化体系确认结果(图 4-A)显示,稳定对照牛β-乳球蛋白B(18.4 kD)在60 min内没有被降解,而不稳定对照牛乳清白蛋白(BSA)(66.4 kD)在模拟胃液中15 s就已完全消化,说明了该消化体系的稳定性及有效性,可以用于以下的转基因玉米蛋白模拟消化实验。
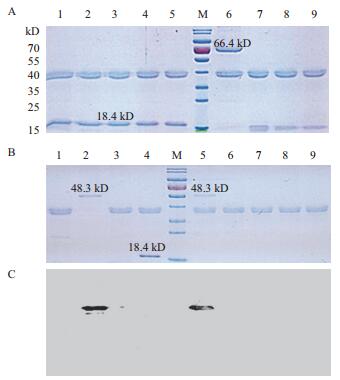
|
| 图 4 AM79蛋白在模拟胃液中消化稳定性分析 (A)1-5:稳定蛋白对照模拟胃液消化稳定蛋白(牛β-乳球蛋白B)0s,15 s,2 min,30 min,60 min;6-9:不稳定蛋白对照模拟胃液消化不稳定蛋白(牛血清白蛋白)0 s,15 s,2 min,30 min;M:蛋白标准分子量;(B,C)1:用模拟胃液处理重蒸水;2:用不含胃蛋白酶的模拟胃液处理AM79 EPSPS蛋白;3:用模拟胃液处理不稳定蛋白牛血清白蛋白2 min;4:用模拟胃液处理牛β乳球蛋白B 60 min;5-9:用模拟胃液处理AM79 EPSPS蛋白0 s,15 s,2 min,30 min,60 min;M:蛋白标准分子量 |
在该体系下,AM79 EPSPS蛋白在体外模拟胃液消化过程中,SDS-PAGE检测到消化时间0 s时尚未消化,仍然可以检测到外源蛋白条带(48.3 kD),消化时间15 s时,外源蛋白就被完全消化(图 4-B),Western bloting进一步证明了这一结果,并未检测到蛋白小片段残留(图 4-C)。
2.5 AM79 EPSPS蛋白在模拟肠液中的稳定性模拟肠液消化体系确认结果(图 5-A)显示,稳定对照大豆胰蛋白酶抑制剂(STI)(20.0 kD)在60 min内仍不能被消化,而不稳定对照β-乳球蛋白B(BLG)(18.4 kD)在模拟肠液中15 s就全部消化,这说明了该消化体系的稳定性及有效性,可以用于以下的转基因玉米蛋白模拟消化实验。
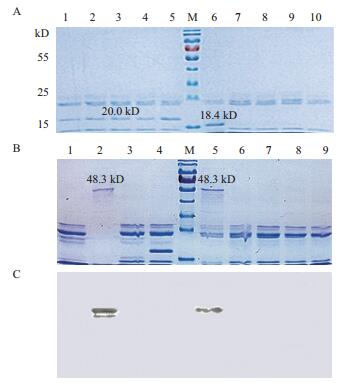
|
| 图 5 AM79 EPSPS蛋白在模拟肠液中的消化稳定性分析 (A)1-5:稳定蛋白对照模拟肠液消化稳定蛋白大豆胰蛋白酶抑制剂(STI)0 s,15 s,2 min,30 min,60 min;6-10:不稳定蛋白对照模拟肠液消化不稳定蛋白(牛β乳球蛋白B)0 s,15 s,2 min,30 min,60 min;M:蛋白标准分子量;(B,C)1:用模拟肠液处理重蒸水;2:用不含胰蛋白酶的模拟肠液处理AM79 EPSPS蛋白;3:用模拟肠液处理不稳定蛋白牛β-乳球蛋白B 2 min;4:用模拟肠液处理稳定蛋白大豆胰蛋白酶抑制剂60 min;5-9:用模拟肠液处理AM79 EPSPS蛋白0 s,15 s,2 min,30 min,60 min;M:蛋白标准分子量 |
在该体系下,用2 mg/mL的AM79 EPSPS蛋白在体外模拟肠液消化过程中,SDS-PAGE检测到0 s时外源蛋白未被消化,仍然可以检测到外源蛋白条带(48.3 kD),消化时间15 s时外源蛋白就被完全消化(图 5-B),Western bloting进一步证明了这一结果,并未检测到蛋白小片段残留(图 5-C)。
3 讨论每一个注册的转基因作物都要根据国际食品法典的建议进行安全性评价,其中包括蛋白质特性、在模拟胃肠液消化中进行稳定评估、在小鼠中进行急性高剂量口服毒性试验、与已知毒素和致敏原进行氨基酸序列比对及对非靶标生物的作用。体外模拟胃肠液消化稳定性评价恰好是最基础也是最关键的一个步骤。自1996年,Astwood等[17]首次将体外胃蛋白酶消化方法系统地应用于食物致敏元的消化稳定性评价以来,消化稳定性实验一直是外源蛋白质,尤其是通过基因工程转入传统食品中表达的蛋白质致敏性评价的重要部分。一般情况下,如果一种蛋白质暴露于胃液或肠液后能迅速被消化,可以认为其对机体产生致敏反应的机率很小[18]。目前商业化种植的转基因作物中表达的CP4 EPSPS[19]、PAT[12]、PMI[13]、HPT[14]等蛋白都进行了严格的体外模拟胃肠液试验,结果表明这些蛋白均能够被快速降解。
本实验通过原核表达并用Ni-NTA亲和层析方法纯化获得AM79 EPSPS蛋白。由于外源蛋白AM79 EPSPS浓度较低,因此运用与蛋白分子量大小相符的超滤离心管进行浓缩后参考模拟胃肠液消化稳定性试验的国家标准,将蛋白浓度设置为国家标准中的样品质量浓度(5、2 mg/mL)进行消化实验。结果显示以国家标准的质量浓度进行消化时,AM79 EPSPS蛋白及其可见片段在模拟胃液和肠液中均在15 s内完全消化,即AM79 EPSPS蛋白在模拟胃肠液中不稳定。在对AM79蛋白进行消化稳定性实验后,该蛋白都会以小肽或氨基酸的形式存在,而这些物质在人体内仅能够作为膳食来源的营养物质。除了花粉蛋白,其他所有免疫性蛋白对消化酶都有极高的稳定性,因此蛋白质的稳定性可以被认为是预测蛋白质免疫原性的重要参考数据[20]。蛋白质经过胃蛋白酶消化后形成小于3.5 kD的小肽和氨基酸,则被认为几乎不可能具有免疫原性[21]。根据以上研究进展,可以初步判断,AM79 EPSPS蛋白经过胃肠液消化后,不具有免疫原性。
4 结论得到AM79 EPSPS纯化蛋白后,在体外模拟胃肠液消化稳定性实验中,该蛋白在模拟胃液和肠液中均不稳定,15 s即被完全消化,属于极易消化蛋白,不具有免疫原性。
| [1] | Taylor SL, Hefle SL. Will genetically modified foods be allergrnic?[J]. Journal of Allergy and Clinical Immunology, 2001, 107 (5): 765–771. DOI:10.1067/mai.2001.114241 |
| [2] | Lehrer SB, Horner WE, Reese G. Why are some proteins allergenic? Implications for biotechnology[J]. Critical Reviews Food Science and Nutrition, 1996, 36 (6): 553–564. DOI:10.1080/10408399609527739 |
| [3] | Mill S, Madsen C, Shewry PR, et al. Food allergens of plant origin-their molecular and evolutionary relations[J]. Trends in Food Science & Technology, 2003, 14 (4): 145–145. |
| [4] | Bannon GA. What makes a food protein an allergen?[J]. Current Allergy Asthma Reports, 2004, 4 (1): 43–46. DOI:10.1007/s11882-004-0042-0 |
| [5] | Metcal DD. Astwood JD, Townsend R, et al. Assessment of the allergenic potential of foods derived from genetically engineered crop plants[J]. Critical Reviews Food Science and Nutrition, 1996, 36 (Suppl. 1): 165–186. |
| [6] | Taylor SL. Protein allergenicity assessment of foods produced though agricultural biotechnology[J]. Annual Review of Pharmacology and Toxicology, 2002, 42 : 99–112. DOI:10.1146/annurev.pharmtox.42.082401.130208 |
| [7] | FAO/WHO. Evaluation of allergenicity of genetically modified foods. Report of a joint FAO/WHO expert consultation on allergenicity of foods derived from biotechnology[R]. Rome:FAO/WHO, 2001. |
| [8] | Codex Alimentarius Commission. CAC/GL 45—2003 Guideline for the Confuct of Food Safety Assessment of Foods Derived from Recombinant-DNA plants[S]. |
| [9] | 中华人民共和国农业部. 农业部869号公告-2-2007转基因生物及其产品食用安全检测模拟胃肠液外源蛋白质消化稳定性实验方法[S]. 北京: 中国农业出版社, 2007. |
| [10] | Cao S, He X, Xu WT, et al. Safety assessment of Cry1C protein from gentically modified rice according to the standards of PR China for a new food resource[J]. Regulatory Toxicology and Pharmacology, 2010, 58 (3): 474–481. DOI:10.1016/j.yrtph.2010.08.018 |
| [11] | Herouet C, Rouquie D, Freyssinet M, et al. Safety evalation of the double mutant 5-enol pyruvylshikimate-3-phosphate synthase(2mEPSPS)from maize that confers tolerance to glyphosate herbicide in transgenic plants[J]. Regulatory Toxicology and Pharmacology, 2009, 54 (2): 143–153. DOI:10.1016/j.yrtph.2009.03.005 |
| [12] | Herouet C, Esdaile DJ, Mallyon BA, et al. Safety evaluation of the phosphinothricin acety1transferase proteins encoded by the pat and bar dequences that confer tolerance to glufosinate-ammonium herbicide in transgenic plants[J]. Regulatory Toxicology and Pharmacology, 2005, 41 (2): 134–149. DOI:10.1016/j.yrtph.2004.11.002 |
| [13] | Privalle LS. Phosphomannose isomerase, a novel plant selection system:potential allergenicity assessment[J]. Annals of New York Academy of Sciences, 2002, 964 : 129–138. |
| [14] | Lu Y, Xu W, Kang A, et al. Prokarytic expression and allergenicity assessment of hygromycin B phosphotransferase protein derived from genetically modified plants[J]. Journal of Food Science, 2007, 72 (7): 228–232. DOI:10.1111/jfds.2007.72.issue-7 |
| [15] | CaoGY, ChenRR, DuJ, 等. Analysis of the active sites in an 5-enolpyrvy-shikimate-3-phosphate synthase(EPSPS)gene of AM79 aroA[J]. Journal of Integrative Agriculture, 2015, 23(5): 606–616. |
| [16] | Ren ZJ, Cao GY, Zhang YW, et al. Overexpression of a modified AM79 aroA gene in transgenic maize confers high tolerance to glyphosate[J]. Journal of Integrative Agriculture, 2015, 14 (3): 414–422. DOI:10.1016/S2095-3119(14)60920-5 |
| [17] | Astwood JD, Leach JN, Fuchs RL. Stability of food allergens to digestion in vitro[J]. Nature Biotechnology, 1996, 14 (10): 1269–1273. DOI:10.1038/nbt1096-1269 |
| [18] | 杨辉, 向钱, 李宁. 食品中转基因表达蛋白的危险性评估[J]. 中国食品卫生杂志, 2010, 22(2): 173–178. |
| [19] | Harrison HA, Han CT, Hopkins RG, et al. The expressed protein in glyphosate-tolerrant soybean, 5-enolypyruvylshikimate-3-phosphate synthase from Agrobacterium sp. strain CP4, is rapidly digested in vitro and is not toxic to acutely gavaged mice[J]. The Journal of Nutrition, 2003, 133 (6): 1909–1912. |
| [20] | Astwood JD, Leach JN, Fuchs RL. Stability of food allergens to digestion in vitro[J]. Nature Biotechnology, 1996, 14 : 1269–1273. DOI:10.1038/nbt1096-1269 |
| [21] | Fu TJ, Abbott UR, Hatzos C. Digestibility of food allergens and nonallergenic proteins in simulated gastric fluid and simulated intestinal fluid-a comparative study[J]. Journal of Arricultural and Food Chemistry, 2002, 50 : 7154–7160. DOI:10.1021/jf020599h |




