病毒性疾病严重损害人类及动物的健康,疫苗接种仍是控制病毒性疾病最常用的有效方法[1]。为了提高疫苗的接种效果,大多数疫苗需要与佐剂配伍以增加其效力和刺激相应的免疫反应[2],所以研制良好的疫苗佐剂来提高疫苗的免疫效力已被视为疫苗成功的一个重要策略[3]。
新疆地处亚洲腹地,具有独特的气候群,这里天然药物资源丰富。大量的证据表明,中草药作为疫苗佐剂具有很多优势,如自然资源丰富、疗效好、毒副作用低等[4, 5]。近年来,研究者们陆续发现中草药中的多糖具有抗肿瘤、抗病毒、抗氧化等多种药理活性,也可以作为新型疫苗佐剂调节机体的免疫功能[6-8]。随着中药研究领域的扩大及中药制剂新技术的应用,新疆一枝蒿(Artemisia rupestris L.)作为一种疗效确切的药材,已被广泛应用于临床[9-11]。由于对一枝蒿用药量的不断增大,野生资源难以满足市场需要,栽培一枝蒿在新疆已经成功种植[12]。而且,前期研究发现新疆栽培一枝蒿粗多糖可以通过显著增强骨髓来源的树突状细胞(Dendritic cells,DCs)表面分子CD40、CD86及CD80、细胞因子IL-12和TNF-α的表达来促进DC的成熟[13],又研究了新疆栽培一枝蒿除蛋白的粗多糖对OVA蛋白的免疫作用,发现它能够作为OVA蛋白的佐剂来增强小鼠体液和细胞免疫应答[14]。
为了有效开发和利用新疆栽培一枝蒿,本研究在前期研究的基础上,选用新疆栽培一枝蒿未除蛋白的粗多糖为候选佐剂,配伍模式抗原OVA皮下免疫小鼠,初步探究新疆栽培一枝蒿未除蛋白的粗多糖对OVA的抗体水平和T淋巴细胞亚群的影响,为从新疆栽培一枝蒿中筛选新型疫苗佐剂提供实验参考。
1 材料与方法 1.1 材料6-8周的ICR雌性小鼠(购自新疆医科大学试验动物中心),新疆栽培一枝蒿未除蛋白粗多糖UCARCP(实验室制备,多糖含量15.23 %),新疆栽培一枝蒿除蛋白粗多糖(Cultivated Artemisia rupestris L. crude polysaccharides,CARCP,实验室制备,多糖含量23.80 %);鸡卵清白蛋白OVA购于Sigma公司;辣根过氧化物酶标记的Goat Anti-Mouse IgG、IgG1、IgG2a购自美国Southbiotech公司;N-四甲基联苯胺(TMB)购自上海蓝季科技发展有限公司;RPMI-1640培养液购自Gibco公司;PE Rat-Anti Mouse CD3、APC Rat-Mouse CD4、FITC Rat-Anti Mouse CD8a等均购自美国BD公司。
1.2 方法 1.2.1 免疫用UCARCP配伍OVA,以ICR雌性小鼠为实验动物模型,采用皮下注射的方式免疫小鼠,UCARCP以多糖含量表示,铝佐剂为阳性对照组,每只小鼠的注射体积为100 μL,共免疫2次,初免后2周加强1次。免疫分组情况见表 1。免疫后每周对小鼠进行眼眶采血,并分离制备血清。
通过间接ELISA法检测小鼠血清中OVA特异性抗体的水平。首先用100 μL 10 μg/mL的OVA溶液作为抗原包被96孔ELISA板,4℃过夜;200 μL PBST洗两次,再用5 %脱脂奶粉37℃封闭1 h;PBST洗两次后加入稀释的待测血清100 μL作为一抗,37℃孵育1 h;PBST洗后再加入100 μL HRP标记的抗鼠IgG、IgG1、IgG2a二抗,孵育1h;经PBST洗3次后,用四甲基联苯胺(TMB)底物溶液避光显色10 min,每孔加入50 μL 2 mol/L H2SO4终止反应,酶标仪于450 nm/655 nm双波长下检测光吸收值。
1.2.3 流式细胞术检测脾脏中CD3+CD4+和CD3+CD8+ T淋巴细胞的含量小鼠初免21 d后,取出脾脏经裂解红细胞后制成细胞浓度为1×107 cells/mL的单细胞悬液。取100 μL脾细胞悬液加入8 mL PBS/0.5 %FBS,经1 200 r/min离心7 min后,弃上清得到细胞沉淀,细胞计数后,每份1×106 cells/100 μL用PE-CD3、APC-CD4、FITC-CD8a进行三染法,常温避光染色30 min,8 mL PBS/0.5% FBS终止染色后,1 200 r/min离心7 min,弃上清用400 μL PBS重悬后经200目的铜网过滤至流式上样管中,经流式细胞仪检测后用Flowjo 7.6.1分析CD3+CD4+和CD3+CD8+ T淋巴细胞亚群的百分比。
1.2.4 数据分析数据均以平均值±标准差(x±s)的形式表示,用软件GraphPad Prism 5.01处理并分析数据,通过Student’s t-test分析不同组数据之间的差异性,*P < 0.05表示差异显著,** P < 0.01表示差异极显著。
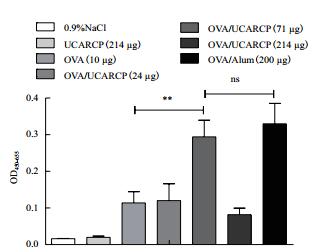
2 结果 2.1 UCARCP免疫后对小鼠抗体IgG水平的影响为探究UCARCP配伍OVA免疫后对小鼠体液免疫反应的影响,本实验以多糖含量为标准,选用低(24 μg)、中(71 μg)、高(214 μg)3个剂量筛选合适的UCARCP剂量,通过间接ELISA法检测初免后14 d的IgG抗体水平,结果如图 1,UCARCP中剂量配伍OVA免疫能极显著提高IgG的表达水平(P < 0.01),与铝佐剂相当,而低剂量和高剂量不能显著提高IgG的表达水平(P > 0.05)。
|
| 图 1 间接ELISA法检测小鼠初免疫14 d血清中抗体IgG水平 *P < 0.05表示差异显著,**P < 0.01表示差异极显著,ns表示无显著性差异,下同 |
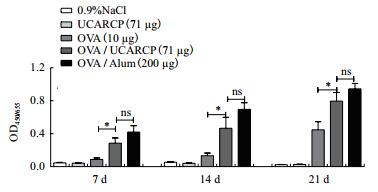
以上实验结果确定了UCARCP的最佳免疫剂量为中剂量,因此,用间接ELISA法检测了中剂量组免疫后不同时期小鼠血清中OVA特异性IgG水平的差异。结果如图 2所示,初免后7 d、14 d、21 d的抗体水平逐渐升高;UCARCP单独免疫组没有激发抗体水平,但中剂量的OVA/UCARCP组免疫激发的抗体水平均显著高于OVA组(P < 0.05),且作用效果与OVA/Alum相当(P > 0.05)。
|
| 图 2 间接ELISA法检测初免后不同时间点抗体IgG |
间接ELISA法测定初免后21 d小鼠血清中抗体IgG及亚型的结果如图 3所示,OVA诱导抗体IgG1的表达水平最高,IgG次之,IgG2a最低;UCARCP单独免疫并不能诱导OVA特异性抗体水平,但中剂量的OVA/UCARCP组抗体IgG及IgG1水平显著高于OVA组(P < 0.05),且极显著促进IgG2a的表达(P < 0.01),作用效果均与OVA/Alum无显著性差异(P > 0.05)。

|
| 图 3 间接ELISA法检测初免后21 d小鼠血清中抗体IgG及亚型 |
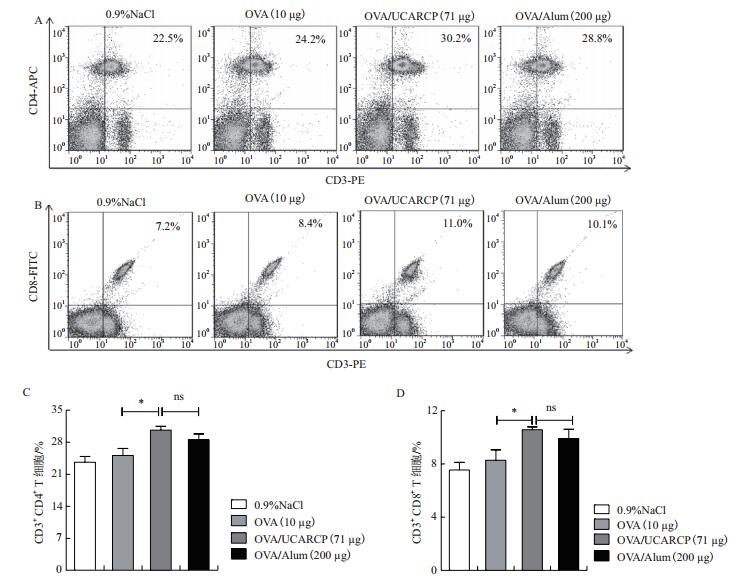
为了观察小鼠免疫后T细胞的免疫水平,于小鼠初免后21 d,通过流式细胞术检测脾脏淋巴细胞中CD3+CD4+和CD3+CD8+ T细胞的含量,结果如图 4A-D所示,中剂量的UCARCP配伍OVA后,CD3+CD4+和CD3+CD8+ T细胞在脾脏淋巴细胞中的百分率与对照组OVA相比有所升高,均显著高于OVA单独免疫组(P < 0.05);OVA/UCARCP组和OVA/Alum组的相比没有显著差异(P > 0.05)。
|
| 图 4 流式细胞术检测CD3+CD4+和CD3+CD8+T细胞 |
为了比较新疆栽培一枝蒿未除蛋白和除蛋白的粗多糖佐剂效果的差异,以多糖含量为标准,分别用其配伍OVA皮下免疫小鼠后,通过间接ELISA法检测21 d抗体及分型水平。结果如图 5,UCARCP和CARCP组均能显著提高抗体IgG及分型IgG1和IgG2a水平(P < 0.05),而且两者相比无显著性差异(P > 0.05)。

|
| 图 5 间接ELISA法检测初免后21 d小鼠血清中抗体IgG及亚型 |
研究表明,植物提取成分的活性与其剂量有很大的相关性[15]。基于此,本研究首先对UCARCP的免疫剂量进行初步筛选,结果发现UCARCP中剂量配伍OVA能够有效激发小鼠的抗体水平,因此后续实验采用中剂量进行相关实验指标的检测。本实验选用铝佐剂为阳性对照,以多糖含量为标准配伍OVA进行免疫实验,间接ELISA法测定初免后7 d、14 d、21 d小鼠抗体IgG水平,UCARCP能显著促进OVA免疫诱导的抗体水平,且初免后21d小鼠的IgG1IgG1和IgG2a的抗体水平也显著升高,且与铝佐剂组的水平相当,说明新疆栽培一枝蒿未除蛋白的粗多糖对OVA抗原诱导的特异性体液免疫有显著的增强效果,且能平衡地促进Th1/Th2混合型免疫反应。
CD4+和CD8+ T淋巴细胞亚群主要由细胞免疫介导的,CD3+CD4+ T细胞是Th2型细胞,能够分泌抗体或细胞因子,作用于B淋巴细胞或抗原递呈细胞,促进B细胞成熟或增强抗原递呈细胞递呈抗原的能力。CD3+CD8+ T细胞是Th1型细胞,能够直接杀伤靶细胞[16, 17]。因此研究CD3+CD4+和CD3+CD8+ T细胞的含量是检测细胞免疫反应的重要指标。近几年的研究表明,中草药提取物能够增强黄羽肉鸡生产性能和T淋巴细胞亚群[18],不同制备工艺板蓝根多糖对小鼠脾淋巴细胞具有增殖的作用[19],野生仙人掌多糖对小鼠特异性免疫功能具有调节作用[20],贵州南五味子多糖能促进鸡细胞免疫和体液免疫,使CD4+/CD8+淋巴细胞比值明显升高[21]。本实验通过流式细胞术检测T淋巴细胞亚群的含量,结果发现UCARCP能显著提高OVA免疫诱导CD3+CD4+和CD3+CD8+ T细胞的含量,且与铝佐剂组的水平相当,说明UCARCP能增强Th1型和Th2型免疫反应。
为了提高栽培一枝蒿的利用率,降低候选佐剂的生产成本,本实验以多糖含量为标准,比较了新疆栽培一枝蒿未除蛋白和除蛋白粗多糖对小鼠抗体水平的影响,结果发现小鼠初免后21 d未除蛋白的粗多糖诱导IgG及分型的抗体水平与除蛋白的粗多糖无显著差异。这些研究结果初步表明,未除蛋白的粗多糖与除蛋白的粗多糖差异不大,深入的比较实验还需进一步进行。综上所述,新疆一枝蒿未除蛋白的粗多糖能增强OVA免疫后小鼠诱导的体液免疫反应和细胞免疫反应,具有良好的免疫佐剂活性,为有效的利用栽培一枝蒿筛选疫苗佐剂提供了依据。
4 结论新疆栽培一枝蒿未除蛋白的粗多糖配伍OVA免疫小鼠后能够显著性提高小鼠抗体IgG、抗体分型IgG1和IgG2a的水平,能显著提高OVA免疫诱导CD3+CD4+和CD3+CD8+ T细胞的表达,且与铝佐剂组的水平相当。此外,未除蛋白的新疆栽培一枝蒿粗多糖诱导小鼠抗体IgG及分型的水平与除蛋白的新疆栽培一枝蒿粗多糖无显著差异。
| [1] | O'Hagan DT, MacKichan ML, Singh M. Recent developments in adjuvants for vaccines against infectious diseases[J]. Biomolecular engineering, 2001, 18 (3): 69–85. DOI:10.1016/S1389-0344(01)00101-0 |
| [2] | Knudsen NPH, Olsen A, Buonsanti C, et al. Different human vaccine adjuvants promote distinct antigen-independent immunological signatures tailored to different pathogens[J]. Scientific Reports, 2016, 6 : 1–13. DOI:10.1038/s41598-016-0001-8 |
| [3] | Tang YH, Lu JH, Wu PP, et al. Inactivated vaccine with adjuvants consisting of pattern recognition receptor agonists confers protection against avian influenza viruses in chickens[J]. Veterinary Microbiology, 2014, 172 (1): 120–128. |
| [4] | Wang YY, Huang MY, Sun RL, et al. Extraction, characterization of a Ginseng fruits polysaccharide and its immune modulating activities in rats with Lewis lung carcinoma[J]. Carbohydrate Polymers, 2015, 127 : 215–221. DOI:10.1016/j.carbpol.2015.03.070 |
| [5] | Feng HB, Du XG, Liu J, et al. Novel polysaccharide from Radix Cyathulae officinalis Kuan can improve immune response to ovalbumin in mice[J]. International Journal of Biological Macromolecules, 2014, 65 : 121–128. DOI:10.1016/j.ijbiomac.2014.01.017 |
| [6] | Feng HB, Fan J, Qiu H, et al. Chuanminshen violaceum polysaccharides improve the immune responses of foot-and-mouth disease vaccine in mice[J]. International Journal of Biological Macromolecules, 2015, 78 : 405–416. DOI:10.1016/j.ijbiomac.2015.04.044 |
| [7] | Jin ML, Zhao K, Huang QS, et al. Structural features and biological activities of the polysaccharides from Astragalus membranaceus[J]. International Journal of Biological Macromolecules, 2014, 64 : 257–266. DOI:10.1016/j.ijbiomac.2013.12.002 |
| [8] | Belska NV, Guriev AM, Danilets MG, et al. Water-soluble polysaccharide obtained from Acorus calamus L. classically activates macrophages and stimulates Th1 response[J]. International Immunopharmacology, 2010, 10 (8): 933–942. DOI:10.1016/j.intimp.2010.05.005 |
| [9] | Gu D, Yang Y, Abdulla R, et al. Characterization and identification of chemical compositions in the extract of Artemisia rupestris L. by liquid chromatography coupled to quadrupole time-of-flight tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2012, 26 (1): 83–100. DOI:10.1002/rcm.5289 |
| [10] | 陈蕾, 姜雯, 潘晓梅, 等. 复方一枝蒿微丸抗炎、免疫及抗菌作用研究[J]. 新疆医科大学学报, 2016, 39(2): 179–183. |
| [11] | 马俊鹏, 朱卫江, 卢冬梅. 一枝蒿提取物调节小鼠免疫功能的研究[J]. 西北药学杂志, 2009, 24(3): 197–199. |
| [12] | 徐鑫, 晁群芳, 方美珠. 新疆一枝蒿多糖的体外抗氧化性研究[J]. 食品科技, 2011, 36(12): 202–206. |
| [13] | 杨雨, 杨秀梅, 张爱莲, 等. 新疆野生及栽培一枝蒿多糖对树突状细胞免疫功能的影响[J]. 生物技术通报, 2016, 32(7): 217–226. |
| [14] | 张爱莲, 王丹阳, 赵淑述, 等. 新疆栽培一枝蒿粗多糖对OVA蛋白疫苗的免疫增强作用[J]. 中华微生物学和免疫学杂志, 2016, 36(9): 654–661. |
| [15] | 刘姚, 欧阳克蕙, 葛霞, 等. 植物多糖生物活性研究进展[J]. 江苏农业科学, 2013, 41(1): 1–4. |
| [16] | Zhang WJ, Wang JP, Su BW, et al. Cimetidine augments Th1/Th2 dual polarized immune responses to recombinant HBV antigens[J]. Vaccine, 2011, 29 : 4862–4868. DOI:10.1016/j.vaccine.2011.03.091 |
| [17] | 计越, 金宁一, 鲁会军, 等. 载基因壳聚糖纳米粒的制备及免疫增强作用的初步研究[J]. 中国生物工程杂志, 2008, 28(2): 37–41. |
| [18] | 胡友军, 林映才, 周桂莲, 等. 补益类中草药提取物对黄羽肉鸡生产性能和T淋巴细胞亚群的影响[J]. 中国畜牧杂志, 2004, 40(9): 23–25. |
| [19] | 马莉, 冯少华, 唐健元, 等. 不同制备工艺板蓝根多糖对小鼠脾淋巴细胞增殖作用的影响[J]. 中国药房, 2007, 18(3): 169–171. |
| [20] | 赵龙岩, 张松蓬, 袁清霞. 野生仙人掌多糖对小鼠特异性免疫功能的调节作用[J]. 中药材, 2012, 35(1): 98–102. |
| [21] | 王宏军, 蒋红, 邓旭明. 贵州南五味子多糖对鸡细胞免疫和体液免疫的影响[J]. 中国兽医学报, 2011, 31(6): 884–886. |