抗体类药物以其高特异性、高亲和力且对人体低毒害性等优点,已成为当今医药产业的主流研发产品。动物细胞培养技术以其生产的抗体类蛋白结构稳定且具有正确的糖基化结构而被产业界广泛接受[1]。作为动物细胞培养的关键要素,培养基及其添加剂在抗体类药物生产工艺中的作用毋庸置疑。蛋白水解物以其成本低廉、无毒害且效果显著等优势,被广泛作为血清替代物或营养增强剂添加于细胞培养基中[2, 3]。
作为蛋白水解物中的一个大类,酵母抽提物(YE)因具有显著促进重组蛋白表达的作用,在动物细胞培养领域获得了广泛的应用,且其批次间具有组分差异小、效果稳定等优点[4, 5]。YE是以发酵得到的面包酵母或酿酒酵母为原料,经细胞自溶、酶解等过程将胞内蛋白、核酸等降解为多肽、氨基酸以及核苷酸等小分子,再通过超滤及干燥而得到的产品[6]。其中富含多肽、氨基酸、核苷酸、维生素以及微量元素等营养物质[7]。尽管YE在细胞培养领域的应用很多,但系统性地研究其在动物细胞培养过程中的作用以及使用策略的报道仍十分有限。因此,深入认识YE在动物细胞培养过程中如何发挥作用及其对关键参数的影响特性,将有助于YE乃至其他蛋白水解物在动物细胞培养领域的应用推广。
为此,本研究以表达单克隆抗体的CHO细胞为研究对象,综合考察了不同浓度YE对连续传代、批式培养以及长期连续传代后批式培养等过程中的细胞生长、代谢及产物表达的影响,旨为YE在动物细胞培养的生物制药产业的应用以及高效无血清培养基的开发提供借鉴和依据。
1 材料与方法 1.1 材料本研究所用细胞株为表达单克隆抗体的重组CHO细胞株。实验所用的基础培养基(BM)为实验室自主开发,所用的YE购自Kerry Group公司。其他培养基配制所用试剂均购自Sigma-Aldrich公司。培养基配制完后经0.22 µm微孔滤膜(Millipore)过滤除菌后使用。
1.2 方法 1.2.1 细胞培养 1.2.1.1 种子细胞传代培养CHO细胞从细胞库中复苏后,采用基础培养基重悬并接种于50 mL细胞培养管(瑞士TPP AG公司),接种体积为20 mL,置于37℃、5% CO2饱和湿度的培养箱中进行悬浮培养,摇床转速为220 r/min。每48小时进行种子细胞传代扩增,传代后活细胞密度控制在(4-6)×105 cells/mL。
1.2.1.2 批式培养取指数生长期的种子细胞,经1 000 r/min离心5 min,弃上清,用新鲜BM培养基进行重悬。以1.0×106 cells/mL左右的活细胞密度接种于50 mL细胞培养管,接种体积为20 mL。根据实验设计额外添加所需的YE浓缩液(200 g/L)。将细胞培养管置于37℃、5% CO2饱和湿度的培养箱中进行悬浮培养,摇床转速为220 r/min。每组实验重复3次。培养过程中自第0天起每天取样600 μL进行细胞计数,经10 000 r/min离心5 min后取上清液于-80℃保存,用于抗体产量和营养物及代谢物的检测。
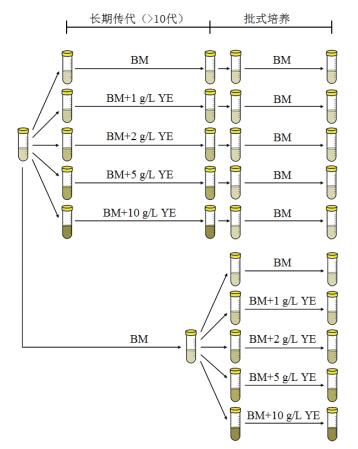
1.2.2 实验方案本研究所涉及的细胞实验分为采用不同浓度YE的BM培养基对细胞进行连续传代后接种于BM培养基进行批式培养和采用BM培养基对细胞进行连续传代后接种于不同浓度YE的BM培养基进行批式培养两大部分(图 1)。
|
| 图 1 细胞传代培养和批式培养实验流程示意图 |
细胞密度采用细胞计数仪(CounterStar)进行计数,并利用台盼蓝拒染法确定细胞的活性。
1.2.3.2 抗体浓度检测抗体浓度采用亲和色谱的方法[8]进行检测,色谱柱为POROS Protein A affinity column,4.0×50 mm(Applied Biosystems)。
1.2.3.3 葡萄糖、乳酸和氨的检测葡萄糖、乳酸和氨的浓度测定分别采用葡萄糖试剂盒(上海科欣生物技术研究所)、乳酸测定试剂盒(南京建成生物工程研究所)和Berthelot尿素氮测定试剂盒(上海科欣生物技术研究所,不使用脲酶,改用NH4Cl作为铵离子标准液),操作按照试剂盒说明书进行。
1.2.3.4 培养上清中氨基酸的检测氨基酸检测采用高效液相色谱法(安捷伦1260 HPLC)测定。样品经OPA按说明书设置程序在线柱前自动衍生,经反相色谱柱(ZORBAX Eclipse AAA)分离后,采用DAD紫外检测器(激发波长:338 nm,发射波长:390 nm)进行检测。氨基酸标准品购自美国Thermo Fisher公司。
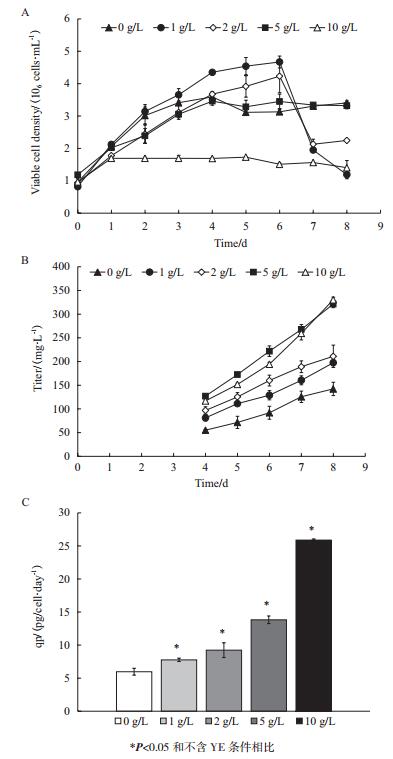
1.2.3.5 数据分析比生长速率μ通过以下公式计算:
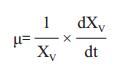
XV为活细胞密度(106cells/mL),t为培养时间(day)。
抗体的比生成速率qp通过以下公式进行计算:
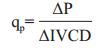
其中qp为抗体的比生成速率(mg/109cells/day或pg/cell/day);P为抗体浓度(mg/L);IVCD为活细胞密度对时间的积分(109cells·day/L)。
上清中营养物及代谢物的比生成/消耗速率参考抗体的比生成速率计算公式进行计算或采用浓度与IVCD进行线性拟合求斜率的方法获得。
2 结果 2.1 连续传代过程中YE对CHO细胞生长的影响为了研究细胞传代过程中YE的添加对CHO细胞生长的影响,分别考察了0、1、2、5和10 g/L YE浓度条件下CHO细胞的传代情况。
图 2-A是CHO细胞在不同YE浓度条件下的细胞传代曲线。结果表明,单独的BM培养基以及不同YE浓度条件下CHO细胞均能以稳定的比生长速率进行生长和连续传代。同时,不同浓度的YE对细胞生长具有不同的影响。通过公式计算得到细胞平均比生长速率如图 2-B所示。当培养基中不含YE(0 g/L)时,细胞的比生长速率维持在0.78±0.04/d。随着YE添加量的提高,细胞的比生长速率呈现先升高后下降的趋势。其中,当YE浓度为1 g/L时,细胞比生长速率达到最高,为0.86±0.03/d;YE浓度为2 g/L时,细胞比生长速率与未添加YE组基本一致,为0.76±0.05/d;当YE浓度继续增加,细胞生长开始受到抑制,比生长速率显著低于未添加YE组(P < 0.05),并于10 g/L时达到最低值,为0.53±0.06/d。
|
| 图 2 CHO细胞在不同YE浓度下的传代曲线(A)以及比生长速率(B) *P < 0.05和不含YE条件相比 |
通过以上连续传代实验可知YE会显著影响CHO细胞在传代过程中的生长情况。为了研究经YE长期传代后的种子细胞在批式培养过程中的表现,采用BM培养基对上述连续传代12-13次的CHO细胞进行批式培养。
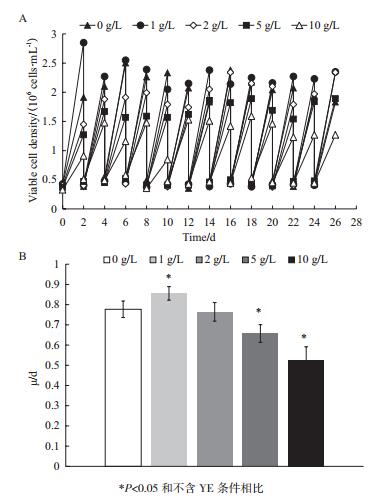
2.2.1 细胞生长和产物表达图 3-A所示为经不同YE浓度条件下连续传代的CHO细胞接种至BM培养基中进行批式培养的细胞生长曲线。由图可知,不同来源的CHO种子细胞经离心接种后在相同培养基(BM)中的生长情况基本一致,最大活细胞密度均在(4.9-5.2)×106 cells/mL之间。图 3-B为批式培养过程中抗体的表达曲线。同细胞生长情况类似,不同实验组中抗体表达也基本一致,均于第10天培养结束时达到最大产物浓度,约为200 mg/L。
|
| 图 3 不同YE浓度下长期传代的CHO细胞在BM培养基中批式培养的生长(A)及抗体表达(B)情况 |
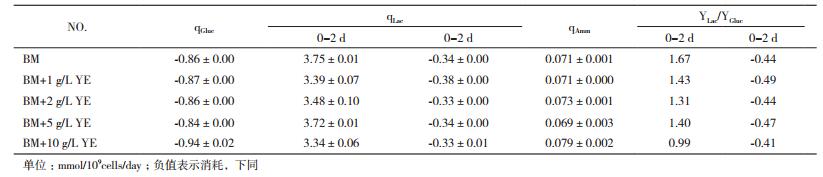
表 1所示为不同YE浓度下长期传代的CHO细胞在批式培养过程中葡萄糖(Gluc)、乳酸(Lac)和氨(Amm)的代谢数据。总体而言,与细胞生长和产物表达类似,不同培养基传代获得的种子细胞在批式培养过程中的代谢特征基本一致,乳酸代谢同样呈现先生成后消耗的趋势。其中,在批式培养前期(0-2 d)乳酸对葡萄糖的得率系数(YLac/YGluc)呈现一定趋势,随着YE浓度的提高,YLac/YGluc从单纯BM条件下的1.67降低至10 g/L YE时的0.99。
以上结果表明,CHO细胞连续传代过程中YE的添加对其生长具有显著影响。低浓度(1 g/L)的YE促进细胞生长,高浓度(5-10 g/L)的YE抑制细胞生长。CHO种子细胞在含YE的培养基中长期传代对细胞在批式培养中的生长、产物表达及营养物代谢基本无影响。其中,仅YLac/YGluc随YE浓度增加而降低。
2.3 YE对CHO细胞批式培养的影响为了继续研究YE作为培养基添加物在细胞批式培养过程中的影响,分别采用YE浓度为0、1、2、5和10 g/L的BM培养基进行CHO细胞批式培养实验。
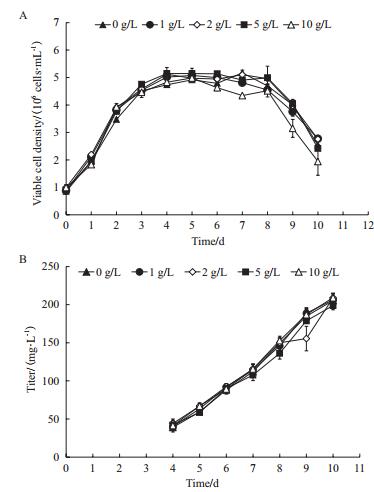
2.3.1 细胞生长和产物表达图 4-A所示为CHO细胞在不同YE浓度的BM培养基中进行批式培养的细胞生长曲线。由图可知,细胞在不同YE浓度的BM培养基中的生长情况存在较大差异。与传代实验中细胞生长情况相似,随着YE浓度的提高,批式培养所能达到的最大活细胞密度呈现出先上升后下降的趋势。当YE浓度为1 g/L时,批式培养所能达到的最大活细胞密度最高,为4.7×106 cells/mL。随着YE浓度的进一步提高(≥2 g/L),培养过程所能达到的最大活细胞密度逐渐下降。当YE浓度为10 g/L时,批式培养所能达到的最大活细胞密度下降到1.7×106 cells/mL,细胞生长被显著抑制。
|
| 图 4 CHO细胞在不同浓度YE的BM培养基中批式培养的生长(A)、抗体表达(B)以及产物比生成速率(C)情况 *P < 0.05和不含YE条件相比 |
抗体的表达同样呈现出较大差异(图 4-B)。未添加YE时,产物终浓度最低。随着YE浓度的提高,产物终浓度逐渐增加。当YE浓度为10 g/L时,产物终浓度最高,达到了330.4±5.4 mg/L。通过计算发现,产物比生成速率在不同YE浓度条件下同样具有显著差异且随着YE浓度的提高而升高(图 4-C)。当YE浓度为10 g/L时,产物比生成速率最大,达到了25.8±0.2 pg/cell/d,为无YE条件下的4.3倍。
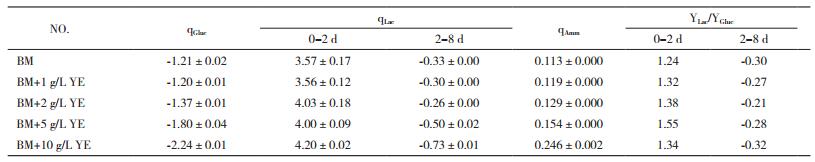
2.3.2 营养物和副产物代谢CHO细胞在不同YE浓度的BM培养基中进行批式培养的葡萄糖、乳酸和氨的代谢情况如表 2所示。总体来说,葡萄糖、乳酸及氨的比消耗/生成速率均随着培养基中YE浓度的提高而增加。其中,当YE浓度为10 g/L时,葡萄糖比生成速率最大,为2.24±0.01 mmol/109cells/d。同时,10 g/L条件下批式培养前期和后期的乳酸比生成和比消耗速率也均为最大,分别达到了4.20±0.02和0.73±0.01 mmol/109cells/day;氨的比生成速率则达到了0.246±0.002 mmol/109cells/d,为无YE条件下的2.2倍。由于葡萄糖和乳酸比生成/消耗速率均随着YE浓度提高而增加,最终计算得到的各YE浓度下批式培养前期和后期YLac/YGluc均基本一致。
YE中富含大量的小分子多肽及游离氨基酸。这些物质被认为是蛋白水解物中影响细胞生长及产物表达的主要有效成分[2]。因此,检测培养体系中氨基酸的代谢情况有助于了解YE中这些营养物质在批式培养过程中所发挥的作用。图 5所示为批式培养过程中必需氨基酸(EAA,图 5-A)和非必需氨基酸(NAA,图 5-B)的代谢情况。当YE浓度在0-5 g/L之间时,除Gly和Ala呈生成状态外,绝大多数氨基酸比消耗速率均随着YE浓度的提高而增加。当YE达到10 g/L时,氨基酸代谢表现出较大差异。其中,Asn和Gln的比消耗速率显著高于其他实验组,Gly和Ala的比生成速率也显著高于其他实验组。必需氨基酸中Val、Ile和Lys出现了净生成的状态。同时,许多其他氨基酸,如Thr、Trp、His、Arg、Tyr以及Cys等,比消耗速率也出现了明显下降,而由2.3.1的结果可知10 g/L条件下产物比生成速率却是最高的。因此,猜测该条件下细胞可能更多地利用多肽中的氨基酸进行代谢和物质合成。
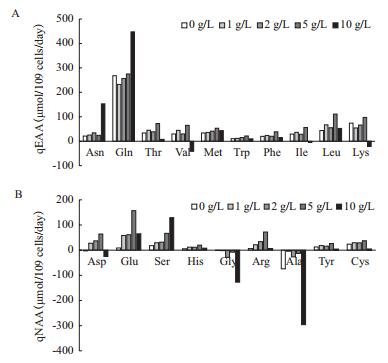
|
| 图 5 CHO细胞在不同YE浓度的批式培养过程中必需氨基酸和非必需氨基酸的代谢情况 |
以上结果表明,批式培养过程中添加YE能够显著影响细胞生长、产物表达和营养物代谢。低浓度(1 g/L)的YE促进细胞生长,高浓度(10 g/L)的YE抑制细胞生长。产物比生成速率随着YE浓度的提高而升高。综合细胞生长与产物比生成速率随YE浓度的变化情况,10 g/L的添加量使得最终的产物浓度最高。同时,YE的添加能够提高细胞对营养物质的利用,尤其是降解和利用YE中的多肽组分。
3 讨论在细胞长期连续传代方面,YE的添加对细胞比生长速率影响显著,低浓度(1 g/L)的YE有利于CHO细胞的生长,而高浓度(5-10 g/L)的YE则会抑制细胞的生长。YE源自于酵母细胞的自溶和酶解,其中包含多肽、氨基酸、寡糖、核苷酸、维生素以及微量元素等多种物质[7]。诸多文献报道,非葡萄糖碳源[9]、寡肽[10, 11]、核苷酸[12, 13]及微量元素[14]等物质的添加均能促进细胞的生长。因此,低浓度的YE可能弥补了基础培养基中缺乏的部分营养物,从而有利于细胞的生长。YE中同时富含高比例的小分子有机物和无机盐类,1 g/L的添加量会使得培养体系的渗透压提高6-10 mOsm/Kg[5]。本研究中YE浓度为5-10 g/L时,培养体系渗透压达到了360-420 mOsm/Kg,故而过高的渗透压可能是抑制细胞生长的主要原因[15]。将在不同浓度YE的基础培养基中长期传代后的CHO细胞进行批式培养实验发现,传代过程中YE的添加量对细胞在批式培养过程中的生长及产物表达均无显著影响。这说明YE可安全应用于种子细胞扩增阶段的培养基中。营养物代谢方面,总体而言影响不显著,仅乳酸对葡萄糖的得率系数(YLac/YGluc)随YE添加量的提高而降低。这表示消耗单位葡萄糖生成的乳酸减少,进入TCA循环的比例提高,其物质代谢效率更高,能够为细胞供应更多能量。
在细胞批式培养方面,YE对细胞生长的影响同连续传代类似,低浓度(1 g/L)促进细胞生长,高浓度(10 g/L)抑制细胞生长。抗体的比生成速率则随着YE浓度的提高而增加。YE对重组蛋白表达的促进作用已有诸多报道[4, 16, 17]。研究发现,YE对蛋白表达的促进作用可能与mRNA转录水平的提高相关[5]。因YE中化学成分复杂,仅能结合相关研究猜测其中发挥效用的物质可能为有机酸,如丁酸[18]、戊酸[19],活性多肽[10]或者其他小分子物质[20]等。同时,高浓度的YE能够显著提升培养体系的渗透压,而高渗条件有利于CHO细胞对胞内重组蛋白的分泌[21]。因此,借助于高渗效应,YE对CHO细胞表达重组蛋白的促进作用更加突出。在营养物代谢方面,YE的添加能够提高细胞对葡萄糖的摄取速率,促进了细胞对葡萄糖的利用。同时YLac/YGluc基本维持一致,即消耗单位葡萄糖进入TCA循环的比例相近,物质代谢效率相似。因此,高YE浓度条件下细胞对葡萄糖比消耗速率较高,单位细胞分解葡萄糖获取能量的速率较大,充裕的能量供给同样有助于重组蛋白的表达。这一现象在文献中也有所报道[22, 23]。高浓度(10 g/L)的YE条件下,多种必需氨基酸出现了净生成的情况。而细胞无法通过其他物质自行合成这些氨基酸,可能的解释是细胞利用了YE中的多肽并将其降解成了游离氨基酸[24]。这一现象说明YE中的多肽在过程中被细胞利用,也为文献中所提及的细胞更倾向于利用水解物中寡肽的观点提供了一个实例[25, 26]。
传代扩增和批式培养是CHO细胞表达重组蛋白生产工艺中的两个典型培养过程。传代扩增阶段,细胞比生长速率的高低是其过程优劣的重要指标;而在批式培养过程中,较高的产物比生成速率往往意味着更高的体积产率和高效的产能。总体而言,这两大过程的目标和需求具有一定的“矛盾性”。本研究发现,YE可同时满足这两大过程的需求,但需要采用不同的添加策略。这也为以往研究文献中YE添加浓度的差异[4, 5, 17]提供了合理的解释。综上所述,通过采用细胞生长阶段低浓度、产物培养阶段高浓度的添加策略,可将YE高效应用于表达重组蛋白的CHO细胞培养过程。
4 结论本研究综合考察了YE在CHO细胞传代扩增阶段以及批式培养阶段对细胞生长及抗体表达的影响。结果表明,低浓度(1 g/L)的YE在这两个阶段均能促进CHO细胞的生长而高浓度(5-10 g/L)时则显著抑制其生长;抗体的比生成速率则随着YE浓度(0-10 g/L)的提高而增加。综合而言,YE的使用宜选择细胞生长阶段低浓度、产物表达阶段高浓度的添加策略。YE在动物细胞培养领域具有巨大的应用价值和潜力。
| [1] | Kim JY, Kim YG, Lee GM. CHO cells in biotechnology for production of recombinant proteins:current state and further potential[J]. Appl Microbiol Biotechnol, 2012, 93 (3): 917–930. DOI:10.1007/s00253-011-3758-5 |
| [2] | Vijai KP, Arnold LD, Chris H, et al. Protein Hydrolysates in Biotechnology[M]. London, New York: Springer Dordrecht Heidelberg, 2010. |
| [3] | 谷瑞增, 刘艳, 林峰, 等. 蛋白水解物在动物细胞培养中的应用研究进展[J]. 生物技术通报, 2012(9): 21–27. |
| [4] | Ho SC, Nian R, Woen S, et al. Impact of hydrolysates on monoclonal antibody productivity, purification and quality in Chinese hamster ovary cells[J]. J Biosci Bioeng, 2016, 122 (4): 499–506. DOI:10.1016/j.jbiosc.2016.03.003 |
| [5] | Sung YH, Lim SW, Chung JY, et al. Yeast hydrolysate as a low-cost additive to serum-free medium for the production of human thrombopoietin in suspension cultures of Chinese hamster ovary cells[J]. Appl Microbiol Biotechnol, 2004, 63 (5): 527–536. DOI:10.1007/s00253-003-1389-1 |
| [6] | 王学东, 阎兵. 酵母抽提物的生产及应用[J]. 食品安全导刊, 2011(10): 43–45. |
| [7] | Sommer R. Yeast extracts:production, properties and components[J]. Food Australia, 1998, 50 (4): 181–183. |
| [8] | Yang JD, Lu C, Stasny B, et al. Fed-batch bioreactor process scale-up from 3-L to 2, 500-L scale for monoclonal antibody production from cell culture[J]. Biotechnol Bioeng, 2007, 98 (1): 141–154. DOI:10.1002/(ISSN)1097-0290 |
| [9] | Sun Y, Zhao L, Ye Z, et al. Development of a fed-batch cultivation for antibody-producing cells based on combined feeding strategy of glucose and galactose[J]. Biochemical Engineering Journal, 2013, 81 : 126–135. DOI:10.1016/j.bej.2013.10.012 |
| [10] | Franěk F, Fussenegger M. Survival factor-like activity of small peptides in hybridoma and CHO cells cultures[J]. Biotechnology Progress, 2005, 21 (1): 96–98. |
| [11] | Kishishita S, Katayama S, Kodaira K, et al. Optimization of chemically defined feed media for monoclonal antibody production in Chinese hamster ovary cells[J]. Journal of Bioscience and Bioengineering, 2015, 120 (1): 78–84. DOI:10.1016/j.jbiosc.2014.11.022 |
| [12] | Kondo M, Yamaoka T, Honda S, et al. The rate of cell growth is regulated by purine biosynthesis via ATP production and G1 to S phase transition[J]. Journal of Biochemistry, 2000, 128 (1): 57–64. DOI:10.1093/oxfordjournals.jbchem.a022730 |
| [13] | Chen F, Fan L, Wang J, et al. Insight into the roles of hypoxanthine and thydimine on cultivating antibody-producing CHO cells:cell growth, antibody production and long-term stability[J]. Applied Microbiology and Biotechnology, 2012, 93 (1): 169–178. DOI:10.1007/s00253-011-3484-z |
| [14] | 张鑫涛, 唐红萍, 赵亮, 等. 金属离子对CHO细胞抗体表达及抗体电荷分布的影响[J]. 生物技术通报, 2016, 32(8): 233–241. |
| [15] | Han YK, Kim YG, Kim JY, et al. Hyperosmotic stress induces autophagy and apoptosis in recombinant Chinese hamster ovary cell culture[J]. Biotechnology and bioengineering, 2010, 105 (6): 1187–1192. |
| [16] | Kim SH, Lee GM. Development of serum-free medium supplemented with hydrolysates for the production of therapeutic antibodies in CHO cell cultures using design of experiments[J]. Appl Microbiol Biotechnol, 2009, 83 (4): 639–648. DOI:10.1007/s00253-009-1903-1 |
| [17] | Mosser M, Chevalot I, Olmos E, et al. Combination of yeast hydrolysates to improve CHO cell growth and IgG production[J]. Cytotechnology, 2013, 65 (4): 629–641. DOI:10.1007/s10616-012-9519-1 |
| [18] | Jiang Z, Sharfstein ST. Sodium butyrate stimulates monoclonal antibody over-expression in CHO cells by improving gene access-ibility[J]. Biotechnology and Bioengineering, 2008, 100 (1): 189–194. DOI:10.1002/(ISSN)1097-0290 |
| [19] | Coronel J, Klausing S, Heinrich C, et al. Valeric acid supplementa-tion combined to mild hypothermia increases productivity in CHO cell cultivations[J]. Biochemical Engineering Journal, 2016, 114 : 101–109. DOI:10.1016/j.bej.2016.06.031 |
| [20] | Allen MJ, Boyce JP, Trentalange MT, et al. Identification of novel small molecule enhancers of protein production by cultured mammalian cells[J]. Biotechnology and Bioengineering, 2008, 100 (6): 1193–1204. DOI:10.1002/(ISSN)1097-0290 |
| [21] | Sun Z, Zhou R, Liang S, et al. Hyperosmotic stress in murine hybridoma cells:effects on antibody transcription, translation, posttranslational processing, and the cell cycle[J]. Biotechnology Progress, 2004, 20 (2): 576–589. |
| [22] | Kim JY, Kim YG, Han YK, et al. Proteomic understanding of intracellular responses of recombinant Chinese hamster ovary cells cultivated in serum-free medium supplemented with hydrolysates[J]. Appl Microbiol Biotechnol, 2011, 89 (6): 1917–1928. DOI:10.1007/s00253-011-3106-9 |
| [23] | Lee HW, Christie A, Starkey JA, et al. Intracellular metabolic flux analysis of CHO cells supplemented with wheat hydrolysates for improved mAb production and cell-growth[J]. J Chem Technol Biot, 2015, 90 (2): 291–302. DOI:10.1002/jctb.2015.90.issue-2 |
| [24] | Nyberg GB, Balcarcel RR, Follstad BD, et al. Metabolism of peptide amino acids by Chinese hamster ovary cells grown in a complex medium[J]. Biotechnology and Bioengineering, 1999, 62 (3): 324–335. DOI:10.1002/(ISSN)1097-0290 |
| [25] | Gupta AJ, Gruppen H, Maes D, et al. Factors causing compositional changes in soy protein hydrolysates and effects on cell culture functionality[J]. J Agric Food Chem, 2013, 61 (45): 10613–10625. DOI:10.1021/jf403051z |
| [26] | Mosser M, Kapel R, Chevalot I, et al. Fractionation of yeast extract by nanofiltration process to assess key compounds involved in CHO cell culture improvement[J]. Biotechnol Prog, 2015, 31 (4): 875–882. DOI:10.1002/btpr.2110 |