胸腺素 (Thymosin) 是一类在人类的健康和疾病中发挥不同重要作用的小分子蛋白。根据等电点的不同分为3个家族:胸腺素α(pI < pH5.0),胸腺素β(pH5.0 < pI < ph7.0),胸腺素γ(pI > pH7.0)[1]。胸腺素β10是β族胸腺素中的一个重要成员,属于Tβ4的一种类似物[2],包括43个氨基酸残基,具有两个α螺旋结构。目前对Tβ10的研究集中于其在肿瘤[3-7]、胚胎[8]、神经发育系统[9]和炎症细胞[10-12]中的差异表达,以及Tβ10在血管发生[13]、细胞生长和凋亡[14-16]方面的作用。同时,Tβ10被认为与细胞骨架结构有关,影响细胞形态、细胞增殖、运动型等[17-20]。本实验室通过前期实验结果,发现Tβ10在鹿茸快速生长期高度表达,说明Tβ10可能与鹿茸的生长和再生相关。通过构建梅花鹿Tβ10基因的真核表达载体,以期为研究其在鹿茸生长和再生中的作用机制提供有力的工具。
1 材料与方法 1.1 材料表达载体VR1012、E.coli DH5α菌株、鹿茸材料和293T细胞由本实验室保存。TRIZOL和双抗购自Invitrogen公司;pMD-18 T vector、反转录试剂盒、PCR相关试剂、限制性内切酶、DNA连接酶、胶回收试剂盒及质粒提取试剂盒等购自TaKaRa公司;转染试剂Fugene®6购自Promega公司;鼠抗HA单克隆抗体和鼠抗Tubulin单克隆抗体购自covance公司;Alexa Fluor 488绿色荧光标记二抗购自Thermo Fisher公司;DAPI购自Roche公司;碱性磷酸酶标记的兔抗小鼠二抗购自Jackson公司;DMEM培养基、胎牛血清、胰蛋白酶购自Gibco公司;细胞爬片、6孔板购自Nest公司;其他生化试剂均为国产分析纯或进口分装试剂。PCR引物由长春华大中天生物技术有限公司合成。
1.2 方法 1.2.1 细胞培养293T细胞培养于DMEM培养基,加入10%血清和1%双抗,37℃,5% CO2条件下培养。待细胞生长至汇合度90%时传代培养。
1.2.2 鹿茸cDNA的获取新鲜的梅花鹿茸取下后迅速放入液氮中,冷冻后置于液氮中研磨,0.05 g组织加入1 mL TRIZOL试剂,匀浆后室温静置10 min,加入0.3 mL氯仿剧烈震荡15 s,室温静置2-3 min,4℃条件下12 000 r/min离心20 min,上清加入1/5体积的5 mol/L NaCl混匀,再加入1/3体积的氯仿,震荡15 s,静置2 min,4℃条件下10 000 r/min离心15 min,上清加入1/2上清体积的混合液 (0.8 mol/L柠檬酸钠,1.2 mol/L NaCl) 与1/2上清体积的异丙醇,震荡后4℃放置90 min,4℃条件下10 000 r/min离心15 min,弃上清,75%的乙醇洗涤2次,无水乙醇洗涤1次,4℃条件下7 500 r/min离心5 min,弃上清,干燥15 min,DEPC水溶解沉淀RNA。使用逆转录酶以及Oligo (dt) 进行逆转录PCR获得cDNA。
1.2.3 Tβ10基因的PCR扩增和亚克隆载体构建以转录组测序得到的序列设计引物,上游引物:5'-TCTAGAGCCACCATGGCAGACAAGC-3'(引入Xba Ⅰ酶切位点和kozak序列) 下游引物:5'-GGATCCTTAAGCGTAGTCTGGGACGTCGTATGGGTACTTTGCTTGCTTC-3'(引入HA标签和BamH Ⅰ酶切位点) 进行PCR扩增,程序为94℃预变性2 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,扩增30个循环,最后72℃延伸10 min。所得片段经胶回收后与pMD-18 T亚克隆载体16℃连接过夜。转化感受态DH5α细胞,接种氨苄抗性的LB固体培养基,37℃过夜培养,挑取单克隆,提取质粒后进行酶切鉴定和测序鉴定。
1.2.4 真核表达载体构建和鉴定取测序正确的pMD-18 T-Tβ10-HA质粒和真核表达质粒VR1012分别进行Xba Ⅰ和BamH Ⅰ双酶切,将目的片段和载体片段经胶回收后使用T4DNA连接酶16℃连接过夜,连接产物转化感受态DH5α细胞,接种卡那抗性的LB固体培养基,37℃过夜培养,挑取单克隆,提取质粒后进行酶切鉴定。
1.2.5 VR1012-Tβ10-HA转染293T细胞在6孔细胞培养板中加入细胞爬片,再将胰酶消化后的293T细胞接种于细胞培养板。在5% CO2、37℃的细胞培养箱中生长至汇合度达到70%。使用Fugene®6转染试剂将重组质粒VR1012-Tβ10-HA转入293T细胞。
1.2.6 免疫印迹转染36-48 h后收集细胞,PBS冲洗1次除去残留培养基,RIPA裂解缓冲液裂解细胞。加入上样缓冲液混合并煮沸10 min致蛋白变性,使用SDS聚丙烯酰胺凝胶电泳来分离样品。通过半干转仪将凝胶上的蛋白转移至硝酸纤维素膜上。硝酸纤维素膜在5%的脱脂牛奶中在室温封闭30 min,PBST溶液冲洗1次,加入含有一抗的1% PBS脱脂牛奶,室温摇动孵育1-2 h或者4℃过夜,弃一抗,用PBST溶液漂洗3次,每次5 min。再加入混有对应二抗的1%PBS脱脂牛奶,室温摇动孵育45 min。再用PBST溶液漂洗3次,PBS溶液漂洗1次,最后加入酶联二抗的显色底物,至特异性条带清晰可见时,终止反应。
1.2.7 免疫荧光293T细胞接种于放置有细胞爬片的24孔细胞培养板中,待细胞汇合度达到20%-50%时使用Fugene®6转染试剂转染VR1012-Tβ10-HA。24 h后弃上清,加入4%多聚甲醛溶液,室温固定10 min。弃去固定液,用0.1%的Triton X-100室温孵育8 min,用含有10% FBS的PBS溶液室温封闭10 min。PBS溶液冲洗1次,加入一抗,室温孵育1-2 h。弃去一抗,用PBST溶液冲洗3次。将对应二抗溶液加入孔板中,室温孵育1 h。弃去二抗,用PBST冲洗3次。加入含有1 μg/mL DAPI的PBS溶液,孵育5 min后用PBS溶液冲洗1次。取出细胞爬片,细胞面冲下倒扣于载玻片上,使用荧光显微镜采集荧光图像,分析蛋白的表达及细胞定位情况。
2 结果 2.1 Tβ10 cDNA的PCR扩增结果从梅花鹿鹿茸组织中提取细胞总RNA,使用nano drop 2000测定OD260/OD280为1.9,通过琼脂糖凝胶电泳可见3条清晰条带,分别为28S、18S和5S (图 1,第1泳道),说明RNA无污染,纯度较好。经RT-PCR技术获取cDNA,以其为模板,根据转录组测序得到的序列设计引物,进行PCR反应。经琼脂糖凝胶电泳以DNA Marker为对照,在100-250 bp左右可见一条特异性亮带,与预期大小相符 (图 1,第4泳道)。PCR产物经胶回收后,连接至亚克隆载体pMD-18 T (图 2,第3泳道)。质粒线性大小应为2 867 bp,但由于质粒的超螺旋结构,在电泳结果呈现出1 000-2 000 bp大小的条带。连接后的重组质粒经Xba Ⅰ和BamH Ⅰ双酶切鉴定,在2 000-3 000 bp和100-250 bp两处可见特异性条带 (图 2,第4泳道),分别为pMD-18 T线性片段及Tβ10-HA片段。提示目的片段成功插入到pMD-18 T载体中。采用通用引物RV-M测序,结果证明插入片段无突变,构建成功。测序结果与转录组数据库中序列匹配率为100%。
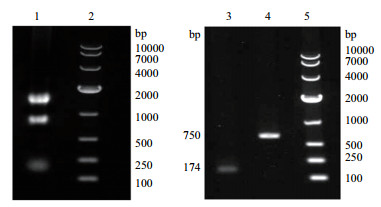
|
| 图 1 鹿茸软骨细胞RNA提取以及Tβ10基因的PCR扩增结果 1:鹿茸总RNA;2,5:DNA分子量标准;3:Tβ10基因;4:β-actin基因 |
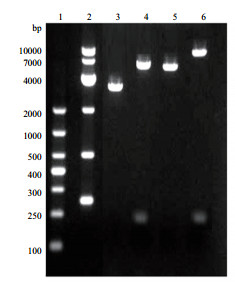
|
| 图 2 亚克隆载体pMD-18 T-Tβ10-HA和真核表达载体VR1012-Tβ10-HA的双酶切鉴定 1,2:DNA分子量标准;3:pMD-18T-Tβ10-HA质粒;4:pMD-18T-Tβ10-HA质粒双酶切鉴定;5:VR1012-Tβ10-HA质粒;6:VR1012-Tβ10-HA质粒双酶切鉴定 |
取测序正确的重组质粒经双酶切获取目的片段,插入到真核表达载体VR1012中,并进行琼脂糖凝胶电泳分析 (图 2)。质粒线性大小应为5 000 bp左右,但由于质粒的超螺旋结构,在电泳结果呈现出2 000-3 000 bp大小的条带。经双酶切鉴定,在5 000 bp和100-250 bp两处可见特异性条带,分别为VR1012线性片段及Tβ10-HA片段,证明VR1012-Tβ10-HA构建成功。
2.3 梅花鹿Tβ10基因及蛋白序列分析分析梅花鹿Tβ10基因可知,其全长为129 bp,共编码42个氨基酸。预测的与肌动蛋白结合的首要位点为18LKKTET23(图 3)。将梅花鹿Tβ10与人、牛、马、小鼠、大鼠和猪等不同物种的Tβ10基因序列和氨基酸序列进行同源性比较,得出核苷酸同源性分别为86.7%、99.2%、86.7%、85.2%、85.2%和96.1%,蛋白同源性分别为86.4%、97.6%、86.4%、86.4%、86.4%和100%。说明在进化上梅花鹿Tβ10与牛和猪Tβ10较为接近。

|
| 图 3 梅花鹿Tβ10核酸和蛋白序列与其他物种的同源性比较 |
转染VR1012-Tβ10-HA质粒转染293T细胞,48 h后收取细胞进行Western blotting分析,结果 (图 4) 表明,与转染空载体VR1012的对照细胞样品相比,转染VR1012-Tβ10-HA的样品在6 kD处可见一特异性条带,说明梅花鹿Tβ10基因在293T细胞中得到了表达。

|
| 图 4 梅花鹿Tβ10在293T细胞中过表达的Western blot分析结果 1:转染VR1012-Tβ10-HA的293T细胞;2:预染蛋白质分子量标准 |
通过荧光显微镜观察可见,转染重组质粒的细胞可见明显的绿色荧光,说明梅花鹿Tβ10基因得到了表达。同时蛋白主要表达于细胞质中,细胞核内几乎无表达。而未转染的293T细胞和转染空载体的阴性对照则未见绿色荧光。再次说明了梅花鹿Tβ10在293T细胞中得到了成功表达 (图 5)。
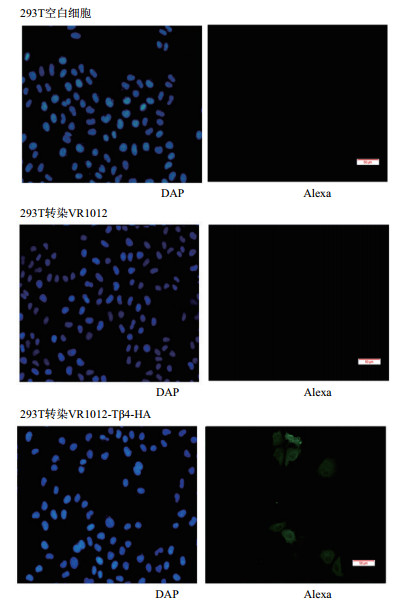
|
| 图 5 梅花鹿Tβ10-HA在293T中过表达的免疫荧光检测结果 |
胸腺素β10是一种普遍存在于各种组织细胞当中的淋巴细胞生长因子,参与多种重要的生理和病理活动,一直是研究的热点。鹿茸是目前发现的唯一可再生哺乳动物器官,鹿茸生长速度极快,最快时可以1-2 cm的速度迅速生长,最终可长至120 cm。鹿茸的快速生长和再生机制目前尚不明确。通过对鹿茸不同生长时期的转录组数据库进行测序分析,发现Tβ10在快速生长期表达量上调,说明其可能与鹿茸的生长发育有一定关系。本研究通过构建梅花鹿Tβ10真核表达载体,为进一步研究其在鹿茸生长发育过程中的作用奠定了基础。
由于鹿茸软骨中存在较多蛋白,本研究采用改良的Trizol法来提取总RNA。该方法可除去绝大部分蛋白及多糖杂质,得到较为纯净的RNA。同时,本研究首次成功克隆得到了Tβ10的基因序列,与人、牛、马、小鼠、大鼠和猪等不同物种的Tβ10基因序列和氨基酸序列进行同源性比较,得出核苷酸同源性分别为86.7%、99.2%、86.7%、85.2%、85.2%和96.1%,蛋白同源性分别为86.4%、97.6%、86.4%、86.4%、86.4%和100%。说明Tβ10在进化上非常保守,梅花鹿Tβ10的氨基酸序列与牛和猪Tβ10更为接近,与人、马、大鼠和小鼠Tβ10的C端有一定差异,这是否会影响梅花鹿Tβ10的功能,是未来要研究的一个内容。
利用本实验所构建的Tβ10真核表达质粒,可以通过瞬时转染或稳定转染软骨细胞,研究Tβ10是否可以促进软骨细胞生长,刺激软骨细胞分化;同时可以利用本研究发现的Tβ10序列,构建原核表达质粒,获得重组Tβ10蛋白,研究其对软骨细胞增值的影响,从而深入探索Tβ10在鹿茸软骨细胞快速增长过程中所起的作用。
4 结论本研究从梅花鹿鹿茸中获得了Tβ10的cDNA,通过Xba Ⅰ和BamH Ⅰ酶切位点连入VR1012真核表达质粒,成功构建梅花鹿Tβ10真核表达载体,使用Western blotting和免疫荧光技术验证了其在293T细胞中的表达。
| [1] | Chen C, Li M, Yang H, et al. Roles of thymosins in cancers and other organ systems[J]. World J Surg, 2005, 29 (3): 264–270. DOI:10.1007/s00268-004-7817-2 |
| [2] | Erickson-Viitanen S, Ruggieri S, Natalini P, et al. Thymosin beta 10, a new analog of thymosin beta 4 in mammalian tissues[J]. Arch Biochem Biophys, 1983, 225 (2): 407–413. DOI:10.1016/0003-9861(83)90047-4 |
| [3] | Wang H, Ji an, S, Zhang Y, et al. High expression of thymosin beta 10 predicts poor prognosis for hepatocellular carcinoma after hepatectomy[J]. World J Surg Oncol, 2014, 12 : 266. DOI:10.1186/1477-7819-12-266 |
| [4] | Gu Y, Wang C, Wang Y, et al. Expression of thymosin beta10 and its role in non-small cell lung cancer[J]. Hum Pathol, 2009, 40 (1): 117–124. DOI:10.1016/j.humpath.2008.06.023 |
| [5] | Oien KA, Vass JK, Downie I, et al. Profiling, comparison and validation of gene expression in gastric carcinoma and normal stomach[J]. Oncogene, 2003, 22 (27): 4287–4300. DOI:10.1038/sj.onc.1206615 |
| [6] | Huang L, Zheng M, Zhou Q, et al. Identification of a gene-expression signature for predicting lymph node metastasis in patients with early stage cervical carcinoma[J]. Cancer, 2011, 117 (15): 3363–3373. DOI:10.1002/cncr.v117.15 |
| [7] | Alldinger I, Dittert D, Peiper M, et al. Gene expression analysis of pancreatic cell lines reveals genes overexpressed in pancreatic cancer[J]. Pancreatology, 2005, 5 (4-5): 370–379. DOI:10.1159/000086537 |
| [8] | Lin SC, Morrison-Bogorad M. Developmental expression of mRNAs encoding thymosins beta 4 and beta 10 in rat brain and other tissues[J]. J Mol Neurosci, 1990, 2 (1): 35–44. DOI:10.1007/BF02896924 |
| [9] | Nakanishi F, Ohkawa K, Ishida H, et al. Alteration in gene expression profile by full-length hepatitis B virus genome[J]. Intervirology, 2005, 48 (2-3): 77–83. DOI:10.1159/000081732 |
| [10] | Ka SM, Rifai A, Chen JH, et al. Glomerular crescent-related biomarkers in a murine model of chronic graft versus host disease[J]. Nephrol Dial Transplant, 2006, 21 (2): 288–298. DOI:10.1093/ndt/gfi229 |
| [11] | Tsuji M, Monkawa T, Yoshino J, et al. Microarray analysis of a reversible model and an irreversible model of anti-Thy-1 nephritis[J]. Kidney Int, 2006, 69 (6): 996–1004. DOI:10.1038/sj.ki.5000191 |
| [12] | Gutierrez-Pabello JA, McMurray DN, Adams LG. Upregulation of thymosin beta-10 by Mycobacterium bovis infection of bovine macrophages is associated with apoptosis[J]. Infect Immun, 2002, 70 (4): 2121–2127. DOI:10.1128/IAI.70.4.2121-2127.2002 |
| [13] | Lin SC, Morrison-Bogorad M. Cloning and characterization of a testis-specific thymosin beta 10 cDNAexpression in post-meiotic male germ cells[J]. J Biol Chem, 1991, 266 (34): 23347–23353. |
| [14] | Maelan AE, Rasmussen TK, Larsson LI. Localization of thymosin beta10 in breast cancer cells: relationship to actin cytoskeletal remodeling and cell motility[J]. Histochem Cell Biol, 2007, 127 (1): 109–113. |
| [15] | Mu H, Ohashi R, Yang H, et al. Thymosin beta10 inhibits cell mig-ration and capillary-like tube formation of human coronary artery endothelial cells[J]. Cell Motil Cytoskeleton, 2006, 63 (4): 222–230. DOI:10.1002/(ISSN)1097-0169 |
| [16] | Hall AK. Thymosin beta-10 accelerates apoptosis[J]. Cell Mol Biol Res, 1995, 41 (3): 167–180. |
| [17] | Eadie JS, Kim SW, Allen PG, et al. C-terminal variations in beta-thymosin family members specify functional differences in actin-binding properties[J]. J Cell Biochem, 2000, 77 (2): 277–287. DOI:10.1002/(ISSN)1097-4644 |
| [18] | Santelli G, Califano D, Chiappetta G, et al. Advances in thymosin beta10 research: differential expression, molecular mechanisms, and clinical implications in cancer and other conditions[J]. Cancer Invest, 2009, 27 (10): 1016–1022. DOI:10.3109/07357900902849640 |
| [19] | Xue B, Aguda AH, Robinson RC. Models of the actin-bound forms of the beta-thymosins[J]. Ann N Y Acad Sci, 2007, 1112 (1): 56–66. DOI:10.1196/annals.1415.010 |
| [20] | Lee SH, Zhang W, Choi JJ, et al. Overexpression of the thymosin beta-10 gene in human ovarian cancer cells disrupts F-actin stress fiber and leads to apoptosis[J]. Oncogene, 2001, 20 (46): 6700–6706. DOI:10.1038/sj.onc.1204683 |




