2. 兰州军区兰州总医院骨科研究所,兰州 730050
2. Institute of Bone Injury, Lanzhou General Hospital of Lanzhou Military Area Command of Chinese PLA, Lanzhou 730050
大鼠神经源性分化蛋白 (Neurogenic differertia-tion,NeuroD) 属于Ⅱ类碱性螺旋-环-螺旋 (Basic helix-loop-helix,bHLH) 蛋白家族成员[1-3],其基因位于2q32,是一种含bHLH结构域并结合E-box的转录因子,在神经分化过程中起重要作用[4],其中NeuroD亚类 (NeuroD,Nex-1[Math-2],Math-3,and NeuroD2[NDRF]) 大部分在神经发育过程中表达[5]。NeuroD2基因主要表达于大脑组织中,是控制神经分化的关键基因,其表达可从胚胎第11天开始持续到成年,Farah等[6]通过上调NeuroD2的表达使来源于小鼠胚胎的P19细胞获得神经元样形态并表达神经特异性蛋白β-tubulin Ⅲ。
本研究通过对大鼠NeuroD2基因的CDS区进行克隆并分析其序列,构建重组表达载体pIRES2-AcGFP1-ND2,转染小鼠MSCs并检测其表达情况,以期为后续研究该载体诱导MSCs向神经元样细胞分化提供理论依据。
1 材料与方法 1.1 材料 1.1.1 实验材料取4只清洁级成年Wistar大鼠,体重 (150±10 g),雌雄不限,颈动脉处死后迅速取其大脑组织,于液氮中储存备用。质粒、菌株及细胞真核表达载体pIRES2-AcGFP1、克隆载体pMD20-T vector及E. coli DH5α均购自TaKaRa公司;小鼠骨髓间充质干细胞D1细胞株购自美国ATCC公司 (CRL-10915)。
1.1.2 主要试剂高保真聚合酶、PrimeScriptTM1st Strand cDNA Synthesis试剂盒、SYBR® Green荧光定量试剂及DNA Marker均购自TaKaRa公司;质粒小提试剂盒和琼脂糖凝胶回收试剂盒购自康为世纪生物科技有限公司;限制性内切酶Nhe Ⅰ和Bam HI购自New England Biolabs;T4连接酶购自Therom Fisher公司;琼脂糖、琼脂粉、胰蛋白胨、酵母浸出粉、氨苄青霉素、IPTG和X-Gal均购自上海生工公司;卡那霉素购自上海麦克林生化科技有限公司;NeuroD2抗体购自Abcam公司;胎牛血清购自浙江天杭科技有限公司;D-MEM/F12培养基购自Gibco;Trizol、Lipofectamine2000和Opti-MEM Medium购自Invitrogen公司。
1.2 方法 1.2.1 引物设计与合成根据NCBI数据库收录的Norway大鼠NeuroD2基因mRNA序列 (NM_019326.1),采用Primer Premier5.0软件针对CDS区设计一对引物,并在引物上下游分别插入Nhe Ⅰ和Bam HI酶切位点及相应保护碱基 (下划线所示)。F:5'-CGGCTAGCCGCATGCTGACCCGCCTGTT-3',R:5'-CGGGATCCCGGGCCGGACAAAGGCAAAG-3'。
1.2.2 总RNA提取及RT-PCR使用Trizol法提取大鼠大脑总RNA,紫外分光光度计测定浓度及纯度后,于-80℃冰箱保存备用。按反转录说明书步骤将总RNA反转录后进行PCR扩增,PCR反应条件:98℃ 10 s,63.6℃ 5s,72℃ 1 min,30个循环,PCR产物用1%琼脂糖凝胶电泳检测。
1.2.3 大鼠NeuroD2基因的克隆PCR产物通过1%琼脂糖凝胶电泳回收纯化后,取1 μL PCR产物、1 μL pMD20-Tvector和3 μL灭菌蒸馏水混匀后,加入5 μL Ligation Mighty Mix,轻轻混匀,16℃ 30 min进行连接。连接后将产物导入E.coli DH5α感受态培养并筛选阳性克隆菌落,通过Nhe Ⅰ和Bam HI双酶切鉴定后,送北京擎科生物技术有限公司进行测序。
1.2.4 大鼠NeuroD2基因的生物信息学分析使用在线软件ProtParam (http://web.expasy.org/protparam/)、SWISS-MODEL (http://swissmodel.expasy.org/)、Predictprotein (http://www.predic-tprotein.org)、SOPMA (http://nhjy.hzau.edu.cn/kech/swxxx/jakj/dianzi/Bioinf7/Expasy/Expasy8.htm)、MotiFinder (http://quasimotifinder.tau.ac.il/)、TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)、PSORT Ⅱ Prediction (http://psort.hgc.jp/form.html) 预测NeuroD2蛋白的结构、功能域及亚细胞定位。通过软件MegAlign和BLAST对牛 (NM_001205958)、黑猩猩 (XM_511456)、人 (NM_006160)、罗猴 (NM_001265801)、热带爪蟾 (NM_001079018)、斑马鱼 (NM_131082)、挪威鼠 (NM_019326)、家鼠 (NM_010895) 进行同源性分析。
1.2.5 真核表达载体pIRES2-AcGFP1-ND2的构建将克隆质粒pMD20-ND2和pIRES2-AcGFP1载体用Nhe Ⅰ和Bam HI双酶切后,回收目的基因和表达载体片段,T4连接酶16℃过夜连接,将连接产物转化至E.coli DH5α感受态细胞,并筛选阳性克隆菌落。
1.2.6 小鼠MSCs的培养及转染将小鼠MSCs按0.25×104个/孔接种于6孔板中,培养于含10%胎牛血清的D-MEM/F-12完全培养基中,37℃ 5% CO2,待细胞贴壁率达70%-90%时开始转染。转染分为实验组 (pIRES2-AcGFP1-ND2) 和对照组 (pIRES2-AcGFP1),每组重复3次。用无血清Opti-MEM培养基清洗细胞3次后,按Lipofectamine2000说明书配置转染体系,转染6 h更换完全培养基,培养24 h后在荧光显微镜下观察AcGFP1的表达。随意挑选5个高倍镜视野 (×400),每个视野分别计数200个细胞并计算表达AcGFP1蛋白的阳性细胞比例。
1.2.7 Real-time PCR检测重组质粒在小鼠MSCs中的表达转染24 h后提取细胞总RNA,反转录后根据NeuroD2基因 (NM_019326.1) 设计引物:F:5'-CCTGCTACTCCAAGACGCAGAA-3',R:5'-CAG-AGTCTGCACGTAGGACACCA-3'。以小鼠GAPDH基因为内参:F:5'-AGGTCGGTGTGAACGGATTTG-3',R:5'-TGTAGACCATGTAGTTGAGGTCA-3'。Real-time PCR反应体系20 μL,SYBR® Green 10 μL,上下游引物各0.6 μL,Rox 0.8 μL,cDNA 2 μL,ddH2O 6 μL;反应条件:95℃ 30 s,95℃ 5 s,60℃ 31 s,40个循环;每组重复4次,所得结果采用2-ΔΔCt法进行计算分析。
1.2.8 免疫荧光和Western blot法检测重组质粒在小鼠MSCs中的表达在含无菌盖玻片的培养皿中转染小鼠MSCs 72 h,待细胞贴壁率在70%-90%时弃去培养基,爬片经4%多聚甲醛固定、0.01 mol/L PBS清洗、0.5% TritonX-100作用后,5% BSA封闭30 min,滴加稀释后的NeuroD2一抗 (1:1 000),4℃孵育过夜,0.01 mol/L PBS清洗3次,滴加FITC标记的二抗 (1:200),37℃避光孵育1 h,PBS清洗3次,滴加浓度为5 mg/mL DAPI染色5 min,蒸馏水冲洗3次,缓冲磷酸甘油封片,荧光显微镜观察结果。
转染72 h后的细胞,通过RIPA裂解液裂解并收集,4℃ 12 000 r/min离心30 min,收集上清。对提取的总蛋白进行定量和变性,按20 μg/孔上样并进行SDS-PAGE电泳分离,5%脱脂奶粉室温封闭2 h,浓度为NeuroD2(1:500) 和β-actin (1:1 000) 的一抗中4℃孵育过夜。0.01 mol/L TBST洗膜后加HRP标记的羊抗兔二抗 (1:10 000),37℃孵育2 h,0.01 mol/L TBST清洗4次,ECL显影曝光,使用Ipwin 32软件对条带进行灰度值扫描。
1.2.9 结果统计分析实验数据采用SPSS18.0进行统计学分析,以x±s表示,组间比较采用t检验,以P < 0.05为差异有统计学意义,图表采用GraphPad Prism 5软件进行绘制。
2 结果 2.1 NeuroD2基因的扩增与克隆RT-PCR产物经1%琼脂糖凝胶电泳检测,可见一条1 200 bp左右条带,与目的基因大小相符 (图 1-A);克隆后的阳性质粒,采用限制性内切酶Nhe Ⅰ和Bam HI酶切后可见2 500 bp和1 200 bp左右条带,结果与预期大小相近 (图 1-B)。

|
| 图 1 大鼠Neuro D2基因RT-PCR产物和pMD20-ND2双酶切凝胶电泳图 M:DNA Marker;1:RT-PCR产物;2:克隆质粒pMD20-ND2双酶切产物 |
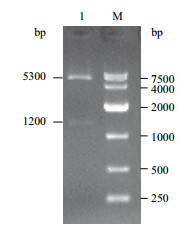
重组后的质粒pIRES2-AcGFP1-ND2进行Nhe Ⅰ和Bam HI双酶切,得到两条片段,长度分别约5 300 bp和1 200 bp,与预期NeuroD2基因和表达载体片段大小一致 (图 2)。
|
| 图 2 重组质粒双酶切凝胶电泳图 1:重组质粒pIRES2-AcGFP1-ND2双酶切产物;M:DNA Marker |
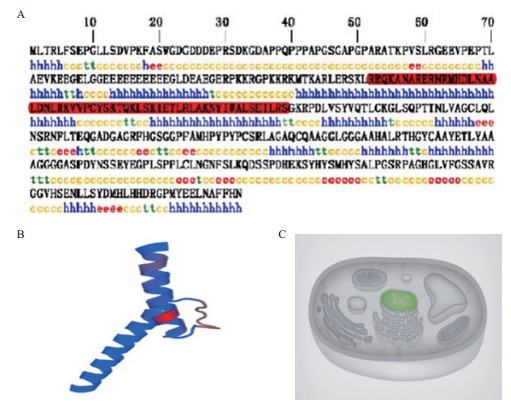
通过BLAST比对确定测序所得序列为大鼠NeuroD2基因,利用ORF Finder软件对所得序列分析结果表明,该基因CDS区长为1 149 bp,编码382个氨基酸 (图 3)。Protparam软件预测该蛋白质分子式为C18O6H2981N589O532S6,分子质量为4.16 kD,理论等电点为10.74。SOPMA分析发现其二级结构主要以α-螺旋与无规卷曲为主,其中α-螺旋占37.43%、无规卷曲46.07%、β-折叠占6.58%(图 4-A)。利用SWISS-MODEL对该蛋白的三维结构进行预测,结果显示主要由位于122-180位的氨基酸构成“螺旋-环-螺旋”(bHLH) 结构 (图 4-B),有12个位点的氨基酸与bHLH结构的保守位点相符。通过PSORT在线分析,得知NeuroD2蛋白主要存在于细胞核中 (图 4-C),可信度为99。

|
| 图 3 NeuroD2基因CDS区及其编码蛋白的序列 |
|
| 图 4 NeuroD2基因编码蛋白的二级结构预测及其细胞中的定位 A:NeuroD2蛋白二级结构,h为α-螺旋,c为无规卷曲,t为β-折叠,e为延伸链;B:NeuroD2蛋白的空间结构;C:蛋白的细胞定位 |
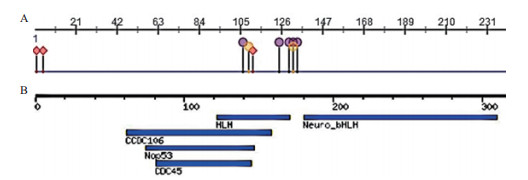
使用Predictprotion与MotifFinder对NeuroD2蛋白结构与功能域进行预测,得出RNA结合位点位于第104、106-109、122-123、127、131位,DNA结合位点位于第107-109、123、129位 (图 5-A);180-310位氨基酸形成Neuronal helix-loop-helix转录因子,74-147位的氨基酸有可能参与形成60S核糖体亚基形成,81-145氨基酸可能形成CDC45蛋白 (图 5-B)。
|
|
图 5 NeuroD2蛋白的结构及功能域
A:编码氨基酸序列的结构位点 |
通过MegAlign比对发现Wistar大鼠NeuroD2氨基酸序列与家鼠、罗猴、人、黑猩猩、牛、Norway鼠、热带爪蟾、斑马鱼同源性分别为99%、98%、97.7%、97.7%、97%、93.9%、70.8%和57.1%(图 6-A);通过MEGA6构建的NeuroD2系统发生树显示,Wistar大鼠、Norway鼠和家鼠的亲源性最近 (图 6-B)。

|
| 图 6 NeuroD2同源性分析图 A:不同物种NeuroD2蛋白质相似性分析 (%);B:NeuroD2基因系统发生树 |
转染24 h后,通过荧光显微镜观察发现,实验组中83%的细胞有绿色荧光蛋白AcGFP1的表达 (图 7-A),对照组中有57.5%的细胞有AcGFP1绿色荧光蛋白表达 (图 7-B)。

|
| 图 7 转染后AcGFP1蛋白表达 A:实验组B:阴性对照组 |
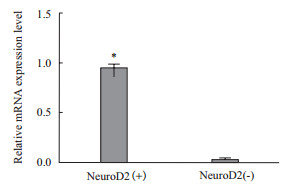
转染24 h后,Real-time PCR结果显示,实验组与对照组均有NeuroD2基因的表达,但实验组NeuroD2基因表达水平显著高于对照组 (P < 0.05)(图 8)。
|
| 图 8 NeuroD2转染后mRNA表达结果 |
通过对转染72 h后细胞NeuroD2蛋白进行Western blot分析,结果显示实验组与对照组相比,在41 kD左右位置有明显的深色条带 (图 9-A),通过Ipwin 32软件对条带灰度值进行扫描,统计后发现实验组NeuroD2蛋白表达量显著高于对照组 (P < 0.05)(图 9-B)。对转染细胞爬片进行免疫荧光染色后发现,实验组中NeuroD2蛋白表达呈阳性 (图 9-C),对照组未见明显表达 (图 9-D)。

|
| 图 9 转染后NeuroD2蛋白表达结果 A:Western blot结果;B:NeuroD2蛋白表达水平;C:实验组免疫荧光结果;D:对照组免疫荧光结果 |
bHLH转录因子作为一种调控蛋白,是真核生物中的一个大家族,其成员从1989年至今已有1 000多条并在不同生物中已得到验证,在生物的生长发育调控过程中起着极为重要的作用,它们参与调控神经元发生、肌细胞生成、血细胞生成、性别决定和组织发育等[7-9]。
Atchley等[10]对392种蛋白bHLH氨基酸的组成进行统计分析发现,bHLH家族氨基酸序列具有19个保守位点,以此建立了bHLH序列的预测基序,并将判断是否属于bHLH家族的标准初步定于19个保守位点中有11个以上位点的氨基酸与预测基序相符。本研究发现,Wistar大鼠NeuroD2蛋白氨基酸序列中有12个氨基酸与保守位点基序相符,通过生物信息学软件对该蛋白不同结构、表达部位、功能位点及同源性分析,推测Wistar大鼠NeuroD2基因所编码蛋白属于bHLH家族。
bHLH转录因子因其所调控基因的功能不同而分为45个家族,根据它们所作用的DNA元件和自身结构特点又被分成6个组[7],包括在视网膜细胞命运中起决定作用的NeuroD家族[11]、在内耳发育中起重要作用的Atonal家族[12]以及与大脑皮质祖细胞分化有密切关系的Ngn家族[13]等。作为bHLH家族中的一员,NeuroD2基因的正常表达可形成正常的神经结构,诱导神经分化,调高神经元生存率[14-16]。NeuroD2水平的降低可导致运动失调,癫痫发作阈值降低和过早死亡[14]。
随着对干细胞研究的不断深入,通过干细胞治疗神经损伤有可能成为神经修复的新途径。Qian等[17]研究显示小鼠MSCs可促进轴突再生并有助于星形细胞中组织纤溶酶原活性的提高。Nakano和Lin等[18, 19]将SD大鼠MSCs注入脑脊液用于中枢神经损伤 (SCI) 研究,结果显示在亚急性和急性SCI中,MSCs可以提高大鼠运动功能,也可以促进轴突再生。本课题组在研究红景天苷诱导大鼠MSCs的分化过程中,发现诱导之后细胞均有β-Tubulin Ⅲ、NSE、MAP2、巢蛋白和GFAP等神经相关蛋白的表达[20]。本研究构建含NeuroD2基因的重组质粒并转染小鼠MSCs,通过Real-time PCR、Western blot和免疫荧光等方法对NeuroD2基因及蛋白表达量测定发现,与对照组相比,此次构建的重组质粒上调小鼠MSCs中NeuroD2基因及蛋白的表达,可为后续进一步诱导小鼠MSCs分化为神经元样细胞的研究奠定基础。
4 结论本研究从大鼠大脑中克隆了NeuroD2基因,其CDS区全长1 149 bp,编码382个氨基酸,属于bHLH家族,该蛋白位于细胞核,其序列具有较高保守性。构建的真核表达载体pIRES2-AcGFP1-ND2在转染小鼠MSCs后得以表达,Real-time PCR、Western blot和免疫荧光结果充分证明,该重组质粒可上调NeuroD2在小鼠MSCs中的表达量。
| [1] | Bormuth I, Yan K, Yonemasu T, et al. Neuronal basic helix-loop-helix proteins NeuroD2/6 regulate cortical commissure formation before midline interactions[J]. Neurosci, 2013, 33 (2): 641–651. DOI:10.1523/JNEUROSCI.0899-12.2013 |
| [2] | Chen F, Moran JT, Zhang Y, et al. The transcription factor NeuroD2 coordinates synaptic innervation and cell intrinsic properties to control excitability of cortical pyramidal neurons[J]. J Physiol, 2016, 594 (13): 3729–3744. DOI:10.1113/JP271953 |
| [3] | Vetrovoi OV, Rybnikova EA, Glushchenko TS, et al. Effects of hypobaric hypoxia in various modes on expression of neurogenesis marker NeuroD2 in the dentate gyrus of rats hippocampus[J]. Bull Exp Biol Med, 2016, 160 (4): 510–513. DOI:10.1007/s10517-016-3209-5 |
| [4] | Fong AP, Yao Z, Zhong JW, et al. Conversion of MyoD to a neurogenic factor: binding site specificity determines lineage[J]. Cell Rep, 2015, 10 (12): 1937–1946. DOI:10.1016/j.celrep.2015.02.055 |
| [5] | Schwab MHA, Bartholomae B, Heimrich D, et al. Neuronal basic helix-loop-helix proteins (NEX and BETA2/Neuro D) regulate terminal granule cell differentiation in the hip-pocampus[J]. Neurosci, 2011, 20 (3): 3714–3724. |
| [6] | Farah MH, Olson JM, Sucic H, et al. Generation of neurons by transient expression of neural bHLH proteins in mammalian cells[J]. Development, 2000, 127 (35): 693–702. |
| [7] | 王勇, 陈克平, 姚勤, 等. bHLH转录因子家族研究进展[J]. 遗传学, 2008, 30(7): 821–830. |
| [8] | Goossens J, Mertens J, Goossens A, et al. Role and functioning of bHLH transcription factors in jasmonate signaling[J]. J Exp Bot, 2016, 7 : pii: erw440. |
| [9] | Timothy J, Cherry L, Sui Wang, et al. NeuroD Factors Regulate Cell Fate and Neurite Stratification in the Developing Retina[J]. Neurosci, 2011, 31 (20): 7365–7379. DOI:10.1523/JNEUROSCI.2555-10.2011 |
| [10] | Atchley WR, Fitch WM. A natural classification of the basic helix-loop-helix class of transcription factors[J]. Proc Natl Acad Sci USA, 1998, 94 (10): 5172–5176. |
| [11] | Gutierrez MA, Davis SS, Rosko A, et al. A novel AhR ligand, 2AI, protects the retina from environmental stress[J]. Sci Rep, 2016, 6 : 29025. DOI:10.1038/srep29025 |
| [12] | Lai HC, Klisch TJ, Roberts R, et al. In vivo neuronal subtype-specific targets of Atoh1(Math1) in dorsal spinal cord[J]. J Neurosci, 2011, 31 (30): 10859–10871. DOI:10.1523/JNEUROSCI.0445-11.2011 |
| [13] | Shahmoradi A, Radyushkin K, Rossner MJ. Enhanced memory consolidation in mice lacking the circadian modulators Sharp1 and-2 caused by elevated Igf2 signaling in the cortex[J]. Proc Natl Acad Sci U S A, 2015, 112 (27): E3582–3589. DOI:10.1073/pnas.1423989112 |
| [14] | Ma YC, Song MR, Park JP, et al. Regulation of motor neuron specification by phosphorylation of neurogenin 2[J]. Neuron, 2008, 58 (4): 65–77. |
| [15] | Bormuth I, Yan K, Yonemasu T, et al. Neuronal basic helix-loop-helix proteins NeuroD2/6 regulate cortical commissure formation before midline interactions[J]. J Neurosci, 2013, 33 (2): 641–651. DOI:10.1523/JNEUROSCI.0899-12.2013 |
| [16] | Ravanpay AC, Hansen SJ, Olson JM. Transcriptional inhibition of REST by NeuroD2 during neuronal differentiation[J]. Molecular and Cellular Neurosciences, 2010, 44 (2): 178–189. DOI:10.1016/j.mcn.2010.03.006 |
| [17] | Qian JY, ChoppM, Liu Z. Mesenchymal stromal cells promote axonal outgrowth alone and synergistically with astrocytes via tPA[J]. PLoS One, 2016, 11 : e0168345. DOI:10.1371/journal.pone.0168345 |
| [18] | Nakano N, Nakai Y, Seo T-B, et al. Effects of bone marrow stromal cell transplantation through CSF on the Subacute and chronicSpinal cord injury in rats[J]. PLoS One, 2013, 8 (9): e73494. DOI:10.1371/journal.pone.0073494 |
| [19] | Lin CH, Stoeck J, Ravanpay AC, et al. Regulation of NeuroD2 expression in mouse brain[J]. Developmental Biology, 2004, 265 : 234–245. DOI:10.1016/j.ydbio.2003.08.027 |
| [20] | 张全伟, 赵兴绪, 赵红斌, 等. 红景天苷体外诱导大鼠骨髓间充质干细胞分化为神经元样细胞[J]. 中国组织工程研究, 2012, 16(14): 2496–2503. DOI:10.3969/j.issn.1673-8225.2012.14.006 |




