IgA肾病 (IgA nephropathy,IgAN) 是一类以IgA在肾小球系膜区发生沉积为主要病理特征的肾小球疾病,其临床表现比较多样,相对以镜下或肉眼血尿最为常见,同时可伴不同程度蛋白尿及肾功能受损等症状[1]。当前普遍认为,IgAN在全球范围内居各种原发性肾小球肾炎发病的首位,而且在确诊为IgAN的5-25年内,大概有30%左右的患者将不可逆地进展为终末期肾病 (End-stage renal disease,ESRD)[2, 3]。IgA免疫系统发生异常是导致IgAN发病的重要因素[4]。其中辅助性T淋巴细胞 (T-heleper lymphocyte,Th) 的失调已被证实为产生致病性IgA1(IgA亚型之一) 的关键性环节[5]。Th分泌的细胞因子主要包括Th1与Th2两个亚群,目前大多数研究支持IgAN的发病及病情进展应与Th1/Th2平衡向Th2偏倚有关,而Th2所分泌的细胞因子则主要包括IL-4、IL-5及IL-13[6]。白藜芦醇 (Esveratrol) 又名茋三酚 (3,4' ,5-三羟基二苯乙烯),是植物在诸如机械性损伤、遭受强紫外线照射以及真菌感染等不利条件下所产生的“植物补体”,其分子式为C14H12O3,相对分子量为228.25。现代药理学研究表明,白藜芦醇具有包括抗炎在内的多种药理作用[7]。本研究通过考察白藜芦醇对IgA大鼠肾组织TH2型细胞因子及血清循环免疫复合物 (Circulating immunocomplex,CIC) 的影响,旨在为临床应用白藜芦醇治疗IgAN提供理论依据。
1 材料与方法 1.1 材料清洁级SD大鼠购自山东大学动物饲养中心;白藜芦醇购自上海得恩德医药科技有限公司,纯度95.0%;胎牛血清白蛋白 (BGG) 与羊抗大鼠IgA、IgG、IgM和C3购自美国Abcam公司;IL-4、IL-5、IL-13及β-actin mRAN内参购自康伟世纪公司;Olympus荧光显微镜购自上海赖氏电子科技有限公司;TRIzol购自美国invitroge公司;RT-PCR逆转录试剂盒购自Promega公司;基因扩增仪器购自 (BIOER,Hangzhou Techology.co,China);PCR引物由北京华大基因公司设计合成;凝胶电泳仪及成像系统购自Bio-RAD公司;CIC酶联免疫吸附法试剂盒购自北京科盈美生物科技公司。
1.2 方法 1.2.1 分组与造模清洁级SD大鼠50只,雌、雄各25只,7周龄,体质量180-220 g。随机选取10只作为正常组,另40只为造模组。参考当前国内外最常使用的IgA大鼠造模方法进行造模,即应用抗原低于食管黏膜内皮细胞施加直接性刺激,继而将巨噬细胞激活并最终获得IgAN模型[8]。具体方法为:以0.9%氯化钠注射液溶解BGG,配制成含BGG 0.1%的溶液给予造模组连续饮用8周,8周后再连续3 d采用尾静脉注射方式追加BGG,1次/d,单次注射剂量1 mg;正常组依次分别给予等量0.9%氯化钠注射液饮用及尾静脉注射。于第9周末在造模组中任意选30只并随机分为3组 (每组各10只) 进行白藜芦醇ig给药,各组给药剂量分别为15 g生药/kg (低剂量组)、30 g生药/kg (中剂量组) 及45 g生药/kg (高剂量组),未给药的10只大鼠定义为模型组。实验期间所有大鼠除上述给药方案外均正常饮食生活,蒸馏水喂养。
1.2.2 标本制作所有大鼠于第12周末剖杀并取材。以50 mg/kg腹腔注射3%戊巴比妥钠,麻醉后沿腹中线将腹部皮肤与腹肌剪开,将肠管推开并充分暴露腹主动脉后穿刺采血,以转速3 000 r/min离心处理血液样本,离心时间10 min,收集血清用于CIC浓度检测。完成血液样本采集后应立即再进行肾组织样本采集,将肾周围残存结缔组完全剥离后于距肾门1 mm处切取肾组织,然后置于-70℃冰箱冷藏备用。
1.2.3 免疫荧光染色采用直接法染色,取肾皮质冰冻切片3 μm,吹干后采用丙酮固定5 min,接着采用磷酸缓冲盐溶液 (PBS) 冲洗3次,5 min/次,将采用羊抗大鼠免疫荧光IgA、IgM和C3(1:10) 稀释荧光标记的抗体滴加至组织切片,在37℃温度条件下孵育45 min,孵育结束后再采用PBS液洗3次,5 min/次,完成后用缓冲液甘油封片并采用Olympus20倍荧光显微镜镜检。镜下荧光强度分5个强度梯度:(-) 无荧光,(±) 弱荧光且不清晰,(+) 弱荧光清晰,(++) 明亮荧光,(+++) 强荧光。荧光越强则表示CIC沉积越严重。
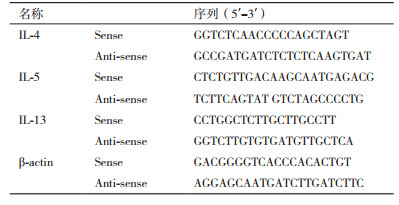
1.2.4 肾组织IL-4、IL-5、IL-13的RT-PCR检测将冰冻肾组织在研钵中碾碎,采用TRIzol一步法提取总RNA[9]。接着以所获总RNA为模版,采用Promega公司试剂盒进行逆转录反应并得到相应的cDNA,在PCR仪上扩增。应用primer Premier 5.0软件进行引物设计,所有序列引物由北京华大基因公司合成 (表 1)。PCR反应条件为95℃预变性5 min;95℃ 45 s,59℃ 45 s,64℃ 50 s,72℃ 45 s,共30个循环;72℃ 10 min终止反应。将PCR产物片段进行1.5%琼脂糖凝胶电泳,用凝胶成像系统拍照并采用Image J软件进行灰度分析。
采用酶联免疫吸附法 (ELISA法) 进行测定,具体操作严格参照试剂盒说明书即可。
1.2.6 统计学方法采用SPSS19.0统计学软件对实验数据进行分析,数据资料以 (x±s) 表示,组间数据比较采用两样本均数t检验,以P < 0.05为比较差异具有统计学意义。
2 结果 2.1 免疫荧光染色镜检结果免疫荧光染色镜检结果显示,正常组大鼠肾小球系膜区IgA、IgG、IgM及C3均呈阴性,模型组大鼠肾小球系膜区表现有明显IgA沉积,荧光强度 (++)-(+++),个别波及毛细血管壁并伴有IgG、IgM、C3沉积;低、中、高剂量组荧光强度较模型组依次减弱,其中高剂量组部分IgA荧光强度 (±)-(-)。该结果提示造模成功,见图 1。

|
| 图 1 免疫荧光染色镜检结果 A:正常组;B:模型组;C:低剂量组;D:中剂量组;E:高剂量组 |
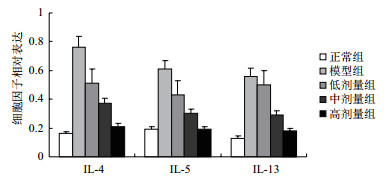
RT-PCR检测结果表明,与正常组比较,模型组大鼠肾组织IL-4、IL-5、IL-13的相对表达水平极显著增高 (P < 0.001),与模型组比较,低、中、高剂量组大鼠肾组织IL-4、IL-5、IL-13的相对表达水平均依次降低,各细胞因子指标组间两两比较均有统计学意义 (P < 0.01),见图 2和图 3。
|
| 图 2 各组大鼠肾组织IL-4、IL-5、IL-13的RT-PCR检测结果 |
|
| 图 3 各组大鼠肾组织IL-4、IL-5、IL-13细胞因子的相对表达 |
CIC检测结果显示 (表 2),与正常组比较,模型组血清CIC浓度显著升高 (P < 0.01),低、中、高剂量组均高于正常组,但与正常组比较均无统计学意义 (P > 0.05),与模型组比较均显著更低 (P < 0.05),并依次呈逐渐降低趋势。
IgAN及其所导致的慢性肾脏疾病及ESRD不仅对患者本身而言是一个非常严重的健康问题,而且其家庭也往往因此遭受沉重的经济负担,进一步提高IgAN临床治疗的有效性是肾病内科医生所面临的重大课题之一。当前西医对IgAN尚缺乏特异性的治疗方法,同时也没有一个被普遍认可的治疗指南,临床主要采用转换酶抑制剂 (ACEI) 或血管紧张素Ⅱ受体阻滞剂 (ARB) 等药物给予支持治疗,效果不理想则建议联合应用激素治疗。另有研究表明,激素联合硫唑嘌呤治疗IgAN不比激素单药治疗更有效反而增加药物不良反应的发生[10]。随着IgAN相关中医理论研究的不断深入,某些中医药已在IgAN的治疗方面愈发表现出优势,不仅能较好控制其近期临床症状,而且能在很大程度上帮助患者激素减量并削弱西药的毒副反应[11, 12]。近期研究证实,白藜芦醇在其他类型肾病的应用中已初具成效[13]。那么基于其抗炎作用是否对IgAN同样具有临床应用价值即是本研究重点关注的问题。
IgAN的发病机制目前尚未完全探明,但考虑与免疫功能异常及遗传等因素有关,其中前者占主要地位[14]。IgA等抗体是由经T细胞调节下活化的B细胞产生的。IL-4与IL-13是活化的Th2细胞所分泌的两种非常重要的抗炎性细胞因子,它们对单核-巨噬细胞表面抗原的表达具调节作用,能对NO产生及抗体所介导的细胞毒性 (ADCC) 作用发挥抑制效应,同时还能下调诸如IL-1、TNF-A、IL-12等多种促炎细胞因子以及巨嗜细胞炎症蛋白 (MIP)、IL-8等趋化因子的合成水平,另外也能促进具抗炎作用的IL-ra与IL-1Ⅱ型受体的表达继而间接抑制IL-1的生物学功能[15]。基于强大的抗炎特性,IL-4与IL-13均被认为对原发性肾小球疾病相关炎性反应具重要保护意义。IL-5则是由Th2细胞所分泌的另一种促炎性细胞因子,其在机体的炎性反应中发挥信息传递功能,并能促进B细胞分化及增殖[16]。故可间接增加IgA表达[17]。本研究结果显示,与正常组比较,模型组大鼠肾组织IL-4、IL-5、IL-13的相对表达水平极显著增高 (P < 0.001),提示在IgAN病情进展过程中,可能基于机体免疫应答,不仅促炎性因子IL-5会有所增高,而且IL-4与IL-13抗炎性因子也同步增高。而与模型组比较,白藜芦醇低、中、高剂量组大鼠肾组织IL-4、IL-5、IL-13的相对表达水平均依次降低,各细胞因子指标组间两两比较均有统计学意义 (P < 0.01),则进一步提示在接受白藜芦醇治疗后,致炎细胞因子IL-5被下调,继而将阻断由致炎因子所致肾组织损害并减轻炎性反应,当炎性反应降低后作为抗炎因子的IL-4、IL-13其表达水平也随之降低。
CIC是抗原与抗体在循环中所结合形成的免疫复合物,肾脏是其发生沉积的敏感靶标。肾脏所接受的心输出量为25%左右,抗原与抗体形成的复合物在流经肾脏时将导致肾小球内部呈高比例CIC状态,继而促使更大量的CIC可透过含大量带负电荷成分 (如硫酸类肝素与多糖蛋白等) 的肾小球毛细血管壁,故导致带正电荷的CIC易于在此发生沉积[18]。另外,CIC本身所具有的大分子量特征而不易被吞噬细胞吞噬也是其发生沉积的重要原因[19]。当CIC沉积于肾组织系膜区后,即可通过吸引或活化炎性细胞及肾小球固有细胞,继而开始释放多种炎性介质并引起细胞或组织损伤[20]。本次实验显示,与模型组比较,白藜芦醇低、中、高剂量组CIC浓度均显著更低 (P < 0.05),这与IL-4、IL-13 mRNA表达情况一致。该结果也可以从另一角度做出推论:抗炎因子IL-4、IL-13的分泌增加可能正是因为IgA等免疫复合物沉积于系膜区,刺激局部产生炎症反应,同时启动了相应的抗炎机制所致。而白藜芦醇则通过调节IL-4、IL-13的表达进而间接亦或直接影响Th1/Th2的平衡,减少活化Th2细胞,同时调节B细胞的增殖与活化减少抗体过度分泌,最终导致CIC形成量减少起到治疗IgAN的效果。
4 结论白藜芦醇可明显下调IgA大鼠肾组织总促炎性因子IL-5的表达,炎性反应减弱后抗炎性因子IL-4与IL-13也随之降低,同时白藜芦醇也能显著降低IgA大鼠血清CIC浓度,提示白藜芦醇对IgAN不仅具积极免疫调节作用,而且也能较好阻遏其病机,可为IgAN患者的临床治疗提供新的思路。
| [1] | 马勇, 罗静, 郭珲. 1, 25-二羟维生素D3对IgA肾病大鼠肾组织中白细胞介素-4表达的影响[J]. 中国药物与临床, 2016, 16(1): 12–15. |
| [2] | Donadio JV, Grande JP. IgA nephropathy[J]. N Engl J Med, 2002, 347 (10): 738–748. DOI:10.1056/NEJMra020109 |
| [3] | Lai KN, Chan LY, Guo H, et al. Additive effect of PPAR-gamma agonist and ARB in treatment of eqperimental IgA nephropathy[J]. Pediatr Nephrol, 2011, 26 (2): 257–266. DOI:10.1007/s00467-010-1703-y |
| [4] | 刘擘, 徐安平, 曾玉纯, 等. 血尿酸水平与IgA肾病患者临床及病理的关系[J]. 广东医学, 2015, 36(13): 2068–2070. |
| [5] | Chintalacharuvu SR, Yamashita M, Bagheri N, et al. T cell cytokine polarity as a determinant of immunog-lobulin A (IgA) glycosylation and the severity of experimental IgA nephropathy[J]. Clin Exp Immunol, 2008, 153 (3): 456–462. DOI:10.1111/cei.2008.153.issue-3 |
| [6] | Maeda S, Yanagihara Y. Inflammatory cytokines (IL-4, IL-5 and IL-13)[J]. Nihon Rinsho, 2001, 59 (10): 1894–1899. |
| [7] | 刘顺, 李赫宇, 赵玲. 白藜芦醇降血尿酸、抗炎作用研究进展[J]. 药物评价研究, 2016, 39(2): 304–307. |
| [8] | Huang H, Peng Y, Long XD, et al. Tonsillar CD4+ CD25+ regulatory T cells from IgA nephropathy patients have decreased immunosuppressive activity in experimental IgA nephropathy rats[J]. Am J Nephrol, 2013, 37 (5): 472–480. DOI:10.1159/000350533 |
| [9] | Ricciardolo FLM, Sorbello V, Silvestri M, et al. TNF-α, IL-4Rα and IL-4 polymorphisms in mild to severe asthma from Italian Caucasians[J]. Int J Immunopathol Pharmacol, 2013, 26 (1): 75–84. DOI:10.1177/039463201302600107 |
| [10] | Pozzi C, Andrulli S, Pain A, et al. Addition of azathioprine to corti-costeroids does not benefit patients with IgA nephropathy[J]. J Am Soc Nephrol, 2010, 21 (10): 1783–1790. DOI:10.1681/ASN.2010010117 |
| [11] | 薛杨, 林珊, 贾俊亚, 等. IgA肾病患者肾组织TNF-α表达与疾病活动性的关系[J]. 广东医学, 2010, 31(19): 2555–2557. DOI:10.3969/j.issn.1001-9448.2010.19.032 |
| [12] | 叶海亮, 江燕, 孙伟. 益气养阴法联合雷公藤多苷片治疗气阴两虚型IgA肾病23例[J]. 河南中医, 2016, 36(6): 1056–1058. |
| [13] | 陈薪薪, 仝欢, 陈宇, 等. 白藜芦醇对小鼠肾纤维化TGF-β1/Smads信号转导通路的干预研究[J]. 中华中医药学刊, 2016, 34(5): 1224–1227. |
| [14] | Wągrowska-Danilewicz M, Danilewicz M. Expression of α5β1 and α6β1 integrins in IgA nephropathy (IgAN) with mild and severe proteinuria. An immunohistochemical study[J]. International Urology and Nephrology, 2003, 36 (1): 81–87. |
| [15] | Aversa G, Punnonen J, Cocks BG, et al. An interleukin 4(IL-4) mutant protein inhibits both IL-4 or IL-13-induced human immunoglobulin G4(IgG4) and IgE synthesis and B cell proliferation: support for a common component shared by IL-4 and IL-13 receptors[J]. The Journal of Experimental Medicine, 1993, 178 (6): 2213–2218. DOI:10.1084/jem.178.6.2213 |
| [16] | 曹廷容, 杨宏, 雷琴. 肺炎支原体感染合并支气管哮喘患儿血清总IgE及IL-5的检测及意义[J]. 海南医学院学报, 2013, 19(2): 241–243. |
| [17] | 陈小红, 何芳, 柳青, 等. 肾型过敏性紫瘫患者血清IL-5, IL-10, CD4+CD25+调节性T细胞测定及意义[J]. 疑难病杂志, 2013, 12(2): 140–141. |
| [18] | 张瑞. 免疫复合物与免疫性肾脏损伤[J]. 国际泌尿系统杂志, 2006, 26(4): 519–523. |
| [19] | Martinsson K, Skogh T, Mousavi S, et al. Deficiency of activating Fcγ-receptors reduces hepatic clearance and deposition of IC and increases CIC levels in mercury-induced autoimmunity[J]. PLoS One, 2010, 5 (10): e13413. DOI:10.1371/journal.pone.0013413 |
| [20] | 赵杰, 陈莹, 陈江华. 人参对家兔系膜增生性肾小球肾炎模型循环免疫复合物的影响[J]. 中国中西医结合肾病杂志, 2010, 11(2): 112–115. |