2. 北京林业大学林学院,北京 100083
2. College of Forestry, Beijing Forestry University, Beijing 100083
植物内生菌能够从根皮层穿越内皮屏障进入到健康植物的各个组织中,依赖于宿主植物为其提供生长必需的能量和营养,同时通过自身的代谢产物或借助于信号传导作用影响植物的生长、发育、抵抗生物及非生物胁迫等[1]。植物内生菌,尤其是链霉菌产生抗生素[2]和细胞壁降解酶[3]等生物活性物质来抑制植物病原菌的生长,并诱导植物产生系统抗性[4]。而且,内生菌通过产生植物激素 (生长素、赤霉素、细胞分裂素或乙烯等)[5]和铁载体[6]等营养物质或通过生物固氮[7]和解磷作用[8]等促进植物生长。因此,植物内生菌及其产生的天然活性物质在植物促生和生物防治方面有巨大的应用潜力。
链霉菌是天然产物,尤其是抗生素的杰出生产者,为人类的健康做出了卓越的贡献。最近的研究报道表明内生链霉菌在协同植物生长方面具有重要的作用[9]。Lin等[10]从红豆杉中分离获得内生链霉菌En-1,该菌产IAA,并且能够促进拟南芥的生长。植物内生链霉菌也可以促进水稻[11]、高粱[12]、小麦[13]、番茄[14]等农作物的生长。Rakotoniriana等[15]从长春花茎部首次分离出一株轮生的内生链霉菌,产生多烯大环内脂抗生素,能够抑制许多植物病原菌,尤其是盘长孢状刺盘孢和核盘菌。分离自药用植物的具有产几丁质酶和溶磷能力的内生链霉菌,不仅显著增加了鹰嘴豆生物量 (1.2-2倍),还能有效预防齐整小核菌引起的鹰嘴豆茎腐病[16]。
在前期研究工作中,我们从药用植物羊角拗 (Strophanthus divaricatus) 的根部获得了内生菌SSD49,该菌对杨树溃疡病病原真菌 (Botryosphaeria dothidea) 具有较强的抑制活性。本研究主要对该菌的分类地位、抑菌谱、促进植物生长和生防潜力进行深入研究,旨在为开发环保型生防菌剂提供参考。
1 材料与方法 1.1 材料 1.1.1 供试菌株和病原菌供试菌株:内生链霉菌SSD49,分离自药用植物羊角拗 (S. divaricatus) 的根部组织。病原菌:耐甲氧西林金黄色葡萄球菌 (Methicillin-resistant Staphylococcus aureus T1959) 来自北京大学第三医院,白假丝酵母 (Candida albicans ATCC 10231) 购于中科院微生物研究所菌种保藏中心,苹果轮纹病病原菌 (Dothiorella gregaria)、两种杨树溃疡病病原真菌 (Botryosphaeria dothidea CFCC 7926/7897) 和欧美杨细菌性溃疡病病原菌 (Lonsdalea quercina subsp. populi) 由北京林业大学贺伟教授馈赠,板栗疫病菌 (Cryphonectria parasitica)、大豆核盘菌 (Sclerotinia sclerotiorum) 和辣椒疫霉 (Phytophthora capsici) 由中国农科院李世东教授馈赠。
1.1.2 培养基ISP2培养基[17]:酵母提取物4 g,麦芽提取物10 g,葡萄糖4 g,琼脂18 g,蒸馏水1 000 mL,pH 7.2-7.4;PDA培养基:土豆200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,pH自然;几丁质培养基[18]:胶体几丁质20-25 g,酵母粉1.5 g,硫酸铵1.5 g,磷酸氢二钾0.7 g,磷酸二氢钾0.3 g,七水合硫酸镁0.5 g,七水合硫酸亚铁0.01 g,琼脂15 g,蒸馏水1 000 mL,pH 7.0;ISP1培养基:胰酪蛋白胨5 g,酵母浸粉3 g,pH 7.2。
1.1.3 主要试剂革兰氏阳性菌基因组DNA提取试剂盒购自Bio-tek OMEGA,PCR扩增相关试剂购自大连宝生物工程有限公司,引物由Invitrogen公司合成,测序服务由生工生物工程 (上海) 股份有限公司提供。
1.2 方法 1.2.1 菌株鉴定利用OMEGA革兰氏阳性菌基因组DNA提取试剂盒提取内生菌的基因组,以基因组DNA为模板,利用细菌通用引物27F (5'-AGAGTTTGATCCTGGCTCAG-3') 和1492R (5'-TTAAGGTGATCCAGCCGCA-3') PCR扩增16S rRNA基因[19]。PCR扩增条件为:变性94℃ 4 min;94℃ 1 min,55℃ 1 min和72℃ 2 min,循环30次;72℃ 10 min。扩增产物经琼脂糖凝胶电泳检测后送测序。测序结果经DNAMAN软件拼接后,提交到http://eztaxon-e.ezbiocloud.net/进行序列比对[20],随后运用MEGA 6.0软件,采用邻接法 (Neighbour Joining) 构建系统发育树。
1.2.2 抑菌活性广谱性分析以苹果轮纹病病原菌、大豆核盘菌、板栗疫病菌、辣椒疫霉和杨树溃疡病病原真菌作为指示菌,利用平板对峙法进行内生菌SSD49的抑菌活性广谱性分析,即在每个PDA平板左侧分别接种一种病原菌,右侧接种SSD49,二者对峙距离约5 cm,以只接种病原菌的平板作为对照,每种病原菌重复3次,28℃恒温倒置培养7 d后观察抑菌圈的有无及大小。
在ISP2固体培养基平板的左侧纵向划线接种SSD49,28℃恒温培养2 d,待菌体产生孢子时,在平板的右侧从上至下分别横向划线接种耐甲氧西林金黄色葡萄球菌、白假丝酵母和欧美杨细菌性溃疡病病原菌,划线要尽量接近SSD49,28℃恒温培养2 d后,观察并记录抑菌效果。
1.2.3 几丁质酶活性的检测将SSD49菌株接种到几丁质培养基,28℃恒温培养1-2周,观察是否有透明圈的出现,有透明圈则表明该菌株有几丁质酶活性,透明圈的大小与几丁质酶活性大小呈正相关。
1.2.4 吲哚乙酸的测定将SSD49接种于含有500 mg/L色氨酸的ISP1液体培养基中,28℃ 120 r/min震荡培养72 h。5 000 ×g离心10 min取上清,加入等体积Salkowshi试剂,然后用分光光度计在530 nm下测量吸光度,以不加内生菌的培养基作空白对照,重复3次实验,计算IAA的浓度,以分析纯的IAA梯度稀释制备标准曲线[21]。
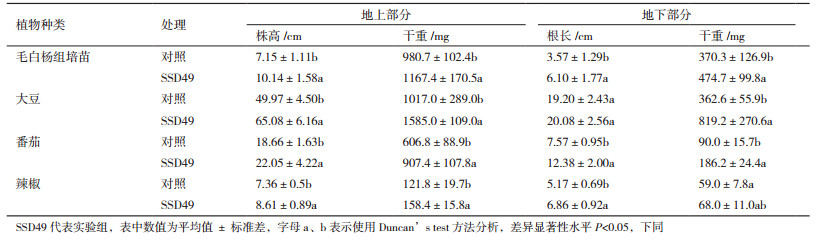
1.2.5 内生菌对毛白杨组培苗的促生实验内生菌在ISP2培养基平板中培养1周后,用无菌水冲洗下孢子,制成106个/mL的孢子悬液。选取生长条件良好的毛白杨组培苗,用无菌剪刀剪下含有3片真叶且大小相似的组培苗顶芽,将下端浸泡在孢子液中1 min,立即插到新的MS固体培养基中;同时用等体积的无菌水浸泡的同一批组培苗作为对照组,每个瓶子接种1株幼苗,每个处理10个重复。将接种好的组培苗置于组培室中25℃培养4周后,测量并统计组培苗的生长情况。
1.2.6 内生菌对大豆、番茄和辣椒的促生实验将大豆、番茄和辣椒种子表面消毒后种到装有灭菌土的花盆中,大豆每盆种2株,番茄和辣椒每盆种3株,待长出4片真叶后浇灌50 mL的孢子液 (107个/mL) 于表层土中,每种植物各5盆作为实验组,同时设置不施加孢子液用等体积的无菌水代替的同一批植物作为对照组,放置在温室里培养60 d后测定各组大豆、番茄和辣椒的株高、根长和干重。
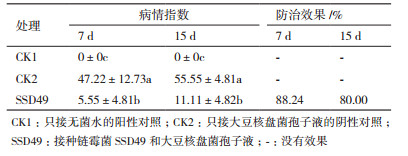
1.2.7 内生菌对大豆菌核病的防治饱满大豆种子经表面消毒后种到装有灭菌土的花盆中,每盆播种2粒,待第4片真叶长出时接种50 mL孢子液 (107个/mL),以同一批大豆接种等量无菌水作为阴性对照。7 d后各组大豆均浇灌50 mL大豆核盘菌孢子液 (107个/mL) 于苗茎基部,以浇灌等量无菌水作为阳性对照,各组设置5盆重复。浇灌7 d和15 d后分别统计各组的大豆菌核病发病情况与病情指数并计算防治效果。
大豆菌核病病情指数分级标准:0级,无病;1级,一些坏死或叶片总病变区域 < 5%;2级,叶片总病变区域在5%-10%之间;3级,植株有较多病变,叶片总病变区域在11%-30%之间,茎端出现腐烂;4级,植株病变严重,叶片总病变区域在31%-94%之间,茎顶端出现腐烂;5级,植株病变严重,叶片总病变区域 > 94%,茎从顶端到底部均腐烂,或植株死亡[22]。
病情指数 (%)=∑(各级病株数×各级代表值)/(调查总株数×最高级代表值)×100
防治效果 (%)=(对照病情指数-处理病情指数)/对照病情指数×100
1.2.8 数据处理用SPSS19.0(SPSS Inc.,Chicago,Illinois) 的单因素方差分析 (ANOVA) 和Duncan’s tests (P < 0.05) 进行差异显著性分析。
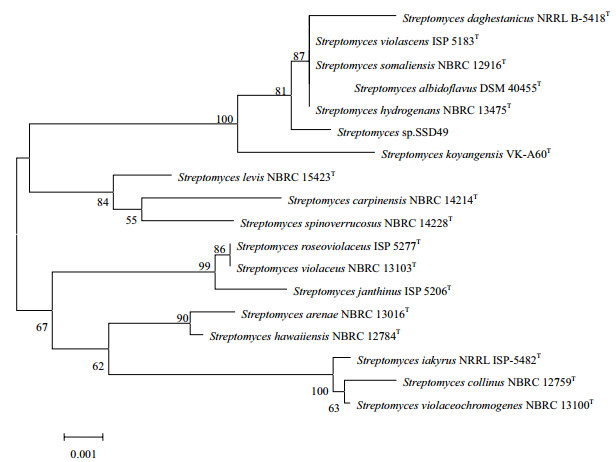
2 结果 2.1 菌株鉴定内生菌SSD49的16S rRNA基因的PCR产物的DNA序列长度为1 396 bp,GenBank序列号为KY290591,将序列提交EzTaxon进行比对,结果表明该菌为链霉菌,与Streptomyces somaliensis NBRC 12916T、Streptomyces albidoflavus DSM 40455T、Streptomyces hydrogenans NBRC 13475T、Streptomyces daghestanicus NRRL B-5418T和Streptomyces violascens ISP 5183T的同源性均为99.85%。选择相似度高于98.5%的17株链霉菌,利用MEGA5.0软件构建的系统发育树如图 1。
|
| 图 1 SSD49 16S rRNA序列系统发育树 |
本研究利用平板对峙法检测了内生链霉菌SSD49对杨树溃疡病菌和其他5种植物病原菌 (4种病原真菌和1种病原细菌) 和两种人类机会致病菌 (1种细菌和1种酵母菌) 的抑菌活性。结果表明,除辣椒疫霉外 (图 2-C),该菌不但对白假丝酵母菌和甲氧西林金黄色葡萄球菌具有很强的抑制作用 (图 2-H和I),而且对杨树溃疡病病原真菌 (图 2-E和F),板栗疫病菌、大豆核盘菌、苹果轮纹病病原菌和欧美杨细菌性溃疡病病原菌具有较好的抑菌效果 (图 2-A、B、D和J)。

|
| 图 2 内生菌SSD49对9种病原菌的拮抗作用 A:板栗疫病菌;B:大豆核盘菌;C:辣椒疫霉;D:苹果轮纹病病原菌;E:杨树溃疡病病原真菌7897;F:杨树溃疡病病原真菌7926;G:链霉菌SSD49;H:耐甲氧西林金黄色葡萄球菌;I:白假丝酵母;J:欧美杨细菌性溃疡病病原菌 |
将SSD49菌株接种在胶体几丁质培养基后,菌株周围形成了明显的透明圈,单位菌落透明圈大小达到1.25 cm,可知SSD49是一株具有产几丁质酶活性的菌株。根际微生物产生植物生长激素调节植物生长是根际微生物促生作用的重要机制之一。经Salkowski比色法测定,内生链霉菌SSD49可产生31.56 mg/L的吲哚乙酸。
2.4 内生链霉菌SSD49的促生作用采用组培苗和温室盆栽实验,对内生菌SSD49的促植物生长作用进行测定。将内生菌SSD49的孢子悬液接种于毛白杨组培苗、大豆、番茄和辣椒幼苗,相同条件培养60 d,结果 (表 1) 表明该菌对毛白杨组培苗、大豆、番茄和辣椒均具有明显的促生效果。接种SSD49孢子悬液的毛白杨组培苗、大豆、番茄和辣椒平均株高分别为10.14 cm、65.08 cm、22.05 cm和8.61 cm,与对照相比,分别提高了41.82%、30.24%、18.17%和16.98%;地上部分的干重分别增加了19.00%、55.85%、49.54%和30.05%;根长分别提高了70.87%、4.58%、63.54%和32.69%,根干重也有了显著提高,分别比对照组增加了28.19%、126.06%、106.89%和15.25%。
本研究观察和记录了接种核盘菌的大豆植株的发病情况及SSD49对核盘菌发病情况的影响及防治效果。结果 (表 2) 表明,接种核盘菌7 d和15 d后,大豆的病情指数分别达到约47.22和55.55,而接种SSD49孢子悬液一周后再接种菌核病病原菌,病情指数分别降低为5.55和11.11,7 d后对大豆核盘菌的防治效果高达88.24%,15 d后的生物防治效果依然很明显。
植物内生菌协同植物共同进化,不但能够产生次级代谢产物和细胞壁降解酶抑制病原菌的侵染[23],同时能够产生植物激素促进植物生长[24],在农林业生物防治方面具有广阔的应用前景。通过选择性分离和平板拮抗实验筛选,实验室前期从羊角拗根部获得了内生菌SSD49,该菌对杨树溃疡病病原真菌具有很强的抑菌活性。本研究通过16S rRNA基因的扩增、测序和系统发育分析将该菌鉴定为链霉菌;利用平板对峙法,检测到该菌能够抑制多种植物病原菌和人类机会致病菌,具有广谱的抑菌能力。
几丁质酶能水解真菌病原菌的细胞壁的成分,使细胞壁破裂,进而抑制真菌病原菌的生长[25]。虽然本研究利用胶体几丁质培养基证实菌株SSD49具有产几丁质水解酶的能力,是抑制病原真菌的机制之一。但是SSD49除了能抑制多种病原真菌 (大豆菌核病菌、苹果轮纹病病原菌、板栗疫霉菌和白假丝酵母菌),还能有效抑制病原细菌 (欧美杨细菌性溃疡病病原菌和耐甲氧西林金黄色葡萄球菌) 的生长,这说明SSD49可能产生一些抑菌的次级代谢产物。该菌所产生的抑菌次级代谢产物的种类、结构特征及抑菌机理有待进一步深入研究。
产生植物生长素是植物促生菌促进植物生长和发育、提高植物产量、以及增强宿主植物对生物[16]和非生物胁迫[14]抵抗能力的重要作用机制之一。本实验证明内生链霉菌SSD49能够产生较高浓度的吲哚乙酸,说明该菌具有植物促生的潜力。温室盆栽实验和杨树组培实验证实该菌对杨树组培苗、大豆、辣椒和番茄具有很强的促生效果,显著提高了这4种植物的株高、根长和干重。
核盘菌是一种世界性的腐生病原真菌,主要侵染包括大豆、油菜、向日葵等400多种高等植物[26],造成农作物严重减产,还能引起许多园艺植物和水果蔬菜的软腐病。温室盆栽实验结果表明SSD49对大豆菌核病的生物效果达到88.24%。深入研究内生菌SSD49在大豆、玉米、杨树等植物体内的定殖情况、田间生防效果、以及生防机制将是下一步的研究目标。
4 结论内生链霉菌SSD49具有抑菌谱广和抑菌效果明显的特征,能够产生水解真菌细胞壁的几丁质酶和高浓度的植物生长素IAA (31.56 mg/L),能显著促进毛白杨组培苗、大豆、番茄和辣椒的生长,对大豆菌核病的生防效果达到88.24%。
| [1] | Mercado-Blanco J, Prieto P. Bacterial endophytes and root hairs[J]. Plant and Soil, 2012, 361 (1): 301–306. |
| [2] | Barka EA, Vatsa P, Sanchez L, et al. Taxonomy, physiology, and natural products of Actinobacteria[J]. Microbiology and Molecular Biology Reviews, 2016, 80 (1): 1–43. DOI:10.1128/MMBR.00019-15 |
| [3] | Gupta R, Saxena R K, Chaturvedi P, et al. Chitinase production by Streptomyces viridificans: its potential in fungal cell wall lysis[J]. Journal of Applied Bacteriology, 1995, 78 (4): 378–383. DOI:10.1111/jam.1995.78.issue-4 |
| [4] | Pieterse CMJ, Zamioudis C, Berendsen RL, et al. Induced systemic resistance by beneficial microbes[J]. Annual Review of Phytopathology, 2014, 52 : 347–375. DOI:10.1146/annurev-phyto-082712-102340 |
| [5] | Spaepen S, Bossuyt S, Engelen K, et al. Phenotypical and molecular responses of Arabidopsis thaliana roots as a result of inoculation with the auxin-producing bacterium Azospirillum brasilense[J]. New Phytologist, 2014, 201 (3): 850–861. DOI:10.1111/nph.12590 |
| [6] | Sadeghi A, Karimi E, Dahaji PA, et al. Plant growth promoting activity of an auxin and siderophore producing isolate of Streptomyces under saline soil conditions[J]. World Journal of Microbiology and Biotechnology, 2012, 28 (4): 1503–1509. DOI:10.1007/s11274-011-0952-7 |
| [7] | Bulgarelli D, Schlaeppi K, Spaepen S, et al. Structure and functions of the bacterial microbiota of plants[J]. Annual Review of Plant Biology, 2013, 64 : 807–838. DOI:10.1146/annurev-arplant-050312-120106 |
| [8] | Palaniyandi SA, Yang SH, Zhang L, et al. Effects of actinobacteria on plant disease suppression and growth promotion[J]. Applied Microbiology and Biotechnology, 2013, 97 (22): 9621–9636. DOI:10.1007/s00253-013-5206-1 |
| [9] | Viaene T, Langendries S, Beirinckx S, et al. Streptomyces as a plant's best friend?[J]. FEMS Microbiology Ecology, 2016, 92 (8): 1–9. |
| [10] | Lin L, Xu X. Indole-3-acetic acid production by endophytic Streptomyces sp. En-1 isolated from medicinal plants[J]. Current Microbiology, 2013, 67 (2): 207–217. |
| [11] | Gopalakrishnan S, Vadlamudi S, Bandikinda P, et al. Evaluation of Streptomyces strains isolated from herbal vermicompost for their plant growth-promotion traits in rice[J]. Microbiological Research, 2014, 169 (1): 40–48. DOI:10.1016/j.micres.2013.09.008 |
| [12] | Gopalakrishnan S, Srinivas V, Vidya M S, et al. Plant growth-promoting activities of Streptomyces spp. in sorghum and rice[J]. SpringerPlus, 2013, 2 : 574. DOI:10.1186/2193-1801-2-574 |
| [13] | Jog R, Pandya M, Nareshkumar G, et al. Mechanism of phosphate solubilization and antifungal activity of Streptomyces spp. isolated from wheat roots and rhizosphere and their application in improving plant growth[J]. Microbiology, 2014, 160 (4): 778–788. |
| [14] | Palaniyandi SA, Damodharan K, Yang SH, et al. Streptomyces sp. strain PGPA39 alleviates salt stress and promotes growth of 'Micro Tom'tomato plants[J]. Journal of Applied Microbiology, 2014, 117 (3): 766–773. DOI:10.1111/jam.2014.117.issue-3 |
| [15] | Rakotoniriana EF, Chataigné G, Raoelison G, et al. Characterization of an endophytic whorl-forming Streptomyces from Catharanthus roseus stems producing polyene macrolide antibiotic[J]. Canadian Journal of Microbiology, 2012, 58 (5): 617–627. DOI:10.1139/w2012-034 |
| [16] | Singh SP, Gaur R. Evaluation of antagonistic and plant growth promoting activities of chitinolytic endophytic actinomycetes associated with medicinal plants against Sclerotium rolfsii in chickpea[J]. Journal of Applied Microbiology, 2016, 121 (2): 506–518. DOI:10.1111/jam.2016.121.issue-2 |
| [17] | Shirling EB, Gottlieb D. Methods for characterization of Streptomyces species[J]. Int J Syst Bacteriol, 1996, 16 (3): 313–340. |
| [18] | 檀建新, 陈忠义, 张杰, 等. 产几丁质酶菌的分离鉴定及其抑菌作用的初步研究[J]. 植物保护, 2001, 27(2): 1–3. |
| [19] | Coombs JT, Franco CMM. Isolation and identification of actinobacteria from surface-sterilized wheat roots[J]. Applied and Environmental Microbiology, 2003, 69 (9): 5603–5608. DOI:10.1128/AEM.69.9.5603-5608.2003 |
| [20] | Kim OS, Cho YJ, Lee K, et al. Introducing EzTaxon-e: a prokaryotic 16S rRNA gene sequence database with phylotypes that represent uncultured species[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62 (3): 716–721. |
| [21] | Sarwar M, Kremer RJ. Determination of bacterially derived auxins using a microplate method[J]. Letters in Applied Microbiology, 1995, 20 (5): 282–285. DOI:10.1111/j.1472-765X.1995.tb00446.x |
| [22] | Zhang JX, Xue AG. Biocontrol of sclerotinia stem rot (Sclerotinia sclerotiorum) of soybean using novel Bacillus subtilis strain SB24 under control conditions[J]. Plant Pathology, 2010, 59 (2): 382–391. DOI:10.1111/ppa.2010.59.issue-2 |
| [23] | Passari AK, Mishra VK, Saikia R, et al. Isolation, abundance and phylogenetic affiliation of endophytic actinomycetes associated with medicinal plants and screening for their in vitro antimicrobial biosynthetic potential[J]. Frontiers in Microbiology, 2015, 6 : 273. |
| [24] | Golinska P, Wypij M, Agarkar G, et al. Endophytic actinobacteria of medicinal plants: diversity and bioactivity[J]. Antonie Van Leeuwenhoek, 2015, 108 (2): 267–289. DOI:10.1007/s10482-015-0502-7 |
| [25] | Nagpure A, Choudhary B, Kumar S, et al. Isolation and characterization of chitinolytic Streptomyces sp. MT7 and its antagonism towards wood-rotting fungi[J]. Annals of Microbiology, 2014, 64 (2): 531–541. DOI:10.1007/s13213-013-0686-x |
| [26] | 窦桂铭, 刘晓瑜, 张银东, 等. 大豆菌核病拮抗内生细菌的筛选与鉴定[J]. 广东农业科学, 2013, 40(7): 78–82. |