2. 南开大学生命科学学院,天津 300071
2. College of Life Science, Nankai University, Tianjin 300071
蒜薹即抽薹大蒜的花茎,不但营养丰富,鲜嫩可口,还含有大量具有氧化、杀菌、抗癌、抗动脉硬化的硫化物,因此深受国内外消费者的青睐[1]。目前,蒜薹是我国蔬菜冷藏业中贮藏量最大、贮藏期最长的蔬菜品种之一[2]。但由于其生产具有季节性、区域性等特点,且鲜蒜薹含水量高,采后呼吸作用旺盛,易受到老化、霉变、气体伤害等多种原因影响而引起贮藏期蒜薹大量腐烂变质,损失率高达30%-40%,其中,致病菌的侵染是导致蒜薹贮藏过程中腐烂损失的主要原因,成为蒜薹采后保鲜工作的重点[3]。蒜薹致病菌中致病力较强的是葡萄孢属,特别是灰葡萄孢霉,发病率为100%,造成蒜薹灰霉病[4]。贮藏过程中,控制蒜薹病害的主要手段是使用化学杀菌剂,包括可菌灵,抑菌灵,敌霉灵,多霉灵和速克灵等[5]。然而,传统的化学保鲜剂会使病原菌产生抗药性问题,并且使用量过大或残留量过多也会对人体和环境产生一定的危害。因此,迫切需要开发绿色、安全的生物防治方法。
芽孢杆菌 (Bacillus) 是一类好氧、内生芽孢的革兰氏阳性细菌,在自然界中广泛存在,其营养简单、生长快,芽孢能忍受极端的外部环境而长期存活,因此有利于生防菌剂的生产、加工及在环境中的存活、定殖与繁殖,而且批量生产工艺简单,成本较低,施用方便,储存期长,是一种理想的生防微生物[6, 7]。目前,芽孢杆菌已在水稻、小麦、玉米、棉花、黄瓜、辣椒等农作物采前病害的防治上应用,并显现出很好的效果[8]。同时大量的研究表明,芽孢杆菌可以控制采后水果的多种疫病,如苹果霉心病、柑橘青霉病、油桃褐腐病、香蕉枯萎病、炭疽病、苹果梨青霉病、黑斑病及金花梨果腐病[9]。关于芽孢杆菌对果蔬采后灰葡萄孢霉的抑制作用相关研究也很多,如草莓、葡萄、番茄的灰霉病等[10-12]。但芽孢杆菌应用于蒜薹采后病害防治及其作用时效性的研究相对较少,因此研究利用芽孢杆菌来控制蒜薹采后病害对绿色生态农业的发展具有重要意义。本研究初步鉴定保存的4种芽孢杆菌,并探究其对蒜薹灰葡萄孢霉在离体条件下的抑制作用,以及20℃活体条件下4种芽孢杆菌对灰葡萄孢霉抑制作用的时效性和对蒜薹保鲜效果的影响,从而为蒜薹灰霉病的生物防治提供理论依据和技术支撑。
1 材料与方法 1.1 材料 1.1.1 植物材料广饶蒜薹采收 (2016年5月20-25日) 后运到国家农产品保鲜工程技术研究中心,置于0℃冷库预冷,剔除有机械伤、病虫害及细弱的蒜薹,除去薹茎上的叶鞘,以1 kg每把捆扎,用0.045 cm PVC (聚氯乙烯) 硅窗袋装好,于0±0.5℃贮藏备用。
1.1.2 供试菌株病原菌由本试验室从感病的蒜薹上分离获得,经纯化、回接及DNA鉴定,确定为灰葡萄孢霉 (Botrytis cinerea)。芽孢杆菌HB-2、B001、B579由天津市植物保护研究所提供,芽孢杆菌B1为本实验室保存菌种。
1.1.3 培养基NA培养基:牛肉膏3 g,蛋白胨8 g,蒸馏水1 000 mL,pH7.0-7.2;PDB培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,自然pH值;PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,自然pH值。
1.2 方法 1.2.1 芽孢杆菌的分类鉴定 1.2.1.1 形态特征将4种芽孢杆菌在NA固体平板上30℃培养2 d,根据性状、颜色、透明度等菌落形态进行观察,并进行革兰氏染色,在显微镜下观察菌体形态进行初步鉴定[13]。
1.2.1.2 16S rDNA序列测定及同源性比对采用常规CTAB法[14]用DNA提取试剂盒 (北京天根生化科技有限公司) 分别提取4种芽孢杆菌基因组DNA。选用细菌通用引物27F (5'-AGAGTTTGATCCTGGCTCAG-3') 和1492R (5'-TACGGHTACCTTGTTACGACTT-3') 扩增16S rDNA基因序列。PCR反应体系 (50 μL) 为:模板10×PCR buffer 5 μL、dNTP (10 mmol/L)4 μL、MgCl2(25 mmol/L)5 μL、模板5 μL、Taq DNA聚合酶0.1 μL、引物各2 μL,ddH2O 26.9 μL。反应条件为:94℃预变性2 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环,最后72℃延伸10 min。纯化后的PCR产物送上海生工生物化学有限公司进行测序。将测序结果与GenBank数据库中的已知序列进行BLAST比对分析,寻找具有较高同源性的16S rDNA序列,并利用MEGA 5.0软件的Neighbor-Joining进行系统发育分析,构建系统发育树。
1.2.2 四种芽孢杆菌对灰葡萄孢霉病原菌菌落扩展的抑制作用4种芽孢杆菌在NA培养基中活化48 h,将PDA平板上培养5 d的灰葡萄孢霉打成直径6 mm的菌饼,接种于PDA培养皿中央,在其周围2.5 cm处等距离放4片灭菌滤纸片 (直径为8 mm),分别滴加20 μL:(1) 活菌液:芽孢杆菌菌液 (2) 过滤液:菌液8 000 r/min离心10 min,上清过0.22 μm滤膜后的液体 (3) 热处理液:加热煮沸15 min后冷冻30 min灭活的菌液 (4) 无菌水。置于20±0.5℃条件下培养,观察菌落发展变化并于5 d后拍照统计抑菌圈直径。实验重复3次。
1.2.3 四种芽孢杆菌对灰葡萄孢霉病原菌菌丝体的抑制作用用直径为8 mm的打孔器打取6块灰葡萄孢霉的菌饼放入装有50 mL PD液体培养基的150 mL的已灭菌三角瓶中,同时加入2 mL NA培养基中活化48 h的芽孢杆菌菌液,对照三角瓶中加入等量体积的无菌水,摇匀后牛皮纸密封,放入水浴振荡器中震荡培养 (20±0.5℃,100 r/min)7 d后,将培养液用中性滤纸过滤,得到的菌丝体再用灭菌后的蒸馏水冲洗3次,然后在赤红外水分测定仪中105℃条件下烘干至恒重。各处理设3个重复,实验重复3次。

挑取平板上生长在芽孢杆菌菌株边缘的灰葡萄孢霉菌丝和对照中正常生长的灰葡萄孢霉菌丝于OLYMPUS BX51显微镜下对比观察菌丝形态特征。
1.2.5 四种芽孢杆菌的时效性实验蒜薹用75%乙醇进行表面消毒,每根用无菌针刺破3个伤口。
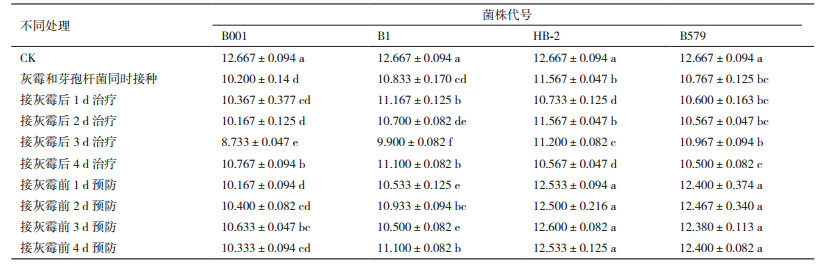
治疗处理:已消毒的蒜薹在第0 d全部接种灰葡萄孢霉菌饼,并分别于第0、1、2、3、4 d在伤口接种30 μL已活化48 h的4种芽孢杆菌,以第0 d只接种灰葡萄孢霉菌饼的蒜薹作为对照。每个处理5根蒜薹设3个重复。
预防处理:取已活化48 h的4种芽孢杆菌,在蒜薹的每个伤口加入30 μL。分别于第0、1、2、3、4 d在伤口接种灰葡萄孢霉菌饼,以第0 d只接种灰葡萄孢霉菌饼的蒜薹作为对照。每个处理5根蒜薹设3个重复。
处理后的蒜薹置于20±0.5℃下贮藏。在接种灰葡萄孢霉后第7 d、9 d、11 d、13 d、15 d测量病斑直径,并在第15 d取各个处理的5根整根蒜薹作为一个整体,测量每个处理3个重复的蒜薹品质指标。实验重复3次。
1.2.6 指标测试用游标卡尺测量抑菌圈直径和病斑大小;通过便携式糖度计测定可溶性固形物含量;采用碘量法测定Vc含量[15];采用NaOH滴定法测定可滴定酸含量[16]。
1.2.7 数据分析采用SPSS统计软件对实验数据进行显著性分析,差异显著性水平为0.05。
2 结果 2.1 四种芽孢杆菌的分类鉴定结果 2.1.1 芽孢杆菌的形态特征形态观察结果显示:芽孢杆菌B579、B001在NA培养基上呈圆形,乳白色或微黄色,半透明,表面光滑湿润稍隆起,边缘整齐,革兰氏染色呈阳性,菌体呈杆状;芽孢杆菌B1和HB-2在培养基平板上呈圆形,乳白色,半透明,表面湿润,周围光滑,中央凸起,革兰氏染色呈阳性,菌体呈杆状。
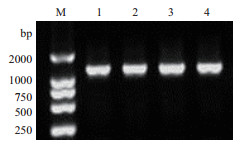
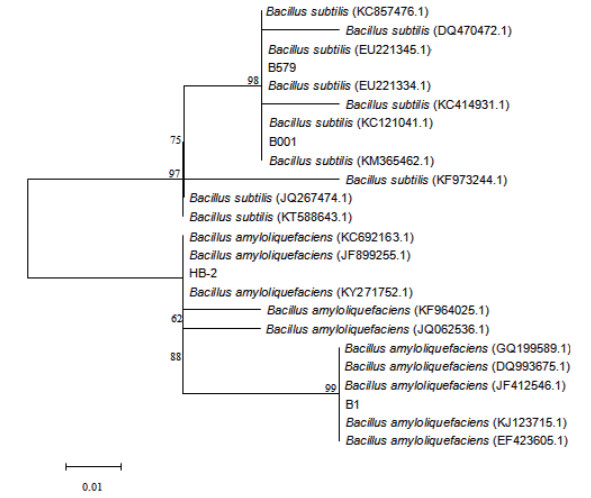
2.1.2 16S rDNA序列测定及系统发育分析16S rDNA纯化产物的1%琼脂糖凝胶电泳 (图 1),其中大部分PCR产物条带清晰且单一。对4种芽孢杆菌的16S rDNA序列相似性进行比对分析,构建系统发育树 (图 2)。菌株B579与Bacillus subtilis(EU221345.1) 和Bacillus subtilis(EU221334.1) 的亲缘关系最近,可初步鉴定为枯草芽孢杆菌 (Bacillus subtilis);菌株B001与Bacillus subtilis(KC121041.1) 和Bacillus subtilis(KM365462.1) 的进化距离最接近,可鉴定为枯草芽孢杆菌 (Bacillus subtilis)。菌株HB-2与Bacillus amyloliquefaciens(JF899255.1) 的相似性最高,初步鉴定为解淀粉芽孢杆菌 (Bacillus amyloliquefaciens);B1与Bacillus amyloliquefaciens(JF412546.1) 和Bacillus amyloliquefaciens(KJ12371-5.1) 最相近,鉴定为解淀粉芽孢杆菌 (Bacillus amyloliquefaciens)。
|
| 图 1 四种芽孢杆菌的16S rDNA基因扩增产物电泳图谱 1:B001;2:B1;3:HB-2;4:B579;M:DNA Marker |
|
| 图 2 基于16S rDNA的系统发育树 |
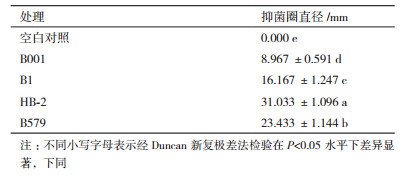
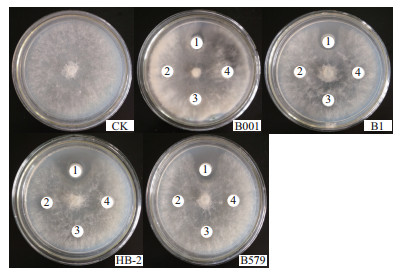
离体实验结果表明4种芽孢杆菌对灰葡萄孢霉病原菌菌落扩展均具有抑制作用 (图 3)。4种芽孢杆菌都是滴加活菌液的滤纸片周围产生明显的透明抑菌圈,而滴加过滤液、热处理液和无菌水的滤纸片周围均没有观察到抑菌圈的产生。同时,通过对平板上灰葡萄孢霉的生长形态观察发现,靠近抑菌圈边缘的病原菌菌丝都出现不同程度的被抑制现象,表现如下:菌丝向上生长且扭曲成结,菌丝变粗,颜色变深变暗。而对照菌落表现为菌落边缘生长比较规整,平铺生长,菌丝在平板上分布均匀,无缠绕现象。4种芽孢杆菌对灰葡萄孢霉抑菌圈直径的影响,见表 1。芽孢杆菌B001、B1、HB-2、B579周围形成的抑菌圈的直径分别为8.967 mm、16.167 mm、31.033 mm、23.433 mm,抑菌圈直径越大,说明芽孢杆菌对灰葡萄孢霉的抑制效果越明显。通过显著性差异分析表明,4种芽孢杆菌对抑制灰葡萄孢霉的菌落扩展作用显著且效果HB-2﹥B579﹥B1﹥B001(P < 0.05)。
|
| 图 3 四种芽孢杆菌对灰葡萄孢霉病原菌菌落扩展的抑制效果 1:20 μL芽孢杆菌菌液;2:20 μL过滤液;3:20 μL热处理液;4:20 μL无菌水. |
4种芽孢杆菌对灰葡萄孢霉病原菌菌丝体生长具有一定的抑制作用,如表 2所示,加入芽孢杆菌B001、B1、HB-2、B579的灰葡萄孢霉的菌丝体干重显著小于空白对照组,对菌丝生长的抑制率分别为21.36%、37.77%、77.16%和54.70%。通过显著性差异分析表明,4种芽孢杆菌对灰葡萄孢霉菌丝体生长的抑制作用显著且效果HB-2﹥B579 ﹥B1﹥B001(P < 0.05)。
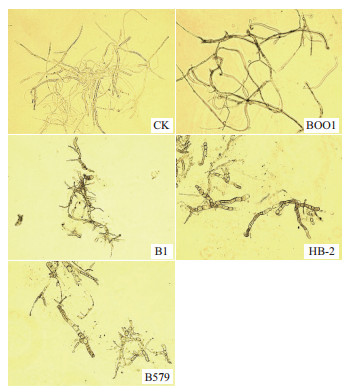
实验中4种芽孢杆菌均能够影响灰葡萄孢霉病原菌菌丝体形态。如图 4所示,在光学显微镜下,空白对照的灰葡萄孢霉菌丝细长且粗细均匀,表面光滑,分支少,间节长,顶端渐尖,原生质分布均匀;而拮抗菌处理组抑菌圈边缘的灰葡萄孢霉菌丝呈现明显的形态异常:菌丝扭曲且粗细不均,分支多,节间缩短、变粗,顶端膨大,原生质收缩,出现空泡。
|
| 图 4 显微镜下不同处理的灰葡萄孢霉菌丝形态 (100×) |
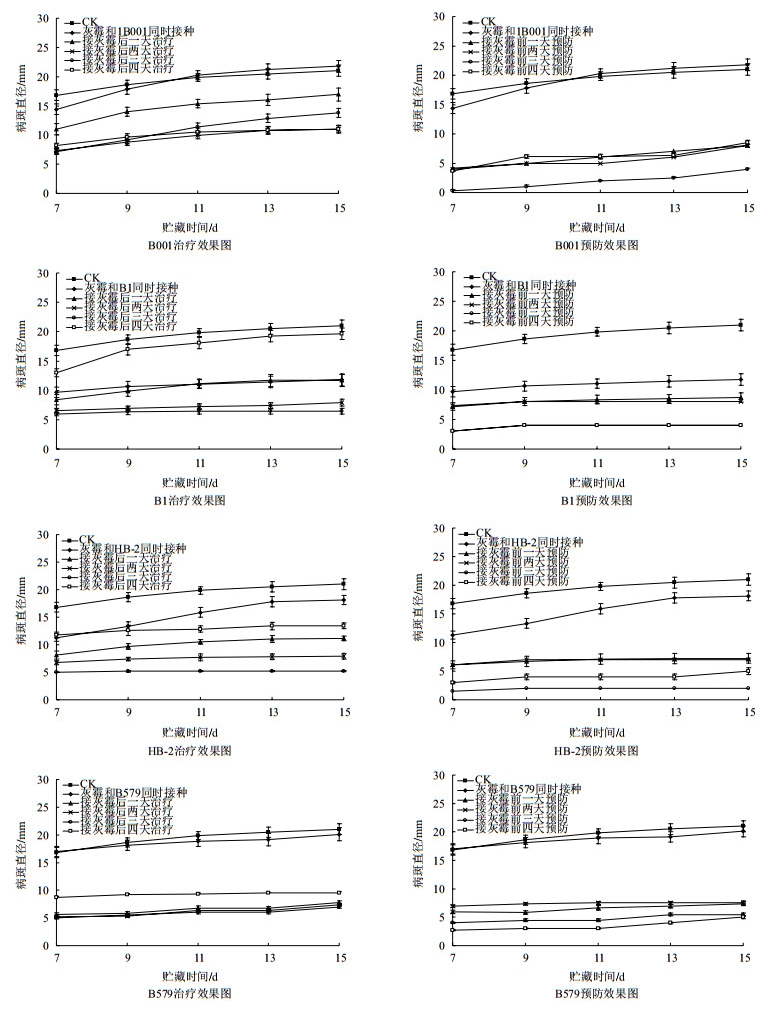
蒜薹活体接种灰葡萄孢霉之后,随着贮藏时间的延长,病斑直径逐渐增大。使用4种芽孢杆菌对其进行预防和治疗试验时,均能够使灰葡萄孢霉病斑直径增长速度减慢,甚至不再增大,4种芽孢杆菌对蒜薹灰霉病的预防效果均好于治疗效果。具体结果如图 5所示,B001:和灰葡萄孢霉同时接种组与只接种灰葡萄孢霉的对照组相比,病斑直径无显著差异,而治疗和预防各组相对于对照组病斑直径显著减小,其中,提前3 d进行预防的效果显著好于其余各组;B1:各处理组相对于对照组都显著减小了病斑直径,其中,前3 d和前4 d预防组的病斑直径显著小于其余各组;HB-2:治疗各组、预防各组以及同时接种组相对于对照组都显著减小了病斑直径,其中,提前3 d进行预防的效果较好;B579:同时接种组与对照组的病斑直径无显著差异,其余各处理组均显著减小但相互之间差异不显著,前3 d和前4 d预防组的效果较好。
|
| 图 5 四种芽孢杆菌对蒜薹病斑扩展的时效性效果图 |
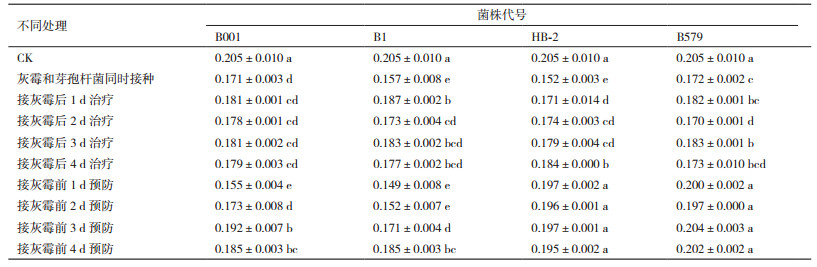
蒜薹感染灰葡萄孢霉后品质下降,从表 3、4和5可以看出:B001处理的各组与对照组相比,可溶性固形物、维C含量以及可滴定酸含量都显著下降;B1处理的各组蒜薹可溶性固形物、维C含量以及可滴定酸含量比对照组也显著减少;HB-2预防处理的各组与对照组相比,可溶性固形物、维C含量以及可滴定酸含量无显著差异,其余各组3者含量均显著下降;B579预防各组蒜薹的可溶性固形物、维C以及可滴定酸含量与对照组无显著差异,其余各组3者含量都显著减少。
经过鉴定,本研究中所用菌株B579、B001为枯草芽孢杆菌 (Bacillus subtilis);B1和HB-2为解淀粉芽孢杆菌 (Bacillus amyloliquefaciens)。芽孢杆菌的生物防治作用机制多种多样,主要包括竞争作用、拮抗作用、溶菌作用、诱导植物产生抗性及促进植物生长5个方面[17]。本研究离体实验中,观察到4种芽孢杆菌的活菌体周围产生抑菌圈,而过滤液、热处理液、和无菌水对照滤纸片周围没有抑菌圈产生。这表明芽孢杆菌活菌菌体对灰葡萄孢霉的扩展产生了抑制作用,而经过加热之后死亡的菌体没有抑制作用。另外,过滤液对灰葡萄孢霉扩展没有抑制作用,可能是由于滤液中芽孢杆菌的分泌物对灰葡萄孢霉没有抑制作用,或者由于本实验中过滤液中含有的抑菌活性物质浓度较低,不能形成明显的抑制作用。因此,芽孢杆菌分泌物对灰葡萄孢霉是否有抑制作用,还需要进一步的验证。通过深入研究影响芽孢杆菌分泌活性物质的条件因素以及活性物质的成分和抑菌活性,最终明确4种芽孢杆菌对灰葡萄孢霉的作用机制。通常丝状真菌的生长表现为顶端生长,但本研究在光学显微镜下观察发现,4种芽孢杆菌抑菌圈边缘的灰葡萄孢霉菌丝顶端膨大变形,这就阻碍了菌丝继续生长,从而形成了对峙培养时的拮抗圈。而抑菌圈边缘的菌丝扭曲且粗细不均,原生质收缩,出现空泡,则可能是芽孢杆菌对灰葡萄孢霉产生了溶菌作用。溶菌作用是拮抗微生物通过吸附在病原真菌的菌丝上,并随着菌丝生长而生长,消解菌丝体,使菌丝畸形发生断裂、解体、细胞质消解,有的还会促使菌丝原生质凝结[17]。Liu等[18]发现枯草芽孢杆菌B.916使Rhizoctoniasolani菌丝顶端肿大、破裂。黄现青等[19]研究发现枯草芽孢杆菌fmbJ对点青霉孢子具有溶解作用。因此推断本研究中4种芽孢杆菌主要通过溶菌作用对灰葡萄孢霉菌丝体的生长产生抑制作用。4种芽孢杆菌中,HB-2对灰葡萄孢霉菌落扩展和菌丝体生长的抑制作用更加显著。
本研究活体实验中,4种芽孢杆菌预防组相对于只接种病原菌的对照组皆显著减小了病斑直径并减缓了病斑的扩展速度,而且效果好于治疗各组。这可能是由于预防处理的芽孢杆菌能在蒜薹上提前繁衍和定殖,形成竞争优势,从而抑制了后来接种的灰葡萄孢霉的生长;而治疗效果不好的原因可能是先接种灰葡萄孢霉使之形成了生长优势,随后使用芽孢杆菌治疗则竞争不过病原菌,所以效果不佳。4种芽孢杆菌抑制蒜薹病斑扩展的时效性有所不同:B001和HB-2提前3 d进行预防最好,B1提前3 d和4 d效果佳,而B579的各种预防处理效果无差异,提前3 d和提前4 d预防的效果都较好。这可能与不同芽孢杆菌的生长特点,对灰葡萄孢霉抑制能力以及两者之间形成的微环境不同有关。芽孢杆菌HB-2和B579也对蒜薹品质的保持产生了作用。可溶性固形物含量是反映果蔬贮藏期间的营养品质指标,主要包括可溶性糖以及其他一些可溶性有机质;蒜薹中维生素C含量丰富,其含量的高低是衡量营养成分的重要指标;可滴定酸也对蒜薹品质有着重要影响[20]。HB-2和B579预防各组蒜薹的可溶性固形物、维C含量以及可滴定酸含量与对照组无显著差异,表明芽孢杆菌HB-2和B579可以有效地减缓蒜薹中可溶性固形物,Vc和可滴定酸的减少,从而保证了蒜薹的营养品质。刘璐等[21]研究发现使用胶冻样芽孢杆菌能有效提高赤霞珠葡萄的光合特性,增强果实品质;肖嫩群等[22]研究接种芽孢杆菌B13能够改良白菜的生物性状,还能提高白菜的产量和品质,都与本研究结果一致。
本实验中的4种芽孢杆菌在离体条件下对蒜薹灰葡萄孢霉均具有较好的抑菌效果,并且HB-2和B579对活体蒜薹也有较好的保鲜作用。本研究的4种芽孢杆菌活体实验针对的是少量单独的蒜薹进行的,但对成袋批量的蒜薹抑菌能力是否和前者相同,抑制效果是否受其他因素影响,对实验以外的病原菌是否有抑制作用,以及能否增加蒜薹的抗病性,都仍需进一步研究验证。
4 结论本研究对保存的4种芽孢杆菌菌株种属水平做初步鉴定并利用它们进行离体实验和活体实验,检测了它们对蒜薹灰葡萄孢霉的抑菌作用以及对蒜薹保鲜的时效性。解淀粉芽孢杆菌HB-2在离体实验中对灰葡萄孢霉菌落扩展和菌丝体生长的抑制作用更加显著,并且芽孢杆菌HB-2和B579活体实验中的预防处理也能较好地保持蒜薹的品质,具有潜在的开发价值。
| [1] | 王向鹤, 裴占江, 王粟, 等. CO2气肥对北方棚室蒜薹生长发育及品质的影响[J]. 湖北农业科学, 2015, 54(12): 2919–2923,2953. |
| [2] | 薛婷, 陈丽, 李喜宏, 等. 蒜薹采后病原真菌鉴定及侵染特点的研究[J]. 安徽农业科学, 2006, 34(3): 513–515. |
| [3] | 刘丽影. 影响蒜薹物流质量安全的病害诊断及致病性研究[D]. 上海: 华东师范大学, 2013. |
| [4] | 赵淑艳, 陈丽, 李喜宏, 等. 蒜薹采后病原菌种类及侵染规律研究[J]. 中国农学通报, 2005, 21(9): 74–78. |
| [5] | 薛婷. 蒜薹采后病害与生防拮抗菌的筛选研究[D]. 天津: 天津科技大学, 2006. |
| [6] | Turner JT, Backman PA. Factors relating to peanut yield increases after seed treatment with Bacillus subtilis[J]. Plant Disease, 1991, 75 (4): 347–353. DOI:10.1094/PD-75-0347 |
| [7] | 赵新林, 赵思峰. 枯草芽孢杆菌对植物病害生物防治的作用机理[J]. 湖北农业科学, 2011, 50(15): 3025–3028. DOI:10.3969/j.issn.0439-8114.2011.15.001 |
| [8] | 刘雪, 穆常青, 蒋细良, 等. 枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用[J]. 中国生物防治, 2006, 22(增刊): 179–184. |
| [9] | 穆常青. 枯草芽孢杆菌B-332菌株及其抗菌物质对稻瘟病的生防作用研究[D]. 北京: 中国农业科学院, 2006: 8-10. |
| [10] | 赵妍, 邵兴锋, 屠康, 等. 枯草芽孢杆B10对采后草莓果实病害的抑制效果[J]. 果树学报, 2007, 24(3): 339–343. |
| [11] | 伏波, 姚娟妮, 高小宁, 等. 植物内生枯草芽孢杆菌Em7菌株对葡萄灰霉病菌的抑菌活性[J]. 农药学学报, 2016, 18(4): 465–471. |
| [12] | 魏东盛, 陈云芳, 刘大群. 芽孢杆菌B21菌株及其发酵液对番茄灰霉菌C31的影响[J]. 河北农业大学学报, 2002, 25(4): 73–79. |
| [13] | 黄秀梨. 微生物学实验指导[M]. 北京: 高等教育出版社, 1999. |
| [14] | Hillis DM, Moritz CM, Mable BK. Molecular Systematics[M]. MasSachusetts: Sinauer Associates, 1990: 411-501. |
| [15] | 库尔班江, 赛丽曼. 碘量法测水果蔬菜中维生素C的含量[J]. 伊犁师范学院学报:自然科学版, 2007(3): 28–31. |
| [16] | 李合生, 孙群, 赵世杰, 等.植物生理生化实验原理与技术[M].北京:高等教育出版社, 2000: 123-124, 195-197, 246-268. |
| [17] | 黄曦, 许兰兰, 黄荣韶, 等. 枯草芽孢杆菌在抑制植物病原菌中的研究进展[J]. 生物技术通报, 2010(1): 24–28. |
| [18] | Liu Y, Chen Z, NG TB, et a1. Bacisubin, an antifungal protein with ribonuclease and hemagglutinating activities from Bacillussubtilis strainB-916[J]. Peptidkes, 2007 (28): 553–559. |
| [19] | 黄现青, 别小妹, 吕凤霞, 等. 枯草芽孢杆菌fmbJ产脂肽抑制点青霉效果及其桃防腐试验[J]. 农业工程学报, 2008, 24(1): 263–267. |
| [20] | 周晓琳, 牟文良, 王庆国. 切除薹苞处理对蒜薹货架期品质的影响[J]. 保鲜与加工, 2012, 12(2): 20–23. |
| [21] | 刘璐, 代红军, 王振平. 胶冻样芽孢杆菌对赤霞珠葡萄光合作用及果实品质的影响[J]. 农业科学研究, 2016, 37(2): 25–28. |
| [22] | 肖嫩群, 黄晓辉, 胡汝晓, 等. 芽孢杆菌B13对白菜产量和品质的影响[J]. 中国微生态学杂志, 2014, 26(1): 27–30,33. |