漆酶是一种含有多个铜离子的多酚氧化酶,可催化氧化多种难降解有机污染物,包括氯酚类污染物、多环芳烃、染料、氯仿、苯系物及其衍生物、三硝基甲苯(Trinitrotoluene,TNT)及其他污染物,在水污染的防治与控制中具有良好的应用前景[1]。且漆酶催化底物广泛,贮存要求低,氧化底物不产生二次污染等优势,自漆酶发现以来,漆酶的开发与研究一直是国内外学者研究的热点。
漆酶来源广泛,可存在于高等植物、细菌、真菌和昆虫中,不同物种中漆酶的含量、催化部位的结构和酶学性质差异较大,筛选高漆酶活性的动植物和微生物一直是漆酶研究的重点[2-4]。由于游离态的漆酶对外部环境敏感、稳定性差和重复利用率低,一些学者提出了漆酶固定化的方法,大大改善了漆酶在催化过程中易失活的问题,提高了漆酶的利用率。合适的载体是漆酶固定化的关键,廉价高效的载体可以提高漆酶固定化的效率和酶活的稳定性。近年来,随着漆酶固定化研究以及材料等相关研究领域的快速发展,越来越多高效的固定化载体被发现,极大地推动了固定化漆酶的工业化应用。
本文根据国内外最近研究进展,总结了漆酶的来源及漆酶固定化载体研究进展,指出了目前漆酶研究存在的问题,并提出未来的研究方向,旨在为漆酶的开发与应用研究提供参考。
1 漆酶的来源 1.1 动植物漆酶漆酶来源广泛,存在于一些高等植物、细菌、真菌和昆虫体内。按漆酶的来源可分为植物漆酶、动物漆酶和微生物漆酶3类,其中植物漆酶发现最早,但高等植物的漆酶的研究相对较少。目前,已发现漆酶的植物有日本漆树、欧亚槭树、拟南芥、水稻、松树、黄杨、棉花、芒果和香蕉等[5, 6]。相比其他两类漆酶,对动物漆酶的研究报道最少,存在漆酶的动物(昆虫)有猪、烟草天蛾、绿头苍蝇、蚊子及双翅目的迁移类蝗虫等。然而,一些学者指出动物漆酶可能是某种多酚氧化酶,并不属于严格意义上的漆酶,关于动物漆酶性质的确定还需要进一步的研究。
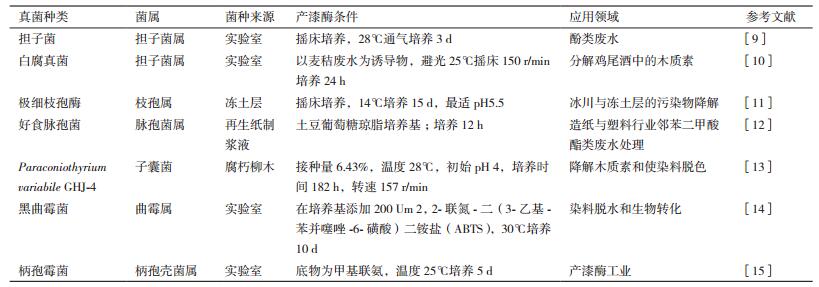
1.2 微生物漆酶动植物漆酶一般生长周期长,同时还受地理、气候和季节等因素的限制,不适于大规模工业化生产。微生物生长周期短,繁殖快,且易于提取与纯化,微生物漆酶是工业漆酶的重要来源。微生物漆酶可分为真菌漆酶和细菌漆酶,其中真菌漆酶的研究较多。据统计,截至目前,已发现的产漆酶真菌超过1 000种,分离提纯的真菌漆酶超过100多种[7]。真菌漆酶的研究主要以担子菌、脉孢菌、子囊菌、曲霉和柄孢壳菌等为主,其中以高等担子菌中的白腐真菌被认为是主要的真菌漆酶生产者和研究对象,由于白腐真菌漆酶属于胞外酶,更易于分离和提纯[8]。表 1总结了典型产漆酶真菌的种类和特性。
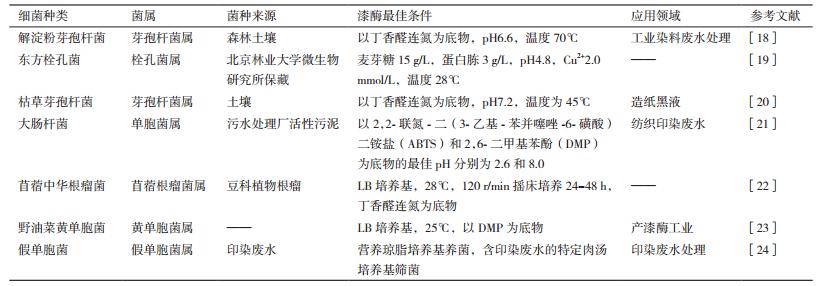
相比真菌漆酶,细菌漆酶的研究相对较晚。细菌漆酶首次发现是由Givaudan在1993年在从水稻根围的土壤中分离的脂固氮螺菌中发现的,随后在交互单胞菌、芽孢杆菌、球形芽孢杆菌、大肠杆菌、苜蓿中华根瘤菌、野油菜黄单胞菌等中均有所发现。表 2总结了一些典型产漆酶细菌的种类和特点。一般来说,真菌漆酶的pH适用范围为4-6,温度为30-50℃[16],且真菌漆酶活性易受外部环境的影响,氯化物、叠氮化合物、氢氧化物等化合物均能抑制漆酶活性[17]。而细菌漆酶适用pH一般为碱性条件,且对外部环境不敏感,耐热性更强。因此,广泛开展细菌漆酶的研究将具有重要的意义。
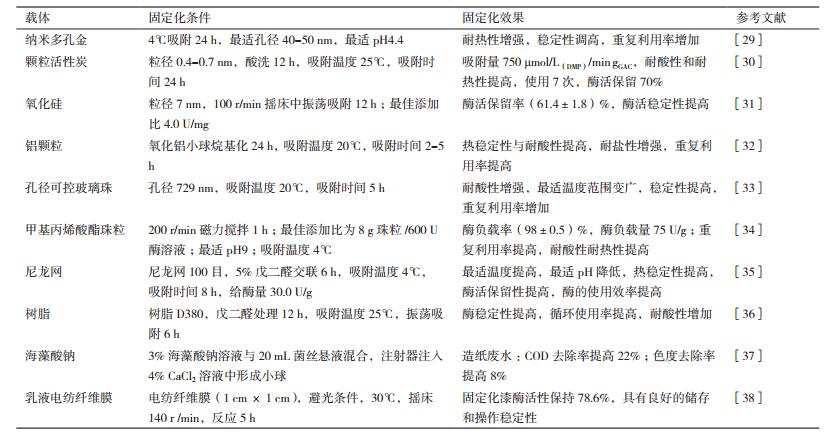
漆酶是一种水溶性蛋白酶,与其他游离酶一样,稳定性较差,且在环境中容易失活。漆酶的易失活、稳定性差和重复利用率低等特性,限制了漆酶的工程化应用。一般来说,漆酶的活性受pH、温度和盐度等多种因素的影响。另外,有研究表明,表面活性剂的添加可降低漆酶的失活率[25, 26]。相比添加表面活性剂的方法,漆酶固定化可改善漆酶在催化过程中易失活的问题,提高漆酶的重复利用率,且固定化漆酶对温度、pH以及底物浓度的变化具有更好的承受能力,对外部环境的适应能力更强[27]。固定化载体的选择直接影响漆酶固定化的效率和固定化漆酶活性的高低。一般来说,常用的漆酶固定化载体往往具有以下特点[28]:(1) 载体表面存在与酶分子发生耦联的活性基团;(2) 载体结构稳定,具有良好的机械强度和生物相容性;(3) 载体廉价易得,适用于大规模工业应用。表 3总结了常用漆酶固定化载体的特点及适用条件。
为了进一步提高漆酶固定化的效果,一些研究者对载体进行表面修饰,并取得的良好的效果。张育淇等[39]采用以氨基化表面修饰的SiO2大孔材料为载体,以戊二醛为交联剂对漆酶进行固定化,发现在最佳固定化条件下,固定化漆酶活性达111.4 U/g,且固定化漆酶pH稳定性、热稳定性和重复使用性均得到了提高。宦庆松等[40]以二苯甲酮为光引发剂,甲基丙烯酸为接枝单体,通过紫外光引发接枝到聚丙烯上,对聚丙烯纤维进行表面改性,并进一步研究了固定化漆酶染料脱色的性能。染料脱色试验表明,以改性的聚丙烯纤维为载体固定化漆酶脱色效率和稳定性均有所提高。可见,经过载体加工修饰和改性,使载体材料表面具有更多的功能基团,可提高载体材料的生物相容性,并大大提高固定化漆酶的性能。
纳米磁性复合载体是近年来发展的新型固定化酶载体,通过在传统载体的基础上,引入磁性金属或者金属化氧,使其具有磁响应性能,在外加磁场的作用下,可实现漆酶的快速分离和回收,从而降低反应成本[41]。纳米磁性复合材料不仅具有大孔体积和比表面积,而且且孔径及形貌单一可控,是一种理想的漆酶固定化载体,在漆酶固定化方面具有良好的应用前景。自纳米磁性复合材料提出以来,就受到国内外学者的广泛关注。黄俊等[42]制备了(CuTAPc-)-Fe3O4纳米复合粒子,并对漆酶固定化性能进行了研究,研究表明,采用(CuTAPc-)-Fe3O4纳米复合粒子固定漆酶的固定化率可达78.3%,且提高了固定化漆酶的贮存稳定性与操作稳定性。同样的,赵敏等[43]采用以五氯化磷修饰的磁性海藻酸钠微粒对漆酶固定,发现固定化漆酶最适pH范围更宽,热稳定性和贮存性均得到了提高。
3 展望漆酶是一种多酚氧化酶,可催化氧化多种难降解有机污染物,在环境污染防治领域具有良好的应用前景。但由于其来源有限,价格昂贵,且稳定性差,在环境中易失活等特点,限制了其大规模的应用。通过对漆酶固定化,可有效提高漆酶的稳定性和重复利用性,降低运行成本。
目前,我国关于漆酶应用于环境污染防治方面的研究仍处于实验室研究阶段,工程应用的报道较少,还需进一步研究:
(1) 现今,漆酶主要通过生物制取方式获得,为满足工业化需求,这就必须要有充足的原材料,因此寻求高效产漆酶的动植物和筛选可大规模发酵生产漆酶的微生物,降低漆酶生产成本,将一直是漆酶研究的重点。此外,广泛开展提高漆酶产量的研究,如添加诱导物,降低阻遏物浓度及基因突变等,对推动漆酶的工业化生产和应用具有重要意义。
(2) 进一步开发高效的漆酶固定化技术,优选出高效、稳定的漆酶固定化载体,同时,通过对现有载体进行修饰和改性,提高载体的固定化性能将是未来漆酶固定化研究的一个重要方向。
(3) 研究漆酶与其他污水处理工艺的相互协同作用,优化漆酶的反应条件,进一步提高污水处理效果。此外,加大研究漆酶降解有机污染物的降解机理,进一步扩宽漆酶在水污染防治中的应用。
(4) 细菌漆酶可实现大规模、低成本的工业化生产,同时细菌漆酶具有良好的稳定性及其环境适应性,开展对细菌漆酶的广泛研究具有重要的意义。利用基因工程对微生物进行异源表达,改善漆酶性质,进一步扩宽漆酶的适用范围将是未来研究的一个重要方向。
| [1] | 慎镛健, 张蓓蓓, 徐昌, 等. 漆酶的研究及进展[J]. 黑龙江环境通报, 2015, 39(2): 59–63. |
| [2] | 司静, 崔宝凯, 贺帅, 等. 微酸多年卧孔菌产漆酶条件优化及其在染料脱色中的应用[J]. 应用与环境生物学报, 2011, 17(5): 736–741. |
| [3] | 司静, 李伟, 崔宝凯, 等. 真菌漆酶性质, 分子生物学及其应用研究进展[J]. 生物技术通报, 2011(2): 48–55. |
| [4] | 司静, 崔宝凯. 绒毛栓孔菌液体培养过程中胞外酶活性的研究[J]. 基因组学与应用生物学, 2012, 31(1): 70–77. |
| [5] | Hüttermann A, Mai C, Kharazipour A. Modification of lignin for the production of new compounded materials[J]. Applied Microbiology and Biotechnology, 2001, 55 (4): 387–394. DOI:10.1007/s002530000590 |
| [6] | Sterjiades R, Dean JFD, Eriksson KEL. Laccase from sycamore maple(Acer pseudoplatanus)polymerizes monolignols[J]. Plant Physiology, 1992, 99 (3): 1162–1168. DOI:10.1104/pp.99.3.1162 |
| [7] | Baldrian P. Fungal laccases-occurrence and properties[J]. FEMS Microbiology Reviews, 2006, 30 (2): 215–242. DOI:10.1111/j.1574-4976.2005.00010.x |
| [8] | 周雪婷, 张跃华, 罗志文, 等. 真菌漆酶的研究进展及其应用前景[J]. 农业与技术, 2012, 32(9): 2–4. |
| [9] | 肖亚中, 张书祥, 胡乔彦, 等. 壳聚糖固定化真菌漆酶及其用于处理酚类污染物的研究[J]. 微生物学报, 2003, 43(2): 245–250. |
| [10] | Parenti A, Muguerza E, Iroz AR, et al. Induction of laccase activity in the white rot fungus Pleurotus ostreatus using water polluted with wheat straw extracts[J]. Bioresource Technology, 2013, 133 : 142–149. DOI:10.1016/j.biortech.2013.01.072 |
| [11] | Dhakar K, Pandey A. Extracellular laccase from a newly isolated psychrotolerant strain of Cladosporium tenuissimum(NFCCI 2608)[J]. Proceedings of the National Academy of Sciences India, 2015 : 1–6. |
| [12] | Sánchez C. Mycelial growth and enzymatic activities of fungi isolated from recycled paper wastes grown on di(2-ethylhexyl)phthalate[J]. Polish Journal of Environmental Studies, 2015 : 24. |
| [13] | 王维乐, 牟志美, 张淑君, 等. 响应面法优化Paraconiothyrium variabile GHJ-4产漆酶发酵条件[J]. 应用与环境生物学报, 2011, 3: 321–325. |
| [14] | Benghazi L, Record E, Suárez A, et al. Production of the Phanerochaete flavido-alba laccase in Aspergillus niger for synthetic dyes decolorization and biotransformation[J]. World Journal of Microbiology and Biotechnology, 2014, 30 (1): 201–211. DOI:10.1007/s11274-013-1440-z |
| [15] | Durand F, Gounel S, Mano N. Purification and characterization of a new laccase from the filamentous fungus Podospora anserine[J]. Protein Expression and Purification, 2013, 88 (1): 61–66. DOI:10.1016/j.pep.2012.11.016 |
| [16] | Hildén K, Hakala TK, Lundell T. Thermotolerant and thermostable laccases[J]. Biotechnology Letters, 2009, 31 (8): 1117–1128. DOI:10.1007/s10529-009-9998-0 |
| [17] | 刘岩, 刘锐, 苏新国, 等. 漆酶的研究进展及其应用[J]. 安徽农学通报, 2016, 22(13): 25–27. DOI:10.3969/j.issn.1007-7731.2016.13.009 |
| [18] | 徐腾飞, 卢磊, 赵敏, 等. 一株产漆酶细菌的分离鉴定及酶学性质研究[J]. 微生物学通报, 2013, 40(3): 434–442. |
| [19] | 司静, 崔宝凯, 戴玉成. 栓孔菌属漆酶高产菌株的初步筛选及其产酶条件的优化[J]. 微生物学通报, 2011, 38(3): 405–416. |
| [20] | 汪春蕾, 赵敏, 杨洪一, 等. 一株产漆酶细菌的分离, 鉴定及对造纸黑液处理的初步研究[J]. 北京林业大学学报, 2011, 33(3): 81–85. |
| [21] | Wu J, Kim KS, Lee JH, et al. Cloning, expression in Escherichia coli, and enzymatic properties of laccase from Aeromonas hydrophila WL-11[J]. Journal of Environmental Sciences, 2010, 22 (4): 635–640. DOI:10.1016/S1001-0742(09)60156-X |
| [22] | Pawlik A, Wójcik M, Rułka K, et al. Purification and characterization of laccase from Sinorhizobium meliloti and analysis of the lacc gene[J]. International Journal of Biological Macromolecules, 2016 : 92. |
| [23] | Solano F, Lucas-Elıo P, López-Serrano D, et al. Dimethoxyphenol oxidase activity of different microbial blue multicopper proteins[J]. FEMS Microbiology Letters, 2001, 204 (1): 175–181. DOI:10.1111/fml.2001.204.issue-1 |
| [24] | Telke AA, Joshi SM, Jadhav SU, et al. Decolorization and detoxification of Congo red and textile industry effluent by an isolated bacterium Pseudomonas sp. SU-EBT[J]. Biodegradation, 2010, 21 (2): 283–296. DOI:10.1007/s10532-009-9300-0 |
| [25] | Majcherczyk A, Johannes C, Hüttermann A. Oxidation of polycyclic aromatic hydrocarbons(PAH)by laccase of Trametes versicolor[J]. Enzyme and Microbial Technology, 1998, 22 (5): 335–341. DOI:10.1016/S0141-0229(97)00199-3 |
| [26] | Modaressi K, Taylor KE, Bewtra JK, et al. Laccase-catalyzed removal of bisphenol-A from water:protective effect of PEG on enzyme activity[J]. Water Research, 2005, 39 (18): 4309–4316. DOI:10.1016/j.watres.2005.08.005 |
| [27] | Dodor DE, Hwang HM, Ekunwe SIN. Oxidation of anthracene and benzo[J]. Enzyme and Microbial Technology, 2004, 35 (2): 210–217. |
| [28] | 胡丽娟, 胡立娜. 漆酶的固定化及研究进展[J]. 科技风, 2013, 18: 77–78. DOI:10.3969/j.issn.1671-7341.2013.01.071 |
| [29] | Qiu H, Xu C, Huang X, et al. Adsorption of laccase on the surface of nanoporous gold and the direct electron transfer between them[J]. Journal of Physical Chemistry C, 2008, 112 (38): 14781–14785. DOI:10.1021/jp805600k |
| [30] | Nguyen LN, Hai FI, Dosseto A, et al. Continuous adsorption and biotransformation of micropollutants by granular activated carbon-bound laccase in a packed-bed enzyme reactor[J]. Bioresource Technology, 2016, 210 : 108–116. DOI:10.1016/j.biortech.2016.01.014 |
| [31] | Zimmermann YS, Shahgaldian P, Corvini PF, et al. Sorption-assisted surface conjugation:a way to stabilize laccase enzyme[J]. Applied Microbiology & Biotechnology, 2011, 92 (1): 169–178. |
| [32] | Abadulla E, Tzanov T, Costa S, et al. Decolorization and detoxification of textile dyes with a laccase from Trametes hirsuta[J]. Applied & Environmental Microbiology, 2000, 66 (8): 3357–3362. |
| [33] | Georgiou RP, Tsiakiri EP, Lazaridis NK, et al. Decolorization of melanoidins from simulated and industrial molasses effluents by immobilized laccase[J]. Journal of Environmental Chemical Engineering, 2016, 4 (1): 1322–1331. DOI:10.1016/j.jece.2016.01.035 |
| [34] | Lettera V, Pezzella C, Cicatiello P, et al. Efficient immobilization of a fungal laccase and its exploitation in fruit juice clarification[J]. Food Chemistry, 2016, 196 : 1272–1278. DOI:10.1016/j.foodchem.2015.10.074 |
| [35] | 张书祥, 肖亚中, 王怡平, 等. 白腐真菌漆酶的固定化及其应用研究[J]. 微生物学通报, 2004, 31(5): 85–88. |
| [36] | 张应鹏, 于银水, 杨云裳. 固定化真菌漆酶对铬蓝黑R的脱色条件[J]. 兰州理工大学学报, 2011, 37(2): 61–63. |
| [37] | 张安龙, 郗文君, 杜飞, 等. 漆酶的形态特性表征及固定化研究[J]. 陕西科技大学学报:自然科学版, 2016, 34(2): 6–11. |
| [38] | 袁钰, 代云容, 宋永会, 等. 乳液电纺纤维膜固定化漆酶及其对水中酚类污染物的降解[J]. 环境工程学报, 2016, 10(1): 88–94. DOI:10.12030/j.cjee.20160114 |
| [39] | 张育淇, 刘晓贞, 李云, 等. 氨基功能化大孔SiO2固定化漆酶[J]. 宁波大学学报:理工版, 2015, 2: 108–113. |
| [40] | 宦庆松, 范雪荣, 王强, 等. 聚丙烯纤维光接枝改性及其在漆酶固定化中的应用[J]. 纺织学报, 2009, 30(10): 80–84. DOI:10.3321/j.issn:0253-9721.2009.10.018 |
| [41] | 马莹莹, 贾红华, 韦萍. 细菌漆酶的研究及应用进展[J]. 生物技术通报, 2013(2): 41–48. |
| [42] | 黄俊, 周菊英, 肖海燕, 等. CuTAPc-Fe3O4纳米复合粒子及其漆酶固定化研究[J]. 化学学报, 2005, 63(14): 1343–1347. DOI:10.3321/j.issn:0567-7351.2005.14.017 |
| [43] | 赵敏, 王玮, 李昕芯, 等. 海藻酸钠磁性微粒的制备及对漆酶的固定化[J]. 中国造纸学报, 2009, 23(4): 94–99. |